Molecular Cell:癌症的“双面蛋白”
2013-03-11 生物通 生物通
一些细胞蛋白具有多种,有时甚至是相反的功能。 来自冷泉港实验室的drian Krainer教授和同事们在新研究中发现,致癌蛋白SRSF1也可以通过稳定p53,触动细胞停止生长,阻止癌性增殖,是一种强有力的抑癌蛋白。其研究成果发表在3月7日的Molecular Cell上。 SRSF1是一种具有多重功能的蛋白质。人们最初描述它是RNA剪接过程的必要条件。它也被证实与RNA代谢的许
一些细胞蛋白具有多种,有时甚至是相反的功能。
来自冷泉港实验室的drian Krainer教授和同事们在新研究中发现,致癌蛋白SRSF1也可以通过稳定p53,触动细胞停止生长,阻止癌性增殖,是一种强有力的抑癌蛋白。其研究成果发表在3月7日的Molecular Cell上。
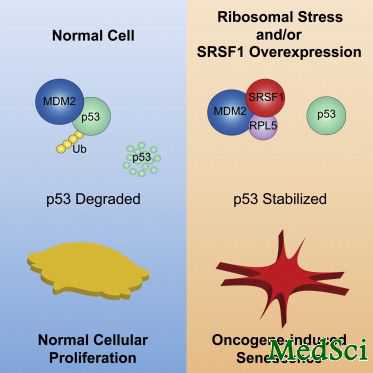
SRSF1是一种具有多重功能的蛋白质。人们最初描述它是RNA剪接过程的必要条件。它也被证实与RNA代谢的许多其他过程相关。
Krainer研究小组从前也证实了SRSF1与癌症有关。他们发现,当在永生成纤维细胞或上皮细胞中过表达时,它驱动了转化,使得细胞以癌性方式生长。它还在包括肺癌、乳腺癌等多种肿瘤中显著高表达。
SRSF1还被证实能够穿梭进出细胞核。这表明,它参与了发生在细胞核或细胞质区室中的各种过程。为了调查SRSF1的不同作用,Krainer实验室前研究生Oliver Fregoso发起了一项研究,寻找与SRSF1互作的其他蛋白。
虽然他获得了大量的“目标”,难题的关键在于如何将信号与噪音分别开来,即确定什么是真正的互作,什么不是。进一步的研究揭示,一种称作RPL5的蛋白与SRSF1发生了特异的互作。核糖体是一种由RNAs和蛋白质构成的大型复合体,负责将mRNA翻译成氨基酸,生成蛋白质。RPL5是核糖体的一个组成部分。
最近,Fregoso博士和Krainer实验室的研究生Shipra Das,一起发现SRSF1与RPL5互作,作为一个复合体的组成部分,没有参与它们各自在剪切或核糖体中的作用。他们证实这一复合体阻止了强有力的肿瘤抑制蛋白p53的降解。
然而Krainer研究小组也证实,原代人类成纤维细胞中SRSF1表达增加会抑制它们增殖,触动细胞衰老程序,导致细胞生长阻滞。“这有点让人感觉惊讶,因为我们已经公布了SRSF1是一种致癌蛋白,而在这里我们发现它稳定了一种肿瘤抑制蛋白。但这看起来像是一个癌基因主题:细胞设法通过经受衰老,对它们的活动做出响应。这是一种细胞不增殖的静止状态,”Krainer说。
冷泉港实验室的Scott Lowe在1997年描述了一种称作癌基因诱导衰老(oncogene induced senescence ,OIS)的过程,在这一过程中细胞对致癌压力做出反应导致细胞周期阻滞。这一研究发现首次表明正常细胞具有一种机制,在适当位置发挥作用阻止向癌细胞转化。
通过确定剪切蛋白SRSF1与核糖体蛋白RLP5之间的相互作用,Krainer的新研究还确定了致癌压力与核糖体压力反应之间的关联。研究人员发现它导致了p53激活和细胞生长阻滞。“我们鉴别了癌蛋白SRSF1抑制自身异常活性的一个新机制,”Das说。“发现SRSF1的这一新作用促进了我们对于肿瘤产生及信号通路转变机制的了解,”Krainer补充说。

doi:10.1016/j.molcel.2013.02.001
PMC:
PMID:
Splicing-Factor Oncoprotein SRSF1 Stabilizes p53 via RPL5 and Induces Cellular Senescence
Oliver I-Fregoso, Shipra Das1, Martin Akerman and Adrian R-Krainer.
Splicing and translation are highly regulated steps of gene expression. Altered expression of proteins involved in these processes can be deleterious. Therefore, the cell has many safeguards against such misregulation. We report that the oncogenic splicing factor SRSF1, which is overexpressed in many cancers, stabilizes the tumor suppressor protein p53 by abrogating its MDM2-dependent proteasomal degradation. We show that SRSF1 is a necessary component of an MDM2/ribosomal protein complex, separate from the ribosome, that functions in a p53-dependent ribosomal-stress checkpoint pathway. Consistent with the stabilization of p53, increased SRSF1 expression in primary human fibroblasts decreases cellular proliferation and ultimately triggers oncogene-induced senescence (OIS). These findings underscore the deleterious outcome of SRSF1 overexpression and identify a cellular defense mechanism against its aberrant function. Furthermore, they implicate the RPL5-MDM2 complex in OIS and demonstrate a link between spliceosomal and ribosomal components, functioning independently of their canonical roles, to monitor cellular physiology and cell-cycle progression.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Cell#
0
#CEL#
65