中科大刘世勇、胡进明AM:含半脲多肽偶联物用于有效的肿瘤化疗和肿瘤转移成像
2023-11-15 BioMed科技 BioMed科技 发表于上海
本研究报道了一种通用、稳健的制备聚(乙二醇)-多聚物(PEG-b)混合嵌段共聚物(HBCPs),通过直接聚合相应的苯氧碳基功能化的α-氨基酸(NPCA)前体,而不是不稳定NCA单体。
多肽材料具有可伸缩性、生物相容性和生物降解性,使其成为生物医学应用的理想平台。然而,制备具有特定官能团的多肽仍然具有挑战性,如氨基脲基团。中国科学技术大学胡进明教授/刘世勇教授等首次报道了直接合成定义明确的含氨基脲的甲氧基端聚(乙二醇)-b多肽杂化嵌段共聚物(HBCPs)。该合成涉及到实现环境稳定的N-苯氧基碳基功能化的α-氨基酸(NPCA)前体的直接聚合,从而避免了不稳定N-羧酸酐(NCA)单体的处理。所得到的含有氨基脲部分的HBCPs使醛/酮衍生物易于功能化,形成pH可裂解的氨基脲键,用于定制药物释放。特别是细胞内pH触发的氨基脲部分的水解恢复最初的氨基脲残基,促进内溶酶体逃逸,从而提高治疗结果。此外,将缺氧探针(Ir(btpna)(bpy)2)整合到pH响应的纳米药物中,可以对酸性和缺氧的肿瘤微环境做出连续反应,从而能够精确检测转移性肿瘤。设计定制功能多肽的创新方法为先进的药物传递和精确治疗带来希望。相关研究内容以“Engineering Semicarbazide-Bearing Polypeptide Conjugates for Efficient Tumor Chemotherapy and Imaging of Tumor Metastasis”为题于2023年11月9日发表在《Advanced Materials》。

本研究报道了一种通用、稳健的制备聚(乙二醇)-多聚物(PEG-b)混合嵌段共聚物(HBCPs),通过直接聚合相应的苯氧碳基功能化的α-氨基酸(NPCA)前体,而不是不稳定NCA单体。由此产生的HBCPs为高效装载醛/酮衍生物,在侧链上形成肟或氨基脲键提供一个理想的平台,而氨基脲键显示出更高的pH响应性,并可以对内溶酶体内的酸性pH值作出反应(图1a)。此外,还可以进一步加入缺氧响应性(Ir(btpna)(bpy)2)探针,以实现对肿瘤酸性和缺氧微环境的顺序响应,以放大检测灵敏度报告肿瘤病变位置(图1b)。
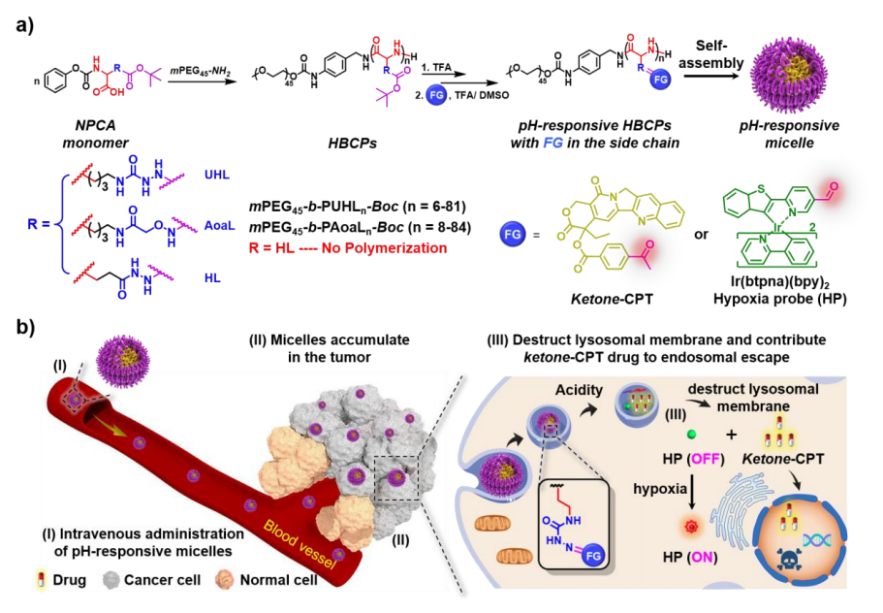
图1 HBCPs合成及应用示意图
【定义明确的PEG-b多肽HBCPs的合成】
氨基脲键是一种酸不稳定键,可在内溶酶体pH上分离,通过氨基脲和酮/醛衍生物之间的反应形成。将PEG-b-P(UHL-Boc)6(HBCP-1)的t-丁基碳基去除,生成氨基脲或羟胺部分,进一步用于共价结合醛/酮衍生物(图2a)。UHL-Boc和AoaL-Boc可以在60°C下成功聚合(图2a-e)。在1610~1640cm−1处,C=N键的特征拉曼信号和红外信号都很明显(图2g、h),表明酮-CPT成功地共价结合到侧链上。
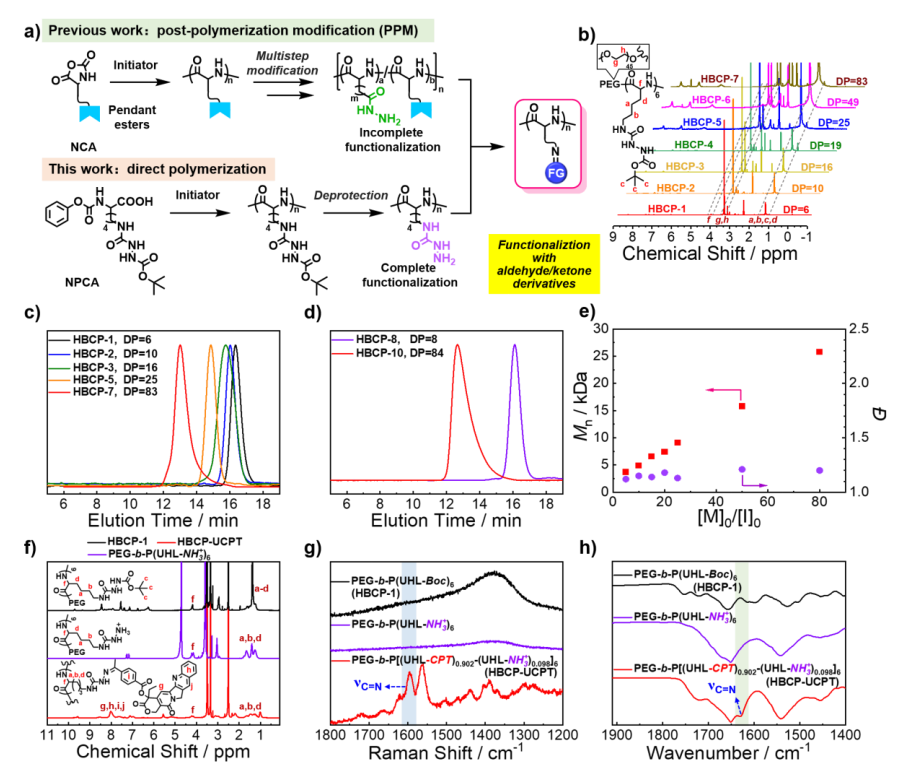
图2 PEG-b多肽HBCPs的合成
【HBCPs的自组装和酸性pH触发的有效载荷释放】
透射电镜观察显示,在pH值为4.8孵育120 h后,HBCP-UCPT胶束解体,这归因于pH触发的疏水酮-CPT药物释放(图3a、b)。HBCP-UCPT胶束的水解动力学高度依赖pH(图3c)。酸性pH介导的胶束纳米颗粒水解进一步证实在酸性pH值下的散射光强度降低(图3d),而颗粒浓度从2.6×109颗粒/mL下降到9.4×106颗粒/mL(图3e)。然而,对于具有肟键的HBCP-ACPT胶束,pH为4.8时,14%的酮-CPT在160小时内释放(图3f),与散射强度和颗粒浓度仅略有下降一致(图3g、h)。
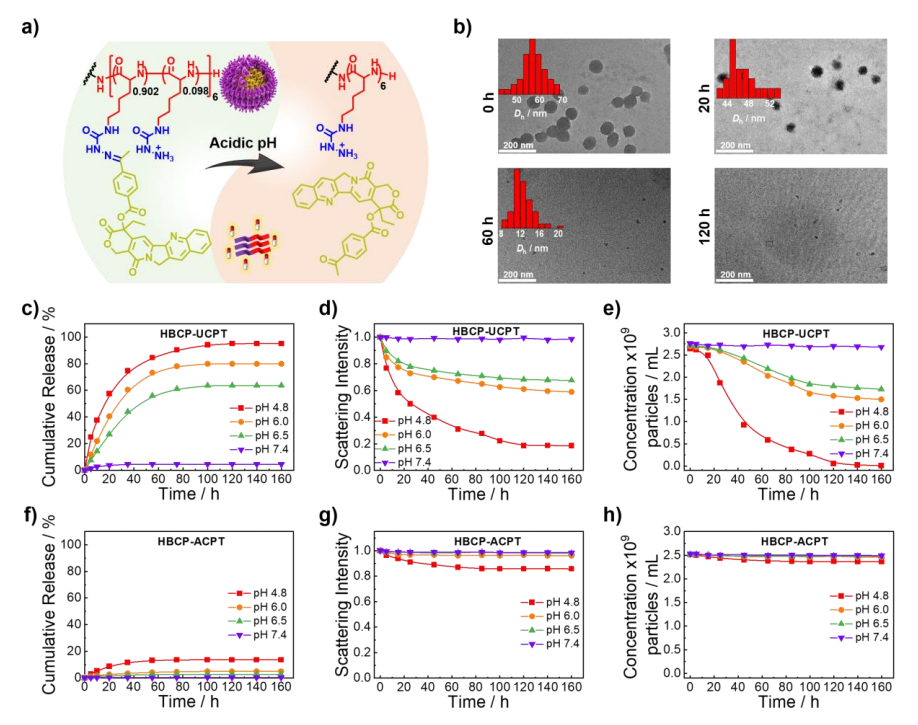
图3 HBCPs的自组装和酸性pH触发的有效载荷释放
【细胞内化和细胞毒性】
通过监测蓝光CPT残基的荧光变化和定位来定量胶束纳米颗粒的摄取。晚期核内体和溶酶体用溶酶追踪器红色染色(图4a)。随着孵育时间增加,内化的酮-CPT药物逐渐增加,并随着孵育时间的增加逐渐从内溶酶体中逃逸,提示细胞内酸性pH触发药物释放(图4a)。HBCP-UCPT胶束处理后AO的绿色荧光增加,显示出溶酶体膜的破坏,而HBCP-ACPT胶束处理后的细胞显示出较弱的绿色发射,表明溶酶体膜完整(图4b)。这些结果表明,核心内具有pH可裂解氨基脲的HBCP-UCPT胶束可以有效地破坏4T1细胞的溶酶体膜,促进溶酶体内逃逸,避免溶酶体降解和释放-CPT药物失活。分别与4T1和HepG2细胞孵育24 h后,HBCP-UCPT胶束比HBCP-ACPT胶束表现出更高的细胞毒性(图4c、d)。
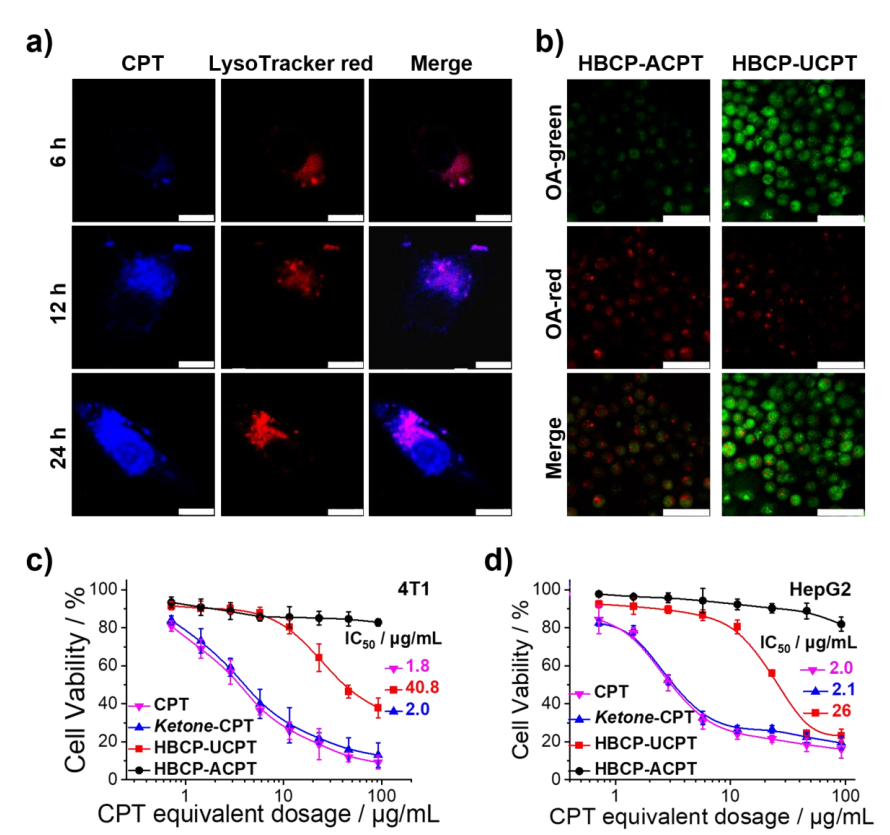
图4 细胞内化和细胞毒性
【药效学研究及体内抗癌作用】
为进一步研究HBCP胶束纳米颗粒在体内的抗癌性能,静脉注射于4T1荷瘤小鼠后检测HBCP-UCPT和HBCP-ACPT胶束的药代动力学(图5a)。HBCP-UCPT胶束的消除半衰期和AUC0-t值均高于HBCP-ACPT胶束(图5b)。通过每4天监测一次生物发光信号(图5c、d)和每2天监测一次大小变化(图5e)来分析肿瘤负荷。CPT治疗后的小鼠肿瘤在无治疗期间复发并生长,而接受HBCP-UCPT胶束治疗的小鼠则观察到明显的肿瘤抑制(图5c-e)。治疗14天后,肿瘤重量显示,与PBS组相比,HBCP-UCPT胶束和CPT分别下降73%和29%(图5f、g)。PBS和CPT处理的中位生存时间分别为41天和45天,而接受HBCP-UCPT胶束处理的小鼠中,60%的小鼠在接种后60天存活(图5h)。
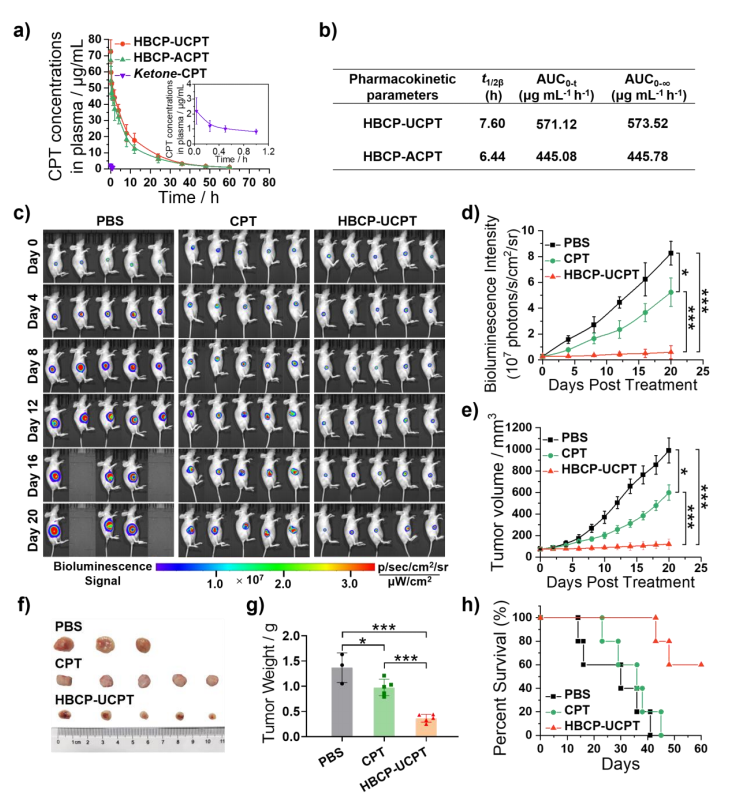
图5 药效学研究及体内抗癌作用
【肿瘤肺转移的超灵敏检测】
pH5.0孵育HBCP-UCPTH胶束时,观察到荧光发射从608到704 nm的红移,表明(Ir(btpna)(bpy)2)探针从侧链释放(图6a、b)。注入HBCP-UCPTH胶束后,在705 nm处测量的荧光强度逐渐增强(图6c、d)。在216 h(9天)后,对解剖的肿瘤和器官进行体外成像,证实开启荧光具有高度的肿瘤特异性(图6e)。在静脉注射HBCP-UCPTH胶束(40mg/kg)时,(Ir(btpna)(bpy)2)探针的荧光信号与4T1-luc肿瘤的生物发光信号有很好的叠加(图6f、g),表明HBCP-UCPTH胶束可以可靠地报告转移病灶的位置。
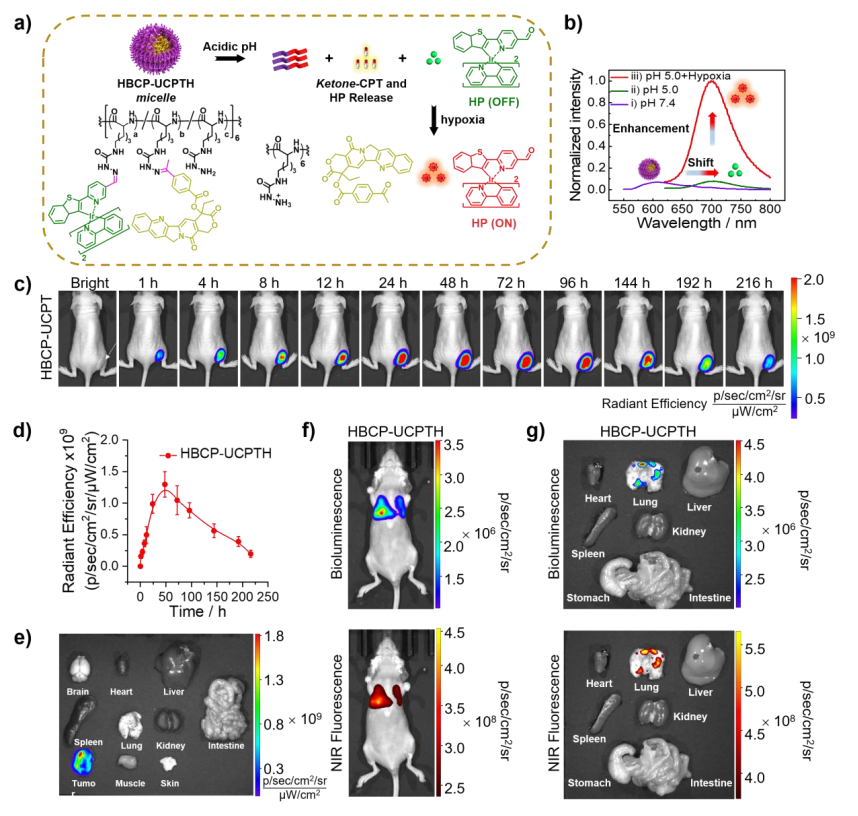
图6 肿瘤肺转移的超灵敏检测
【总结】
综上所述,本研究通过直接聚合NPCA基前驱体,成功地合成在侧链中含有氨基脲部分的定义明确的HBCPs。HBCPs的这种基础架构为多种含酮/醛功能剂的整合提供一个合适的框架。基于HBCP的纳米药物中产生的氨基脲部分赋予细胞内pH触发的药物释放和干扰溶酶体屏障的能力,从而避免溶酶体内药物不必要的降解,并有效地提高治疗效果。扩展基于HBCP平台的多功能性,本研究引入了响应缺氧条件显像剂的集成。通过氨基脲键的形成,由此产生的纳米药物使对酸性和缺氧微环境的顺序反应成为可能,为精确检测转移性肿瘤病变提供巨大的希望。本研究为构建多肽基功能化醛/酮衍生物的平台提供有价值的见解,具有提高治疗性能的潜力。
原文链接:
https://doi.org/10.1002/adma.202309315
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#含半脲多肽#偶联物用于有效的肿瘤化疗和肿瘤转移成像
82