Microbiome:苏州大学邓泮等揭示肠道微生物在胆碱生物合成中的新功能
2024-06-09 iNature iNature 发表于上海
该研究使用稳定同位素分辨代谢组学(SIRM)对口服给予13C-菊粉的小鼠进行研究,作者首先观察到了在盲肠内容物中氨基酸和短链脂肪酸代谢途径中13C代谢物的动态富集。
肠道微生物群代谢产物是调节宿主健康和疾病的重要因素。然而,肠道微生物群的整体代谢潜力及其与宿主器官的相互作用尚未得到充分探索。
2024年5月15日,苏州大学邓泮和肯塔基大学Bernhard Hennig在Microbiome 上在线发表题为“13C-Stable isotope resolved metabolomics uncovers dynamic biochemical landscape of gut microbiome-host organ communications in mice”的研究论文,该研究使用稳定同位素分辨代谢组学(SIRM)对口服给予13C-菊粉的小鼠进行研究,作者首先观察到了在盲肠内容物中氨基酸和短链脂肪酸代谢途径中13C代谢物的动态富集。随后,对在给予示踪剂后6、12和24小时收集的血浆、肝脏、脑和骨骼肌中的13C标记代谢物进行了比较分析。观察到了器官特异性和时间依赖性的13C代谢物富集。
碳源优先被整合到肝脏和大脑中的胆碱代谢以及谷氨酰胺-谷氨酸/GABA循环中。骨骼肌中的13C-乳酸富集显示了性别差异,这突出了性别对肠道微生物群与宿主器官相互作用的影响。胆碱被鉴定为一种源自肠道微生物群的器官间代谢物,并参与了宿主器官中磷脂酰胆碱和溶血磷脂酰胆碱的脂肪生成。体外和计算机模拟研究揭示了人类肠道微生物群通过乙醇胺途径的新生胆碱合成,并确定了粪肠球菌(Enterococcus faecalis)是主要的胆碱合成菌种。这些结果揭示了肠道微生物在胆碱生物合成中的一个此前未被充分认识的作用。

肠道微生物代谢物已知能够调节跨界相互作用,影响宿主健康和疾病发生率。最近的研究表明,肠道微生物群的紊乱与不仅影响肠道还影响远端器官的疾病有关。人类肠道微生物群的重要作用是分解复杂的碳水化合物,而短链脂肪酸(SCFAs)是最终产物,被认为在肠道微生物群-宿主器官轴中发挥关键作用。然而,只有少部分结肠来源的SCFAs能进入全身循环和外周组织(丙酸和丁酸分别为9%和2%),因此关于结肠来源的SCFAs对远端器官的影响存在疑问。此外,虽然SCFAs可以调节大脑功能,但大脑对SCFAs的摄取量似乎很少,丁酸的摄取量为注射剂量的0.006%。因此,肠道微生物群代谢物介导的宿主组织相互作用仍有很大未知领域。
稳定同位素分辨代谢组学(SIRM)可以动态追踪代谢网络中单个原子的运动。作者小组之前使用13C-糖类(菊粉和纤维素)作为示踪剂来研究小鼠粪便微生物群的代谢功能。此外,SIRM还揭示了小鼠模型在摄入13C6-葡萄糖后的宿主代谢基本特征。这些发现为微生物的营养偏好和宿主器官中的生化分布提供了重要见解。基于肠道微生物合成的代谢物对于维持宿主代谢稳态的重要性,作者尝试使用SIRM和小鼠模型来识别这些代谢物,并确定它们是否会转移到肝脏、大脑和骨骼肌组织。
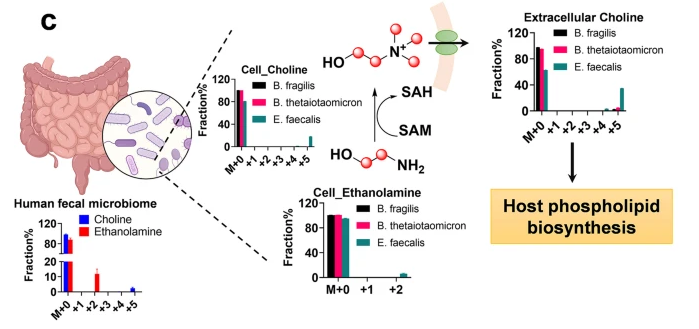
模式机理图(图片源自Microbiome)
在此,作者使用全13C标记的菊粉作为示踪剂,并采用液相色谱-高分辨质谱(LC-HRMS)对口服给予[U-13C]-菊粉后不同时间点的小鼠盲肠内容物和宿主器官(血浆、肝脏、大脑和骨骼肌)进行无靶向SIRM分析。作者还在体外应用该方法筛选微生物-宿主交流代谢物的微生物生产者。这些发现强调了肠道微生物代谢潜力的重要性,并为肠道微生物群与多个宿主器官之间的动态代谢相互作用提供了新的见解。
原文链接:
https://doi.org/10.1186/s40168-024-01808-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肠道微生物# #胆碱生物合成#
0