智飞生物发布重组新冠疫苗Ⅲ期临床关键数据:总保护效率82%、Delta保护率78%
2021-08-28 JACKZHAO MedSci原创
8月27日晚间,智飞生物发布公告称,与中科院微生物所合作研发的重组新型冠状病毒疫苗获得Ⅲ期临床试验关键性数据。Ⅲ期临床试验关键数据结果证明,重组新型冠状病毒疫苗(CHO细胞)在符合本临床试验方案的人群

智飞生物公告
8月27日晚间,智飞生物发布公告称,与中科院微生物所合作研发的重组新型冠状病毒疫苗获得Ⅲ期临床试验关键性数据。Ⅲ期临床试验关键数据结果证明,重组新型冠状病毒疫苗(CHO细胞)在符合本临床试验方案的人群中具有很好的安全性和防病效果。
公告称,该疫苗自2020年12月12日开始,陆续在我国湖南省、乌兹别克斯坦、印度尼西亚、巴基斯坦和厄瓜多尔开展国际多中心Ⅲ期临床试验,计划入组18周岁以上普通人群共计29000人,按照0、1、2月的免疫程序共接种3剂疫苗。
截止到本次数据分析日,实际共入组28500人,其中疫苗组14251例、安慰剂组14249例。共监测到全程接种后的主要终点病例数221例,对于任何严重程度的COVID-19的保护效力为81.76%,达到WHO要求的新冠疫苗有效性标准。其中对于COVID-19重症及以上病例、死亡病例的保护效力均为100%。
目前已完成大部分主要终点病例的基因分型,初步分析结果显示:对Alpha变异株的保护效力为92.93%;对Delta变异株的保护效力为77.54%。
本研究安全性数据结果显示:总体不良事件/反应的发生率,疫苗组与安慰剂组无显著差异,安全性良好。已完成的Ⅲ期临床试验关键数据结果证明,重组新型冠状病毒疫苗(CHO细胞)在符合本临床试验方案的人群中具有很好的安全性和防病效果。
对比全球主要获批上市和紧急使用新冠疫苗的III期临床数据,智飞生物重组新冠疫苗的综合保护率居前,且是唯一对野生株和主要变异株完成完整三期临床试验的新冠疫苗。
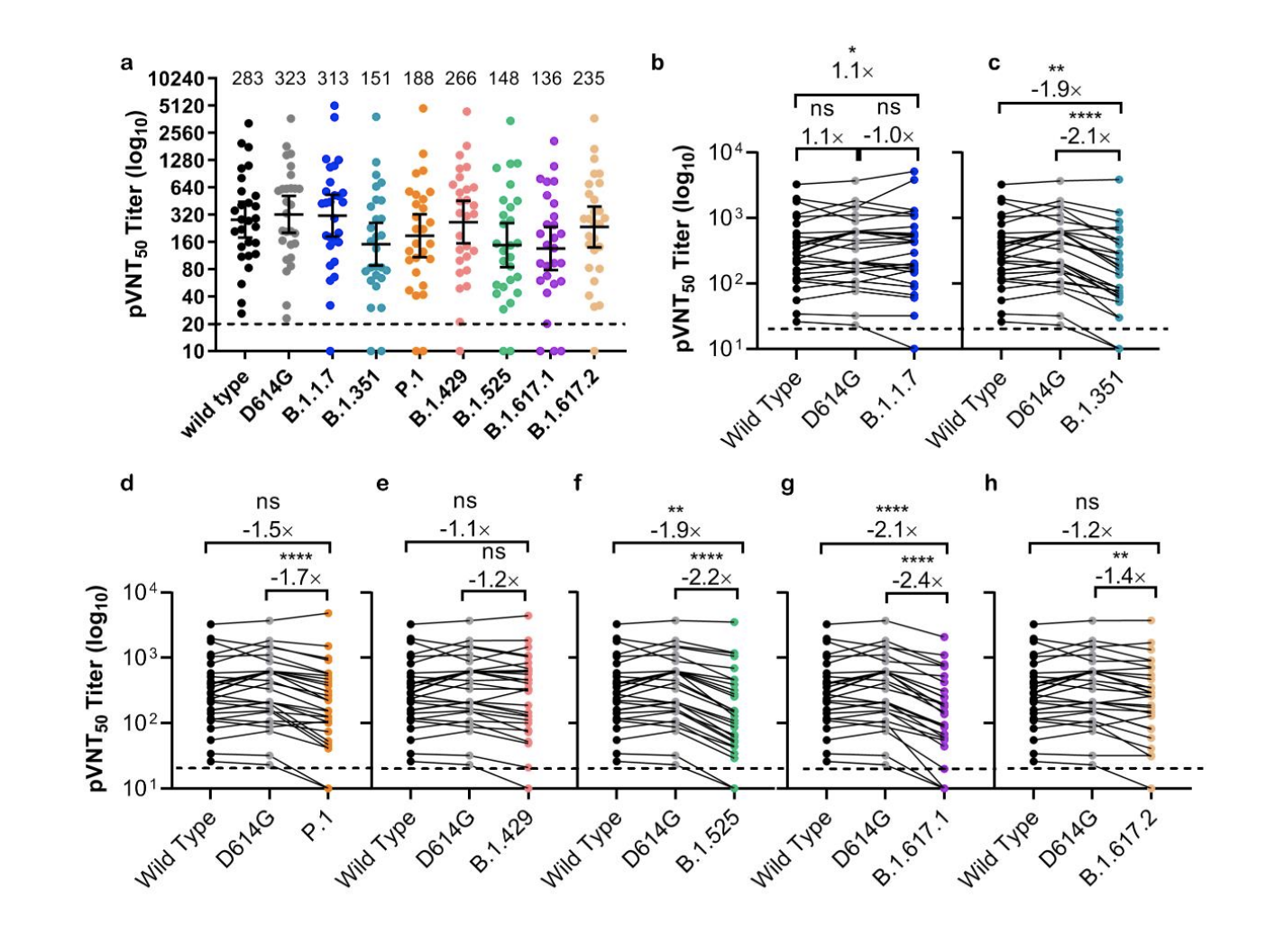
ZF2001中和三种SARS-CoV-2变异假病毒血清样本抗体滴度水平。
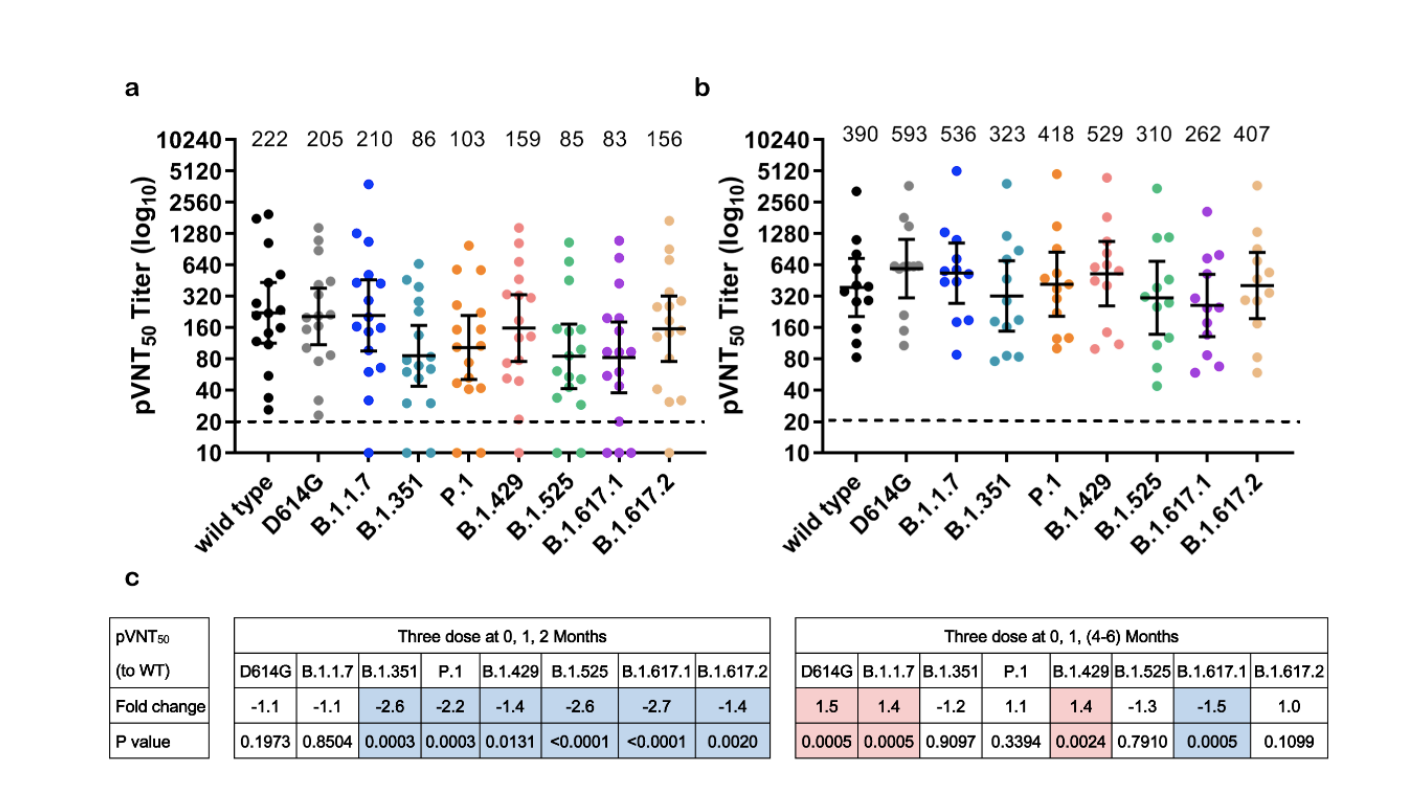
接受三剂ZF2001受测者血清样本抗体水平
7月15日,智飞生物与中国科学院微生物研究所在预发表平台bioRxiv上曾发表实验结果称,以模拟Delta变体颗粒进行测试,与早先出现的病毒颗粒相比,接种过智飞三剂疫苗者的血清样本显示其中和抗体降低了1.2倍。科研人员指出,仍需要来自临床试验或实际使用的数据来确定疫苗对病毒变体的防护力。该研究采用了28名受测者样本。试验结果也发现,施打第二剂和第三剂疫苗的间隔时间较长者,对新冠病毒变体的活性更大。
但研究人员指出,这些新出现的变种对 ZF2001的高度敏感性疫苗支持当前的大规模免疫接种机会,以建立群体免疫。然而,针对这些变异的疫苗有效性仍然必须通过3期临床验证试验和真实世界的证据。
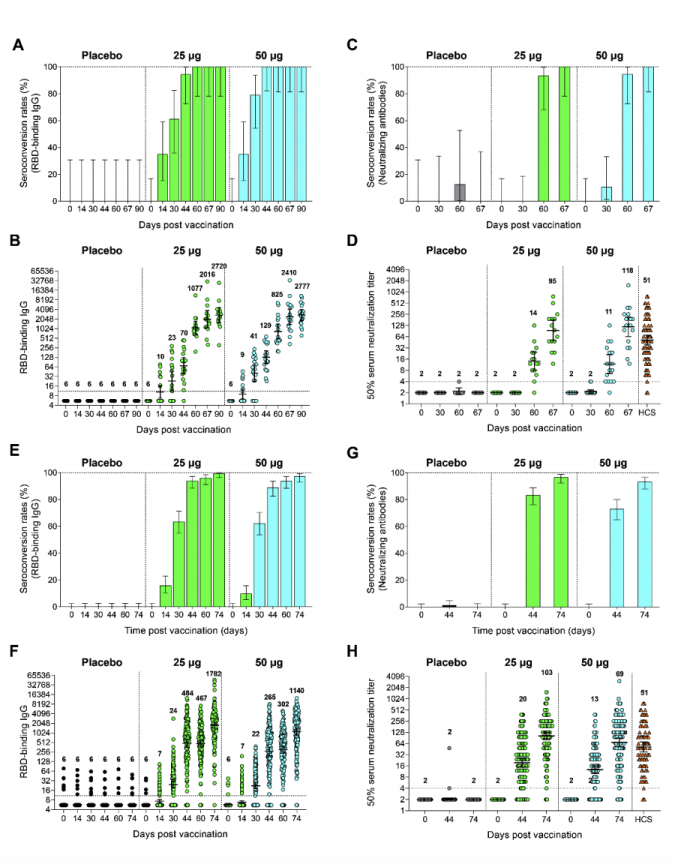
1期和2期试验中的体液免疫反应,doi: https://doi.org/10.1101/2020.12.20.20248602
在去年10月30日,中科院微生物所已顺利完成Ⅰ/Ⅱ期临床试验揭盲数据显示,临床试验结果符合预期,疫苗显示出了很好的安全性和免疫原性。并于去年12月在MedRxiv发布的一二期临床试验数据显示,ZF2001具有良好的耐受性,没有与疫苗相关的严重不良事件。 在第0、30和60天进行免疫活性检测中,中和抗体的血清转化率为93-100%,GMT超过了恢复期血清样品的大小。
今年2月初,中国疾病预防控制中心高福团队在bioRxiv发布正在开展3期临床试验的国产重组蛋白亚单位新冠疫苗和批准上市的国产灭活新冠疫苗(北京生物制品研究所等联合开发的BBIBP-CorV灭活新冠疫苗)对南非新变种(501Y.V2)的保护效果。结果显示,虽然这两种疫苗接种者血清对南非新变种的中和效果稍有下降,但是依然保留大部分中和活性,提示这两种疫苗对南非新变种依然有保护效果。
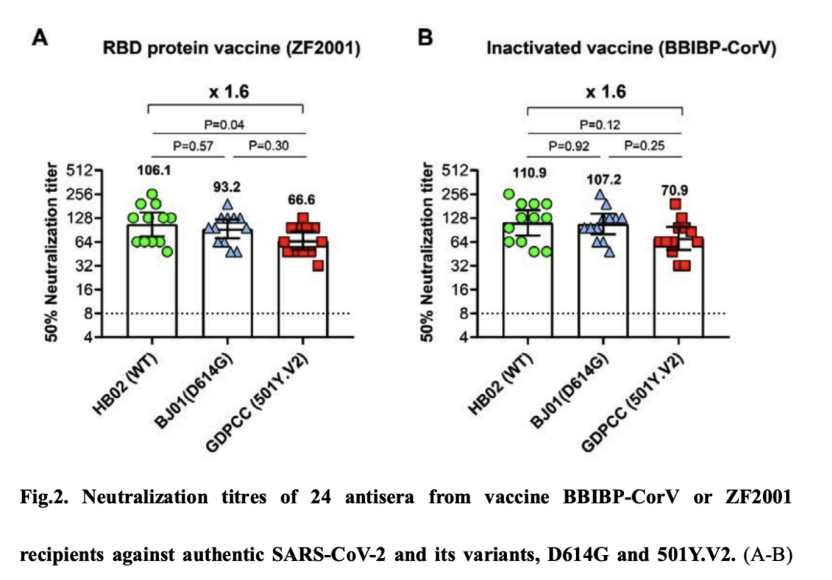 doi: https://doi.org/10.1101/2021.02.01.429069
doi: https://doi.org/10.1101/2021.02.01.429069
文章称,研究者为每种疫苗选择了12个来自临床试验参与者的血清样本,无论是ZF2001还是BBIBP-corV受试者的12份血清样本都基本保留了南非变异毒株的中和作用。与它们和新冠病毒毒株WT或D614G的滴度相比,几何平均滴度(GMTs)下降幅度均是1.6倍。令人鼓舞的是,减少量明显少于以前报道的康复患者血清(超过10倍)或来自mRNA疫苗接受者体内的抗体血清(超过6倍)的减少量。
A组(智飞重组蛋白疫苗):相比原株,对南非突变株的几何平均滴度(GMT)从106.1下降到了66.6,降幅1.6倍;相对流行株,GMT从93.2下降到66.6。
虽然,第三期临床试验详细数据尚未公布,但智飞生物公告三期关键数据也再次证实ZF2001具有良好的安全性和免疫原性了这一点,智飞生物重组新冠疫苗的。未来需要更多真实世界来验证。
智飞的ZF2001疫苗已在中国和乌兹别克斯坦获得紧急授权使用,目前已生产超过1亿剂。
参考资料:
Neutralization of recombinant RBD-subunit vaccine ZF2001-elicited antisera to SARS-CoV-2 variants including Delta bioRxiv preprint doi: https://doi.org/10.1101/2021.07.15.452504
Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD protein vaccine against COVID-19 in adults: pooled analysis of two randomized, double-blind, placebo-controlled, phase 1 and 2 trials,doi: https://doi.org/10.1101/2020.12.20.20248602
Neutralization of SARS-CoV-2 VOC 501Y.V2 by human antisera elicited by both inactivated BBIBP-CorV and recombinant dimeric RBD ZF2001 vaccines,doi: https://doi.org/10.1101/2021.02.01.429069
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Ⅲ期临床#
73
中国疫苗杠杠的
90
新冠肺炎,疫情何时才能消失
73
好消息,谢谢分享。
77
效果不错
87
值得关注
97