皮肤紫癜伴肾脏损害1例报道
2013-07-27 南京军区南京总医院 全军肾脏病研究所 陈樱花 章海涛 刘志红 中国医学论坛报
病例摘要 患者男性,70岁,因“反复双下肢皮肤紫癜8年,尿检异常伴血肌酐升高3年余,加重1月余”两次入院。 第一次住院 2002和2003年,患者两度出现双下肢散在皮肤出血点,压之不褪色,5天后消退。 2007年1月,患者情绪激动后步态不稳,无意识障碍,血压220/110 mmHg,头颅CT示脑梗塞,尿
 |  |
 |  |
病例摘要
患者男性,70岁,因“反复双下肢皮肤紫癜8年,尿检异常伴血肌酐升高3年余,加重1月余”两次入院。
第一次住院
2002和2003年,患者两度出现双下肢散在皮肤出血点,压之不褪色,5天后消退。
2007年1月,患者情绪激动后步态不稳,无意识障碍,血压220/110 mmHg,头颅CT示脑梗塞,尿蛋白和隐血(+),血肌酐(Cr)1.47 mg/dl,予降压治疗,血压控制平稳(130/70 mmHg)。
2007年9月,患者双下肢轻度浮肿,尿蛋白及隐血2+,血Cr 1.7 mg/dl,补体C3 0.5 g/L,C4 0.1 g/L,未治疗。
2008年5月,患者浮肿加重,尿量减至500 ml/d,于2008年5月入院。
病程中患者夜尿4次/晚,无不规则发热及关节痛。
既往史 1986年发现乙肝“小三阳”,肝酶正常,病毒无复制,未治疗。1991年十二指肠球部溃疡出血,已愈。患者长期睡眠差,精神焦虑,间断服用阿普唑仑。
体格检查
体温36.6℃,脉搏80次/分,呼吸19次/分,血压170/100 mmHg,脉氧92%。面部轻度浮肿,贫血貌,全身无皮疹,浅表淋巴结未及肿大。双肺呼吸音清,双下肺呼吸音减低,未闻及干湿音。心律齐,心尖区可闻及2/6级舒张期杂音。腹膨隆,无压痛,肝脾肋下未及,移动性浊音阳性。双下肢中度浮肿,四肢关节无异常。
实验室检查
尿蛋白 6.19 g/24h,尿沉渣红细胞(RBC)375万/ml(多形型)。
肾脏B超(LK/RK)98×46×48/97×43×48 mm,皮质回声正常,髓质回声增加。
血红蛋白(HGB)8.3 g/dl,网织红细胞2%,白细胞(WBC)6200/mm3,血小板(PLT)19.7万/mm3。空腹血糖7 mmol/L,餐后2小时血糖12 mmol/L,糖化血红蛋白 6.1%。
白蛋白(ALB) 32.7 g/L,球蛋白27.7 g/L,肝功能正常。尿素氮(BUN)36.8 mg/dl,Cr 2.55 mg/dl,尿酸(UA) 363 umol/L,电解质正常。
自身抗体阴性,补体正常,乙肝表面抗原(HBsAg)、核心抗体(HBcAb)、e抗体(HBeAb)阳性,乙肝DNA及丙肝抗体和RNA阴性,类风湿因子(RF)两次分别为5330 IU/ml和4970 IU/ml,免疫球蛋白(Ig)M为5.12 g/L,冷球蛋白389.7 mg/L。免疫固定电泳示κ型IgM单克隆免疫球蛋白条带。骨髓细胞学检查正常。肝胆胰脾超声正常。
肾脏病理
光镜下,20个肾小球中2个球性废弃,1处节段纤维细胞性小新月体,余正切肾小球体积增大,分叶状,系膜细胞明显增多,见多处系膜溶解,肾小球内皮细胞增殖明显,部分致毛细血管袢狭小,脏层上皮细胞肿胀明显、颗粒变性,节段囊壁增厚、分层,壁层上皮细胞增生。高碘酸/乌洛托品银-马松染色(PASM-Masson)示少量系膜区、内皮下嗜复红物沉积,节段外周袢“双轨”。多灶性肾小管萎缩、基膜增厚,未萎缩的肾小管基膜亦增厚,见小管再生及小管炎。间质单个核细胞浸润,数处小灶性聚集。髓质区间质纤维化(++)。小动脉弹力层增厚、分层,节段透明变性。
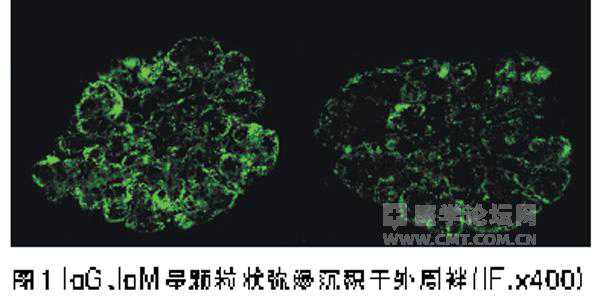
冰冻切片荧光染色肾小球IgG++(图1)、IgM+、C3++,弥漫分布,呈颗粒状沉积于外周袢。
肾组织荧光染色游离κ轻链++、游离λ轻链++,弥漫分布,呈颗粒状沉积于外周袢,肾小管、肾血管壁均阴性。
肾组织HBsAg、HBeAg、HBcAg均阴性。
第一次出院诊断及治疗随访
第二次住院
2010年1月20日,患者因丙氨酸氨基转移酶(ALT)升至91 U/L,自行停用霉酚酸酯胶囊及雷公藤多苷,加用保肝药物,肝酶恢复正常。
2010年3月,患者血Cr升至3.33 mg/dl,浮肿加重,尿量减至600 ml/d,体重1个月内增加5 kg,于2010年4月第二次入院。
实验室检查
尿蛋白6.48 g/24h,尿沉渣RBC 1070万/ml(多形型),C3 12.90 mg/L,α2-m 3.98 mg/L,尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)酶 77.3 u/g·Cr,视黄醇结合蛋白 28.4 mg/L,尿溶菌酶<0.5 mg/L,尿浓缩功能 320 mOsm/Kg·H2O。
HGB 6.4 g/dl,WBC 8700/mm3,PLT 22.7万/mm3。C反应蛋白1 mg/L。
ALB 33.5 g/L,球蛋白27.7 g/L,肝功能正常,血脂正常。BUN 61.4 mg/dl,Cr 4.96 mg/dl,UA 692 μmol/L,电解质正常。乳酸脱氢酶 337 U/L,磷酸肌酸激酶 74 U/L,磷酸肌酸激酶同工酶 4 U/L。空腹血糖6.68 mmol/L,餐后2小时血糖 11 mmol/L,糖化血红蛋白5.2%。
自身抗体、可提取核抗原多肽及抗心磷脂抗体阴性,IgG 7.88 g/L,IgM 3.42 g/L,IgA 1.8 g/L,C3 1.0 g/L,C4 0.129 g/L。RF 4820 IU/ml,冷球蛋白1606 mg/L,免疫固定电泳亦见κ型IgM单克隆免疫球蛋白条带。淋巴细胞CD4+ 352/μl,CD8+ 594/μl, CD20+ 85/μl,CD19+ 85/μl。
尿游离κ轻链136.51 mg/L,尿游离λ轻链 95.48 mg/L,κ/λ 1.43,尿本周蛋白阴性。
血游离κ轻链120.88 mg/L,血游离λ轻链76.65 mg/L,κ/λ为1.58。
HBsAg、HBcAb、HBeAb阳性,乙肝DNA及丙肝抗体和RNA阴性。
辅助检查
胸、腹CT示双下肺间质性炎症伴部分萎陷,纵隔无肿大淋巴结;有腹水,腹部无肿大淋巴结。
心脏超声示主动脉硬化,左室壁增厚,二尖瓣脱垂伴重度关闭不全,左室舒张功能减低,左室射血分数62%,肺动脉高压(收缩压42.2 mmHg)伴相对性三尖瓣反流,少量心包积液。
脑磁共振成像示老年性脑萎缩,脑干多发陈旧性腔隙性梗塞。
眼底检查示黄斑区色素紊乱,视网膜出血,动静脉比例1:2,动脉硬化程度2级。
血管超声示双下肢动脉粥样硬化斑块形成,双肾血管未见血栓。
泌尿系超声 双肾105×46/95×47mm,皮质回声正常,髓质回声增加。
骨髓细胞学检查示成熟浆细胞1.5%。骨髓活检组织学检查示骨髓造血活跃,浆细胞轻度增多(5%),免疫组化CD138约5%(+),κ、λ、CD79a均散在(+)。
第一次出院时,患者被诊断为膜增生性肾小球肾炎,慢性乙型病毒性肝炎,2型糖尿病。
予霉酚酸酯胶囊0.5 g/d联合雷公藤多苷片60 mg/d诱导,间断红细胞生成素纠正贫血及降压治疗,尿蛋白波动于0.96~2.05 g/24h,尿沉渣红细胞计数波动于 80万/ml左右,血Cr稳定为2 mg/dl左右,HGB稳定于10 g/dl左右。
肾脏病理(重新阅片及电镜检查)
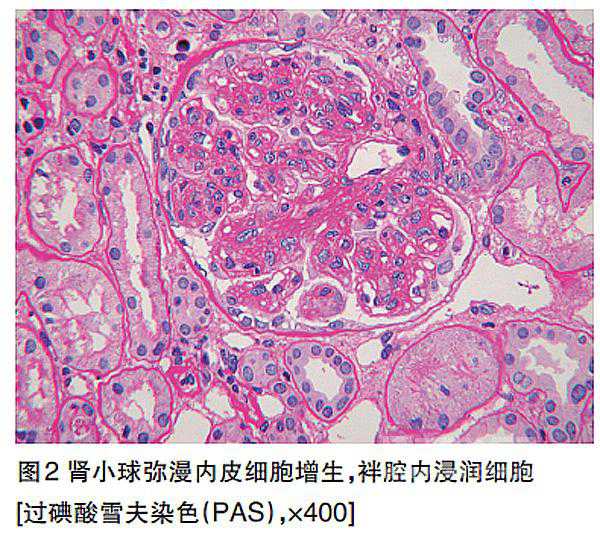
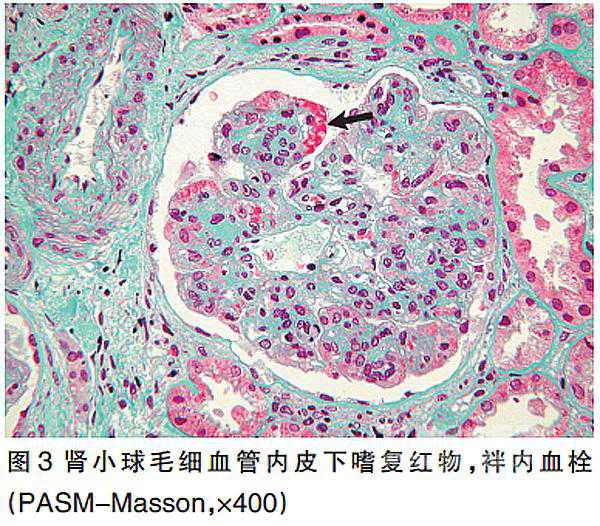
光镜下除可见肾小球体积增大、分叶状、系膜细胞明显增多,还可观察到内皮细胞弥漫增殖、肿胀伴袢内浸润细胞(图2);除系膜区及内皮下的嗜复红物沉积,还可见袢内血栓(图3)。
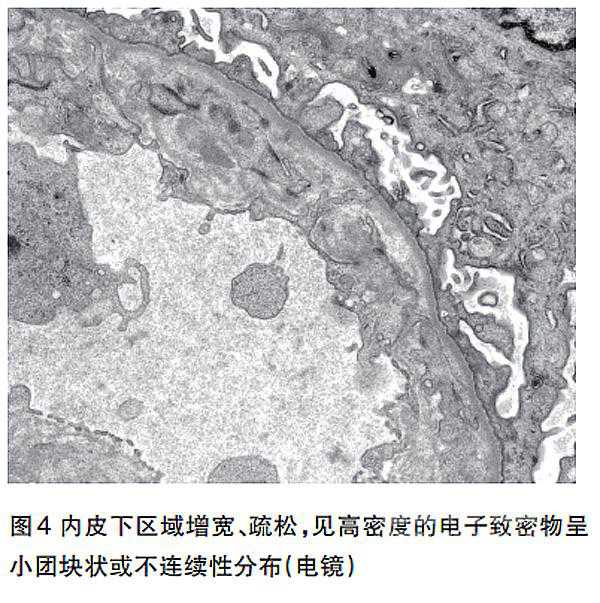
电镜下,肾小球毛细血管袢腔内充满增殖的内皮细胞、浸润的单核细胞和中性粒细胞,有的浸润细胞侵入内皮下,多处内皮下区域增宽、疏松,见高密度的电子致密物呈小团块状或不连续性分布,上皮侧无电子致密物沉积(图4)。多处外周袢基膜分层,内见插入,基膜内见电子致密物。足突广泛性融合增宽。
|
 |
 |
诊断分析
患者老年男性,病程8年,临床多系统损害,肾脏损害表现为肾炎综合征,大量镜下血尿伴大量蛋白尿,血肌酐(Cr)升高,血压高,肾外有皮肤紫癜及贫血。
初次住院首先考虑诊断继发性肾脏病,在完善相关检查后,排除抗中性粒细胞胞浆抗体(ANCA)相关血管炎、过敏性紫癜性肾炎和狼疮性肾炎等。
患者贫血较重,免疫固定电泳见单克隆免疫球蛋白条带,但无淋巴结肿大,血、尿游离轻链阴性,骨髓细胞学和组织学检查无异常,肾组织轻链染色阴性,诊断多发性骨髓瘤、华氏巨球蛋白血症和慢性淋巴细胞白血病等依据不足。
患者冷球蛋白轻度升高,类风湿因子(RF)高滴度阳性,IgM升高,但丙型肝炎病毒(HCV)抗体和RNA均阴性,诊断HCV相关冷球蛋白血症依据也不足。出院后按膜增生性肾小球肾炎予免疫抑制剂治疗,近2年病情稳定。
患者在停用免疫抑制剂3个月后病情进展迅速,蛋白尿和血尿明显增多,肾功能恶化,冷球蛋白升高达1606 mg/L。
复阅病理片,我们发现一些不同于单纯膜增生性肾小球肾炎的特点:① 光镜下除肾小球体积增大、分叶状、系膜细胞明显增多外,还可见内皮细胞弥漫增殖、肿胀伴袢内浸润细胞;② 除系膜区及内皮下嗜复红物沉积,还可见袢内血栓;③ 电镜下肾小球毛细血管袢腔内充满增殖的内皮细胞,内皮下区域增宽、疏松,高密度电子致密物呈小团块状或不连续性分布。结合患者有皮肤紫癜、冷球蛋白升高、RF高滴度阳性,修正诊断为冷球蛋白血症肾损害。
最后诊断及治疗转归
患者本次出院诊断为冷球蛋白血症,冷球蛋白血症肾损害,慢性乙型病毒性肝炎,2型糖尿病。
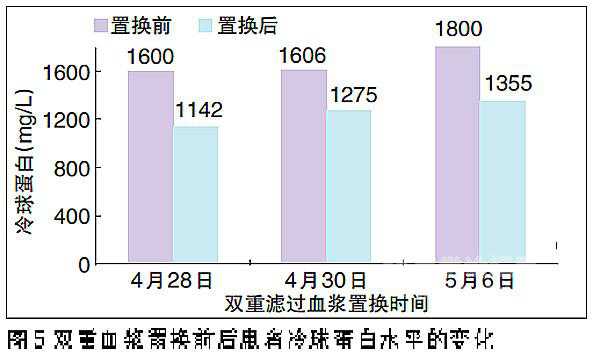
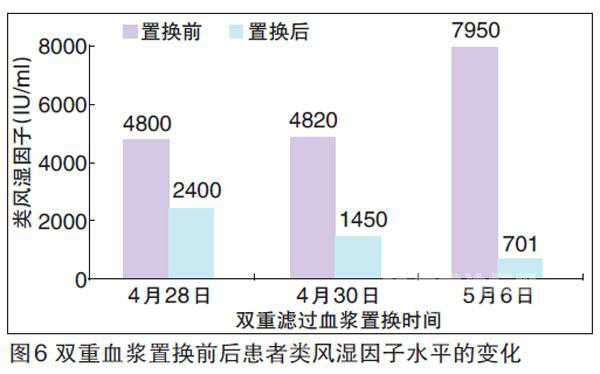
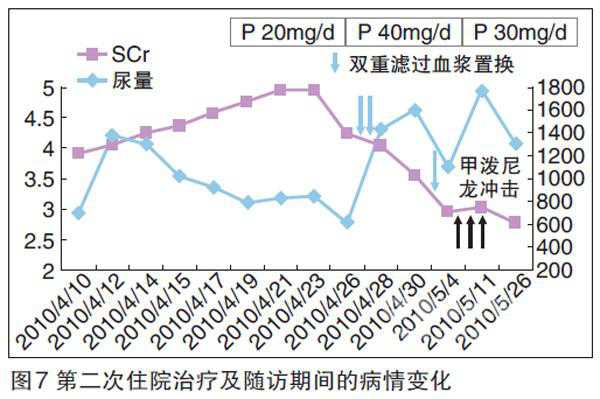
在本次入院时,患者尿量600 ml/d,顽固性高血压,血Cr达4.96 mg/dl,大量蛋白尿及镜下血尿,贫血重。经连续血液净化等对症治疗后,尿量增至1000 ml/d,浮肿减轻。但持续大量镜下血尿、冷球蛋白及RF高滴度阳性,予甲泼尼龙250 mg、250 mg、500 mg治疗三次,双重滤过血浆置换(DFPP)三次,冷球蛋白及RF水平下降,尿蛋白减少,血Cr下降(图5、6、7)。治疗中出现血糖升高,加用口服降糖药后控制良好;乙肝病毒复制,加用抗病毒治疗。
{nextpage}出院半月随访,血Cr降至2.7 mg/dl,乙肝病毒无复制。但患者高龄,长期焦虑,因既往反复十二指肠溃疡出血,担心激素及免疫抑制剂的不良反应,自行停用激素,拒用环磷酰胺(CTX)。2月后浮肿再次加重,血Cr升高,进入维持性血液透析治疗。
讨论
冷球蛋白血症肾损害的临床病理特点
冷球蛋白血症是一种系统性小血管炎,常合并肾外多系统损害,典型表现为“皮肤紫癜、乏力、关节炎”三联征,还可合并慢性肝损害、周围神经病变、间质性肺炎、内分泌紊乱和弥漫性血管炎,淋巴组织和肝组织恶性肿瘤少见。
与HCV相关冷球蛋白血症相比,非HCV相关冷球蛋白血症肾损害研究甚少。除镜下血尿外,该类患者75%表现为肾病范围蛋白尿,80%伴高血压,85%可进展为肾功能不全,肾脏损害较HCV相关冷球蛋白血症更严重。
HCV与非HCV相关冷球蛋白血症肾脏病理均表现为膜增生性肾小球肾炎,以Ⅰ型膜增生性病变最常见,典型病理特征为肾小球毛细血管袢内见冷球蛋白“栓子”,常伴单核细胞和中性粒细胞浸润,但也有部分患者未见大量冷球蛋白“栓子”。约30%患者可伴中小动脉病变。免疫荧光证实,肾小球毛细血管袢沉积物与冷球蛋白成分一致,通常是IgM和IgG,且IgM常伴κ轻链沉积。电镜下内皮侧可见大量电子致密物,有时凸向管腔,形成毛细血管袢腔内栓子。电子致密物为直径约30 nm的管状结构,或呈束状曲线样,横切面则呈轮状改变。
非HCV相关冷球蛋白血症肾外损害主要表现为皮肤血管炎,16%~70%患者RF阳性。
本患者以皮肤紫癜为首发表现,在排除ANCA相关性血管炎、过敏性紫癜和系统性红斑狼疮等常见皮肤紫癜疾病后,未重视患者有冷球蛋白血症、高水平RF及IgM升高等情况,在随访中也未及时复查。因此,临床医师应加强对冷球蛋白血症肾损害这种少见疾病的认识。
本患者出现冷球蛋白血症的病因
本患者明确诊断为冷球蛋白血症肾损害,因不能行冷球蛋白免疫固定电泳,暂未明确冷球蛋白类型。根据患者RF高滴度伴IgM升高、免疫固定电泳示κ型IgM单克隆免疫球蛋白条带、肾组织免疫荧光同时存在IgG和IgM沉积,考虑Ⅱ型冷球蛋白血症可能性大。
导致冷球蛋白血症常见疾病有淋巴组织增生性疾病(如多发性骨髓瘤、华氏巨球蛋白血症和慢性淋巴细胞白血病等)、感染(如HCV感染)及自身免疫性疾病等。
本患者HCV阴性,虽有乙型肝炎病史,但乙型肝炎病毒DNA持续阴性,曾有肝酶升高,但短期护肝治疗后即恢复正常,不支持感染相关的冷球蛋白血症。
本患者为老年男性,自身抗体阴性,也不支持自身免疫性疾病。老年男性,贫血严重伴血IgM升高,免疫固定电泳κ型IgM单克隆免疫球蛋白条带,但无淋巴结肿大,血、尿游离轻链及肾组织轻链染色均阴性,骨髓细胞及组织学检查浆细胞仅轻度增多,目前诊断多发性骨髓瘤、华氏巨球蛋白血症和慢性淋巴细胞白血病等需淋巴组织增生性疾病的依据不足。
最近有研究报告一组非HCV相关冷球蛋白血症患者均为Ⅱ型混合型冷球蛋白,由单克隆IgM 和多克隆IgG组成, 50%为原发性冷球蛋白血症,其中30%在随访中进展至B细胞淋巴瘤,5%继发于非霍奇金淋巴瘤(NHL)。
另一项研究显示,31%非HCV相关冷球蛋白血症继发于血液系统疾病(主要是NHL)。非HCV相关冷球蛋白血症进展为NHL的风险是HCV相关冷球蛋白血症的4倍。
本例患者目前未能找到冷球蛋白血症的明确病因,但存在单克隆免疫球蛋白条带,骨髓活检见浆细胞轻度增多,随访中尤其须注意是否进展为B细胞淋巴瘤。
冷球蛋白血症肾损害的治疗
文献建议,在冷球蛋白血症出现肾小球肾炎等合并症时,应予血浆置换联合大剂量激素和CTX或利妥昔单抗(RTX)治疗。
血浆置换DFPP较血浆置换能相对高选择性地清除血浆中分子量较大的致病物质,保留人体必需成分,利于迅速缓解病情,减少血浆和(或)白蛋白输入量。但在治疗间期,器官及组织间隙冷球蛋白及RF返回血液致浓度有所反弹,且DFPP清除致病物质选择性相对较高,应据致病物质分子量选择滤器。
本患者血清中存在κ型IgM单克隆免疫球蛋白条带,推测其RF为IgM型免疫复合物可能性大,但其冷球蛋白类型尚不明确,否则可据其分子大小,选择更适宜滤器,达到更好效果。
病因治疗DFPP仅部分清除冷球蛋白,不能阻断其产生。故还须进一步明确病因,选择适宜免疫抑制剂方案,从根本上阻止冷球蛋白产生。患者早期接受免疫抑制剂治疗病情相对稳定,也支持该观点。
B淋巴细胞克隆增殖产生IgM-RF是形成混合性冷球蛋白血症的关键。本例血清免疫固定电泳存在κ型IgM单克隆免疫球蛋白条带,提示存在B细胞活化和克隆增殖,可选择激素、CTX或RTX等药物。RTX直接针对B淋巴细胞特异性CD20抗原,有研究示针对B细胞的治疗可改善冷球蛋白血症的临床症状。但尚无前瞻性、对照临床试验来评价不同治疗方案的优劣,也缺乏RTX相关并发症资料。本患者血CD20水平并不高,故未建议其接受RTX治疗。
本例在DFPP后冷球蛋白和RF明显下降,在加用激素后,病情明显改善,尿量增加,血Cr降至2.7 mg/d。我们建议其采用CTX冲击治疗,但患者未接受。后其病情加重,最终进入维持性血液透析治疗。
■ 小结
有关非HCV相关冷球蛋白血症的研究较少。本患者在DFPP联合激素治疗后,病情得到改善,但其病因须在随访中进一步明确。临床医师应提高对冷球蛋白血症特点的认识,避免贻误治疗时机,并进一步探求这类疾病更好的治疗方案。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#皮肤紫癜#
67
#紫癜#
69