Nat. Med.:肠道细菌控制过敏症?
2012-04-14 towersimper 生物谷
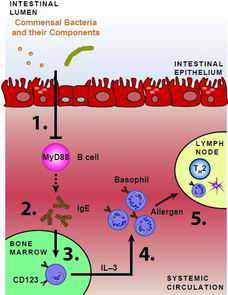
嗜碱性粒细胞发育、循环流通的嗜碱性粒细胞群体和与嗜碱性粒细胞相关联的TH2细胞的共生调控模型。 100万亿多个细菌细胞生活在每个人的肠道内,比人体本身所拥有的细胞数量多10倍。如今,美国宾夕法尼亚大学佩雷尔曼医学院(Perelman School of Medicine)微生物学副教授David Artis博士和博士后研究员David Hill与来自在美国费城儿童医院、日本和德国公共机构的研究人

嗜碱性粒细胞发育、循环流通的嗜碱性粒细胞群体和与嗜碱性粒细胞相关联的TH2细胞的共生调控模型。
100万亿多个细菌细胞生活在每个人的肠道内,比人体本身所拥有的细胞数量多10倍。如今,美国宾夕法尼亚大学佩雷尔曼医学院(Perelman School of Medicine)微生物学副教授David Artis博士和博士后研究员David Hill与来自在美国费城儿童医院、日本和德国公共机构的研究人员,发现这些人肠道内共生菌(commensal bacteria)可能在影响和控制过敏性炎症(allergic inflammation)中发挥着一种重要的作用。人类和体内细菌之间产生的这种共生关系对彼此都有利。相关研究结果于2012年3月25日发表在Nature Medicine期刊上。
已有研究证实选择性操纵共生菌群体能够影响免疫系统,比如对病人的研究提示着共生菌群体的变化或者服用广谱抗生素能够让他们容易患上全身性过敏症,而在动物模式的研究则表明共生菌能够影响肠道内局部免疫细胞。但是共生菌影响宿主免疫系统(特别是到底影响宿主免疫系统中哪些部分)的细胞和分子机制,人们还没有得到很好地理解。
Artis和他的同事们集中研究一种被称作嗜碱性粒细胞(basophil)的白细胞在导致过敏性炎症产生中所起的作用,以及嗜碱性粒细胞反应和过敏症之间的关系。
研究人员让小鼠口服广谱抗生素从而清除某些类型的细菌,随后研究血液中循环流通的嗜碱性粒细胞数量的变化。
利用肺部过敏性炎症(拥有一些与人哮喘相同的特征)的小鼠模式动物作为研究对象,他们发现抗生素治疗导致嗜碱性粒细胞反应显著性提高,而且嗜碱性粒细胞介导的过敏性气道炎症(allergic airway inflammation)严重程度显著地加深。此外,他们也观察到小鼠血清IgE水平增加。
在经过抗生素治疗的小鼠接触到屋尘螨(house dust mite)过敏原之后,它们在血液和淋巴结中产生较高的嗜碱性粒细胞反应,并表现出加重的过敏反应,而且在肺部产生增强的炎症反应。
在无菌环境中培养的无菌小鼠缺乏所有活着的共生菌,而且它们表现出在抗生素治疗的小鼠接触屋尘螨过敏原之后观察到的类似反应。这一发现表明共生菌来源的信号负责维持正常的嗜碱性粒细胞数量保持不变。
Artis和他的同事们也发现血清IgE浓度和循环流通的嗜碱性粒细胞数量受到B细胞内源性表达的髓系分化因子88(myeloid differentiation factor 88, MyD88)的限制。已知MyD88在识别细菌来源因子中发挥着作用,而且来自共生菌的信号通过IgE限制骨髓中嗜碱性粒细胞前体细胞(basophil precursor cell)的增殖来控制循环流通的嗜碱性粒细胞数量。
归纳在一起,这些发现表明常驻性共生菌群体影响和控制嗜碱性粒细胞反应,从而影响身体对我们环境中过敏原作出的反应。
鉴定出共生菌、嗜碱性粒细胞和过敏症之间存在的机制性关联有助于人们开发出治疗性药物来阻断或抑制过敏症产生。进一步研究和鉴定这些共生途径也可能有助于揭示与免疫系统功能相关联的其他慢性疾病。(生物谷:towersimper编译)

doi:10.1038/nm.2657
PMC:
PMID:
Commensal bacteria–derived signals regulate basophil hematopoiesis and allergic inflammation
David A Hill, Mark C Siracusa, Michael C Abt, Brian S Kim, Dmytro Kobuley, Masato Kubo, Taku Kambayashi, David F LaRosa, Ellen D Renner, Jordan S Orange, Frederic D Bushman & David Artis
Commensal bacteria that colonize mammalian barrier surfaces are reported to influence T helper type 2 (TH2) cytokine-dependent inflammation and susceptibility to allergic disease, although the mechanisms that underlie these observations are poorly understood. In this report, we find that deliberate alteration of commensal bacterial populations via oral antibiotic treatment resulted in elevated serum IgE concentrations, increased steady-state circulating basophil populations and exaggerated basophil-mediated TH2 cell responses and allergic inflammation. Elevated serum IgE levels correlated with increased circulating basophil populations in mice and subjects with hyperimmunoglobulinemia E syndrome. Furthermore, B cell–intrinsic expression of myeloid differentiation factor 88 (MyD88) was required to limit serum IgE concentrations and circulating basophil populations in mice. Commensal-derived signals were found to influence basophil development by limiting proliferation of bone marrow–resident precursor populations. Collectively, these results identify a previously unrecognized pathway through which commensal-derived signals influence basophil hematopoiesis and susceptibility to TH2 cytokine–dependent inflammation and allergic disease.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Nat#
71
#肠道细菌#
68
#过敏症#
68
#Med#
50