BMJ:新发现——这样吃脂肪,让你远离偏头痛!
2021-07-16 MedSci原创 MedSci原创
H3-L6和H3干预措施改变了牵涉到头痛发病机制的生物活性介质,减少了头痛的频率和严重程度。
偏头痛是全世界最大的残疾原因之一。尽管过去十年中偏头痛的治疗方案有所改善,但许多患者尽管服用多种药物,仍会出现严重的疼痛和残疾。与许多因素的慢性病一样,对基本生物机制的不完全了解限制了偏头痛的预防和治疗进展。
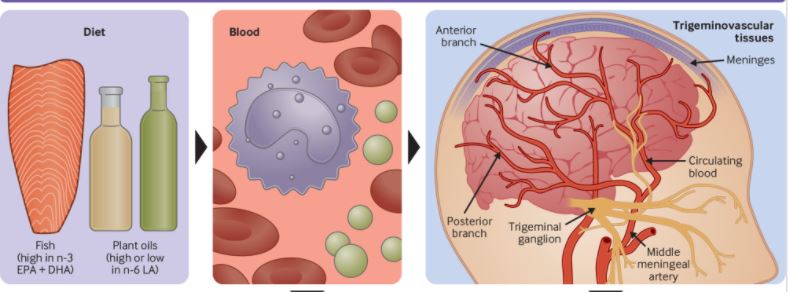
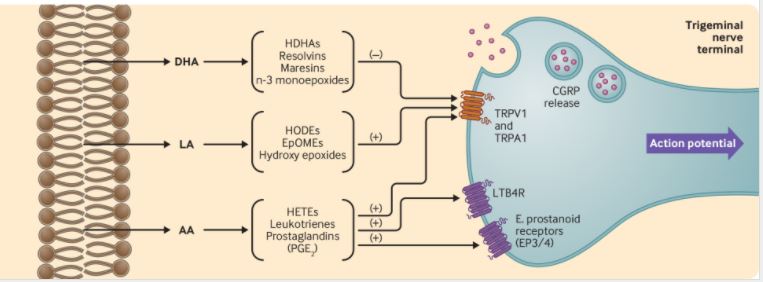
n-3和n-6脂肪酸是与偏头痛发病机制有关的组织的主要成分,它们是调节疼痛的几种生物活性脂质介质(如前列腺素、白三烯、解毒素、马来素)的前体。由于人类不能从头合成n-3和n-6脂肪酸,这些脂肪酸及其氧化脂衍生物的水平可以通过饮食来改变。
今年来的研究表明,衍生自n-6脂肪酸的几种氧脂类物质具有代偿性(促进疼痛)的特性。例如,输注衍生自n-6花生四烯酸的前列腺素可唤起人类类似偏头痛的发作。n-6亚油酸的氧脂类衍生物可使三叉神经末梢敏感,并在临床前模型中唤起行为疼痛反应。
相比之下,由n-3二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)衍生出的几种草脂类化合物具有强大的抗痛(减少疼痛)特性。其中,17-羟基二十二碳六烯酸(17-HDHA)是几个氧化脂类家族的途径前体,据报道在实验模型中具有强大的抗痛作用,并与关节炎患者的疼痛评分降低有关。
饮食中的n-6和n-3脂肪酸及其氧化脂衍生物与头痛发病机制的关系
那么,增加n-3脂肪酸和不减少n-6亚油酸的情况下,饮食干预是否能改变牵涉到头痛发病机制的循环脂质介质,并减少成人偏头痛患者的头痛呢?来自美国国立卫生研究院下属的美国国立衰老研究所的专家近期在BMJ期刊上给出了自己的答案。
来自美国的学术医疗中心的研究人员设计了一项三臂、平行组、随机、改良双盲、对照试验,为期16周。招募182人(88%为女性,平均年龄38岁),每月有5-20天偏头痛(67%符合慢性偏头痛的标准)的患者。将EPA、DHA和亚油酸的改变作为控制变量设计的三种饮食:
H3饮食(n=61)--将EPA+DHA增加到1.5克/天,将亚油酸维持在能量的7%左右;
H3-L6饮食(n=61)--将n-3 EPA+DHA增加到1.5克/天,将亚油酸减少到能量的≤1.8%;
对照饮食(n=60)--将EPA+DHA维持在<150毫克/天,亚油酸维持在能量的7%左右。
饮食对前体脂肪酸的影响:三种前体脂肪酸在红细胞和免疫细胞的分布。
所有参与者接受占每日食物能量三分之二的食物,并继续接受常规护理。主要的结局终点是第16周时血液中抗痛介质17-HDHA和头痛影响测试(HIT-6)的结果。
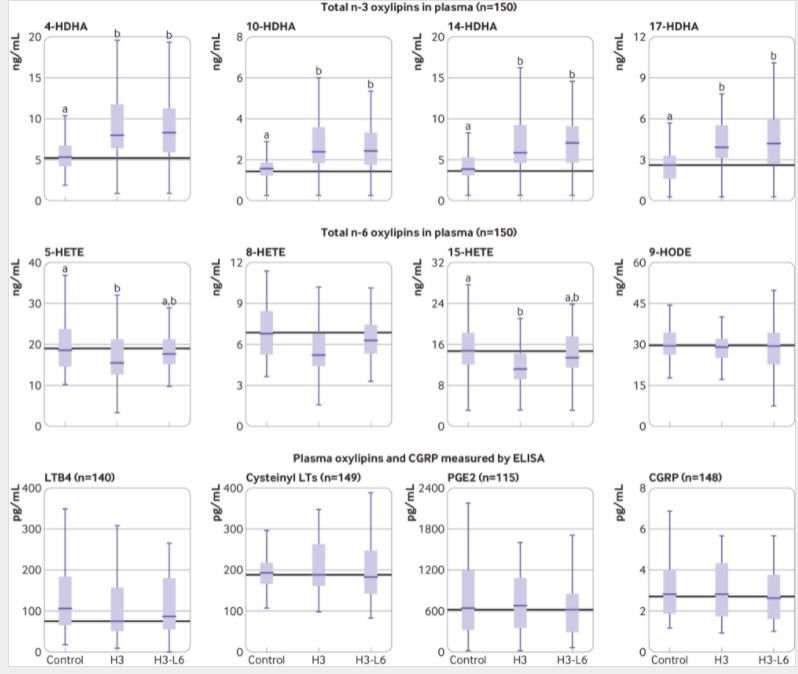
结果显示,在意向性治疗分析中(n=182),与对照组饮食相比,H3-L6和H3饮食增加了17-HDHA(平均差异分别为0.6,95%CI:0.2-0.9;0.7,95%CI:0.4-1.1)。但两组观察到的HIT-6评分没有统计学意义(分别为-1.6,95%CI:-4.2~1.0,-1.5,95%CI:-4.2~1.2)。
饮食对氧化脂质和CGRP的影响:血浆中氧化脂质和CGRP的最终测量分布。
与对照组相比,H3-L6和H3膳食减少了每天的总头痛时间(分别为-1.7,95%CI:-2.5~-0.9,和-1.3,95%CI:-2.1~-0.5)、每天的中度至重度头痛时间(-0.8,95%CI:-1.2~-0.4,和-0.7,-1.1~-0.3)以及每月的头痛天数(-4.0,-5.2~-2.7,和-2.0,-3.3~-0.7)。
其中,H3-L6比H3饮食更能减少每月的头痛天数(-2.0,95%CI:-3.2~-0.8),这表明降低饮食中的亚油酸会带来额外的好处。H3-L6和H3饮食改变了n-3和n-6脂肪酸以及它们在血浆、血清、红细胞或免疫细胞中的几种痛觉氧化脂衍生物,但没有改变经典的头痛介质CGRP和PGE2。
由此可见,H3-L6和H3干预措施改变了牵涉到头痛发病机制的生物活性介质,减少了头痛的频率和严重程度。
参考文献:
Dietary alteration of n-3 and n-6 fatty acids for headache reduction in adults with migraine: randomized controlled trial. BMJ 2021;374:n1448
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#新发现#
67
#BMJ#
62
学习了
70