谭紫凝:角蛋白17影响电离辐射引起的放射性皮肤损伤中整体基因的表达并控制G2/M细胞周期转变
2023-12-27 医悦汇 医悦汇 发表于上海
本期文献内容由吉林大学病理生物学教育部重点实验室辛颖教授课题组谭紫凝分享肿瘤治疗相关领域及病理生物学研究领域最新进展,以供交流!
编者按:电离辐射(IR)广泛应用于癌症治疗。电离辐射引起的脱发和皮肤损伤(放射性皮炎(RD))是放射治疗的常见副作用。本期文献内容由吉林大学病理生物学教育部重点实验室辛颖教授课题组谭紫凝分享肿瘤治疗相关领域及病理生物学研究领域最新进展,以供交流!
研究背景
电离辐射(IR)广泛应用于癌症治疗。电离辐射引起的脱发和皮肤损伤(放射性皮炎(RD))是放射治疗的常见副作用。在先前的研究中,作者发现角蛋白17(K17)在RD啮齿动物模型中首先下调,而后显著上调。但目前尚不清楚K17是否以及如何参与了IR引起的放射性皮肤损伤。
角蛋白构成了上皮细胞的中间丝细胞骨架。K17参与调节皮肤的多种功能,包括毛发发育及其循环再生、炎症和细胞因子的产生,以及细胞的生长和凋亡。K17还参与了疾病的进展,如银屑病和DNA损伤反应。这是由于K17的非经典作用,它可以帮助运输细胞功能的关键调节因子(14-3-3蛋白、异质核核糖核蛋白K、自身免疫调节因子和p27)。
另一个公认的IR诱导的遗传毒性应激的调节因子是P53,它的激活触发了大量下游目的基因的表达。毛基质角质形成细胞(KCs)中p53依赖性细胞凋亡的激活已在辐射诱导的脱发中得到证实。然而,在野生型(WT)和p53-/-小鼠之间的RD反应并没有差异,表皮KCs主要发生了有丝分裂突变(MC)而不是细胞凋亡。之前的研究表明,p53激活的动力学决定了细胞在遗传毒性应激下的命运选择,但p53的作用似乎依赖于细胞环境。
在K17-/-小鼠中,作者发现K17可以调节辐射引起的脱发和RD反应,K17对放射性皮肤损伤中整体的基因表达有重大的意义。K17的缺失将导致IR后表皮KCs中出现MC。因此,K17是IR诱导放射性皮肤损伤关键调节因子。
研究结果
结果一:K17调节IR引起的皮肤损伤
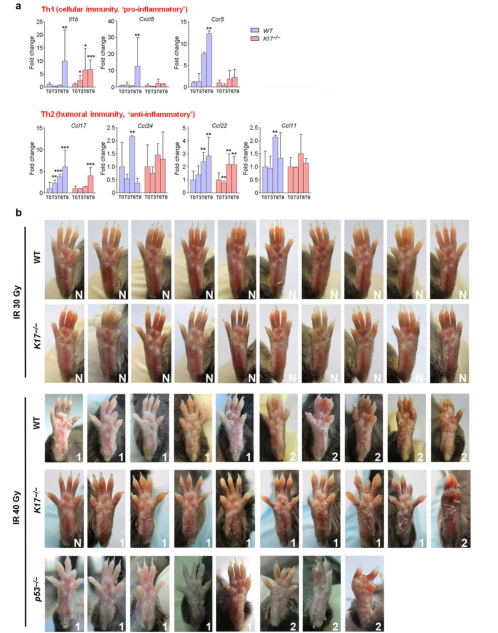
为了评估K17在IR诱导的毛囊(HF)损伤中的作用,作者对2个月大的雄性小鼠进行脱毛以诱导毛发的活跃生长,并应用5 Gy的剂量单次辐照。WT小鼠出现了部分脱发和毛发发育不良,K17-/-小鼠的损伤则更加严重,而P53-/-的大多数小鼠并未出现这些损伤性的改变(图1a和1b)。作者继续检测了K17-/-中出现RD反应的小鼠。对小鼠的足垫皮肤给予40Gy的剂量单次辐照,WT组和P53组的小鼠均产生了相似脱皮反应(I级损伤),这证实了作者之前的结果。然而,在K17-/-小鼠中观察到了较轻的炎症反应,伴有皮肤的肿胀和渗出的II级损伤减轻,(图1c和1d)。因此,K17可以同时调节辐射诱导的脱发和RD反应。
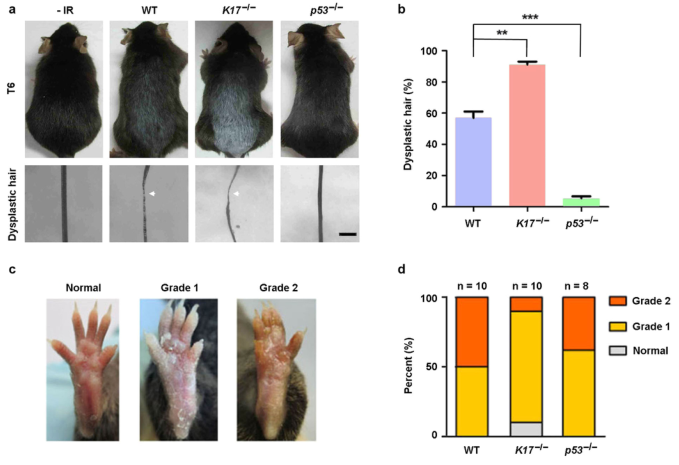
图1
结果二:K17在IR诱导的皮肤损伤中对整体基因表达的影响
组织学分析揭示了IR后HFs内的形态变化,其中包括分布在整个毛基质中的深色黑色素团块和毛基质营养不良,这在K17-/-小鼠中的损伤更为严重,而在p53-/-小鼠的HFs中观察到的损伤较轻(补充图 S1a)。一致地,作者利用TUNEL染色,检测到了K17-/-小鼠的HFs中有更多的凋亡细胞,但在p53-/-的HFs中无凋亡细胞(补充图 S1b)。Cleaved caspase-3染色进一步证实,毛基质KC在IR诱导后发生了细胞凋亡(补充图 S1b)。辐照后的皮肤中未检测到Ripk3/Mlkl磷酸化增加,提示皮肤未发生细胞坏死(补充图 S1c)。这些结果与K17在调节HFs细胞存活和凋亡中的作用一致。
为了更好地了解K17如何调节IR诱导的皮肤损伤,作者在全基因组水平上分析了基因表达的变化。采集全层背部皮肤样本,比较WT、p53-/-、K17-/-小鼠之间的差异表达基因(DEGs)(图2a)。在WT小鼠中,1091个基因在0小时和6小时的样本之间显示出差异表达;在p53-/-小鼠中,基因减少到538个;K17-/-小鼠中的DEGs表达量也减少至475。IR后的24小时观察到类似的表达变化。因此,在K17-/-或p53-/-中,6小时总共800个DEGs(73.3%)和24小时的778个DEGs(74.0%)无显著差异。
为了研究IR后6小时WT皮肤中800个DEGs的功能,作者进行了加权基因共表达网络分析(图2b和补充图S2)。约63%的DEGs被分为两个亚组(蓝色和绿松石模块),分别对应于细胞周期/有丝分裂和细胞凋亡(图2b和2c)。基因本体分析揭示了WT的小鼠皮肤中有比p53-/-和K17-/-更多受干扰的通路,这与WT小鼠中具有更多DEGs的事实一致(图2d)。基因本体轨迹分析进一步表明关键功能组包括细胞周期/有丝分裂、细胞凋亡、肌肉系统过程和免疫反应(图2e)。由于K17不在肌肉中表达,这可能是一种间接的结果。总之,作者的数据表明K17可以直接或间接影响放射性皮肤损伤中的整体基因表达。
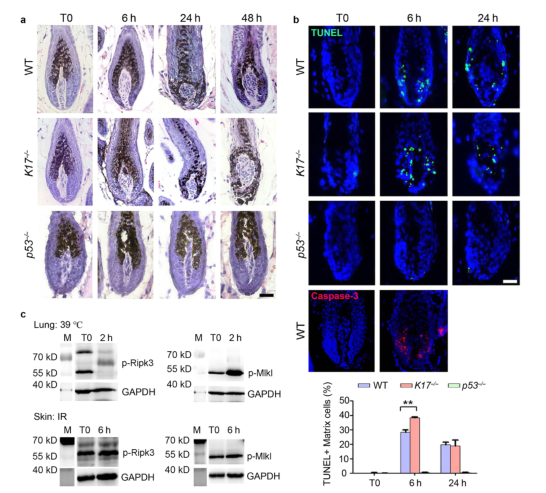
补充图S1
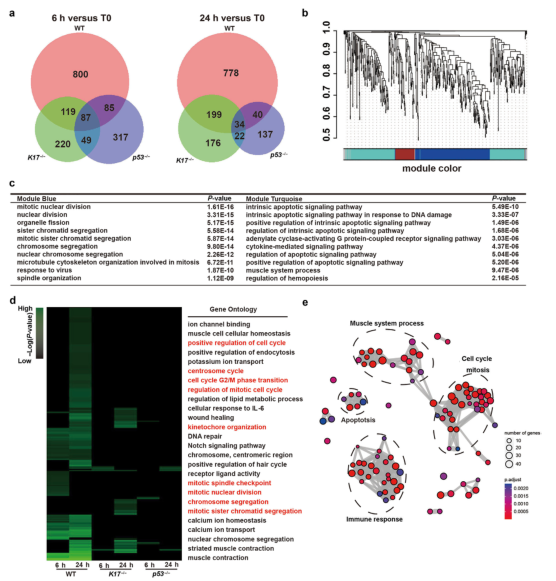
图2
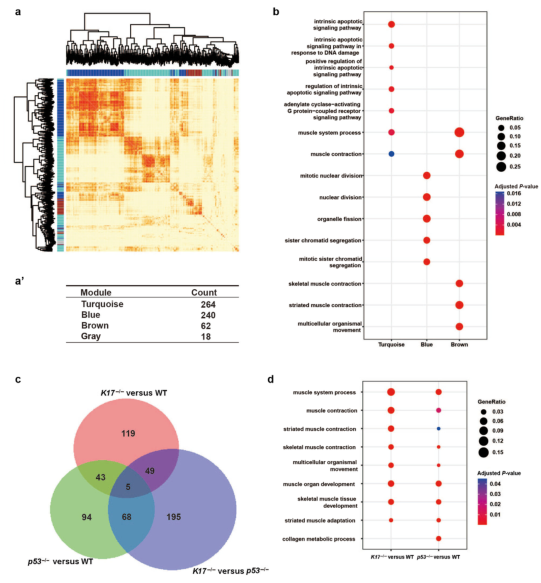
补充图S2
结果三:K17不干扰P53的激活
作者通过对全层小鼠皮肤样本进行蛋白质印迹分析,检测K17是否可以通过调节P53的激活动态来调节基因的表达。结果显示,在IR后4小时P53的积聚达到峰值,WT和K177-/-小鼠皮肤之间的峰值幅度或达到峰值的时间没有差异(图3a和补充图S3)。由于细胞凋亡主要发生在活跃生长的毛基质中,作者还分析了毛发休止期的样本。这些样本中的p53水平在IR后的8-10小时达到峰值(图3a和3b)。皮肤在生长期和休止期的峰值幅度没有差异,但在休止期的峰值时间间隔加倍(图3c和3d)。
使用免疫组织化学进一步检测p53的激活。在HFs和表皮KCs中观察到p53的核积累(图3e和3f)。统计学分析,WT和K17-/-组小鼠之间p53阳性核的差异无统计学意义(图3g)。因此,K17可能不会干扰p53激活的程度和动力学。
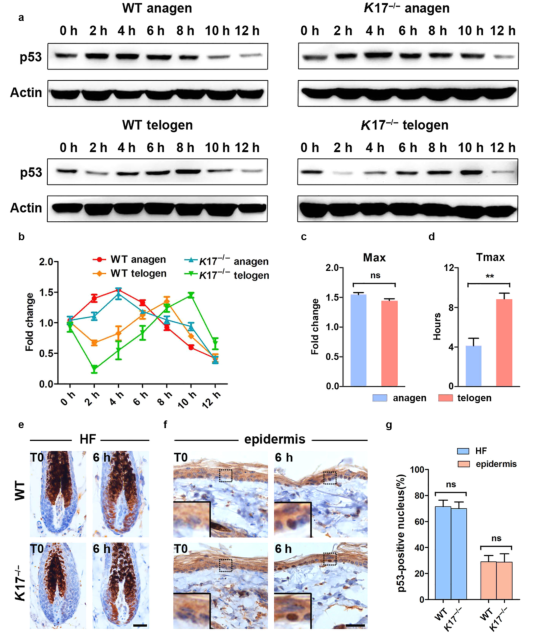
图3
补充图S3
结果四:仅少量DEGs是IR诱导的皮肤损伤中p53的直接靶基因
为了研究p53如何调节基因表达,作者进行了染色质免疫沉淀和测序(CHIP-seq)。在IR后6小时对皮肤样本进行分析,并以未受照射的皮肤(day 0)为对照。在全基因组水平上,分析了P53峰的定位。在2909个峰中,44%位于远端基因间,24.1%位于转录起始位点上游10kb以内,27%位于内含子,2.8%位于编码外显子(图4a)。
当作者将CHIP-seq和RNA测序数据结合起来时,只有33个基因同时存在差异表达,并且在转录起始位点10kb内有p53结合峰(图4b)。其中,11个基因上调,可能是潜在的p53靶基因(图4c和补充数据表S1)。作者还参考了已建立的p53靶基因库检查了DEGs。在343个共有p53靶基因中,有323个在小鼠皮肤中表达;然而,只有34个基因表现出差异表达,其中20个基因在转录起始位点10kb范围内具有p53结合峰。结合基因调控的两个标准:差异表达和近端p53结合,仅鉴定出三个经典基因:Bbc3、Ccng1和Trp53inp1(图4d和补充数据表S2)。这些基因表达的变化如图4e所示。
作为验证数据的另一种方法,作者分析了共有的p53结合序列,这与之前的结果有很好的相关性(补充图S4)。对于经典的p53靶基因(Bbc3、Ccng1、Cdkn1a和Bax),在WT和K17-/-皮肤的近端启动子中均鉴定出了p53结合峰(图4f)。转录起始位点和H3K4me3 CHIP-seq峰的重叠证明了这一点(图4f)。因此,放射性皮肤损伤中的大多数DEGs似乎不是直接的p53靶基因。
此外,作者研究了K17是否通过改变基因组中的p53结合来调节基因的表达。在K17-/-小鼠中,p53结合峰的总数显着减少(从2909减少到1100)(图4g)。此外,p53结合峰在WT和K17-/-小鼠中并未共定位。当认为10 kb距离内的结合是重叠时,只有188个共同峰;而当认为1 kb距离内的结合是重叠时,只有37个共同峰(图4h和4i)。因此,K17对基因组中p53的结合具有重要的影响,这可能为超过70%的DEGs受到p53和K17共同调节提供了合理的解释。以上结果表明K17通过间接机制来调节放射性皮肤损伤中的大多数DEGs。
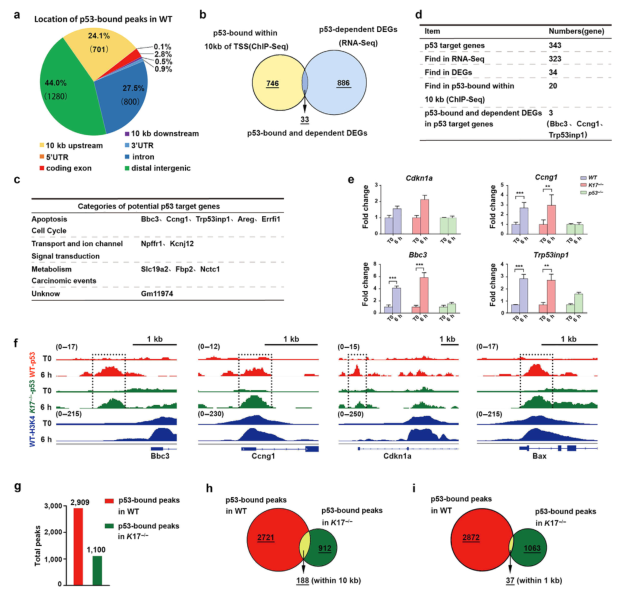
图4
补充数据表S1

补充数据表S2
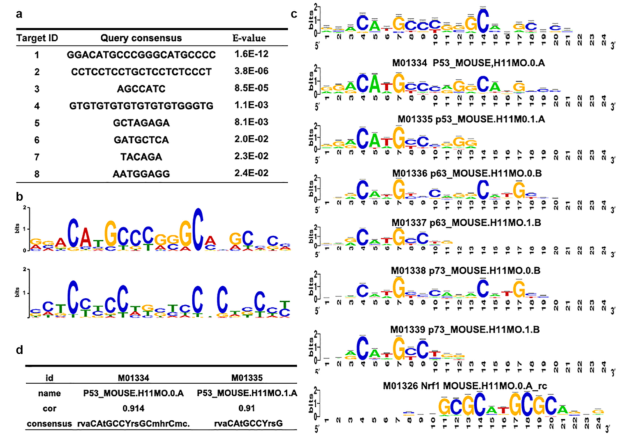
补充图S4
结果五:K17控制G2/M细胞周期转换
为了研究K17如何调节RD,作者分析了小鼠足垫皮肤中的基因表达变化。先前的研究表明,K17控制细胞因子/趋化因子基因的表达。一致地,作者发现K17-/-皮肤中的促炎细胞因子/趋化因子基因的表达水平降低(补充图S5a)。K17-/-皮肤对IR并不敏感,因为较低剂量的30Gy射线没有引起WT或K17-/-小鼠的形态变化(补充图S5b)。
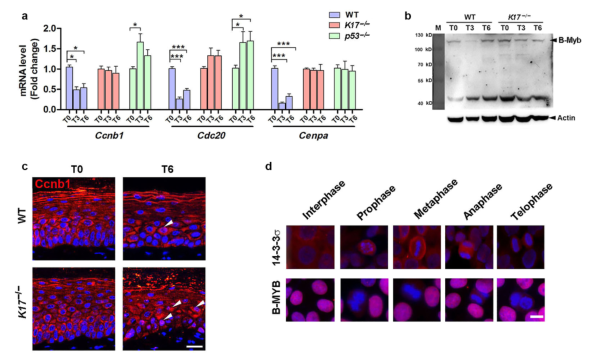
作者先前已经证明,表皮KCs在照射后会发生MC。在本研究中,作者利用组织学分析、组蛋白H3磷酸染色和透射电子显微镜,发现MC细胞在K17-/-和P53-/-皮肤(图5a、5b和c)的百分比相当。结果显示,K17-/-皮肤的有丝分裂过程中,许多细胞功能受到干扰,包括染色体分离和核分裂(图5d)。参与G2/M转变的基因(Ccnb1(细胞周期蛋白B1)、Ccnb2(细胞周期蛋白B2)、Cdc20和Cenpa)在WT小鼠中下调,但在K17-/-小鼠中保持不变(图5e和补充图S5a)。因此,WT小鼠中的G2/M转换被阻滞(G2停滞),但这种阻滞在K17-/-小鼠中幸免。尽管如此,这些细胞仍然无法完成分裂导致MC的发生。
G2/M细胞周期转换和相关基因的表达是由Myb/MuvB复合体控制的。此外,p53还通过这种机制调节G2/M期的转换。在表皮KCs中,大约90%的细胞核是B-Myb阳性,但IR后的3-6天只有60%的细胞核保持阳性;这种B-Myb核染色的减少并未发生在K17-/-的皮肤中(图5f和g)。在IR后第3天,WT皮肤中B-Myb的总水平下降,但这种下降在K17-/-中并不显著皮肤(图5h)。作者还证实了K17-/-皮肤中14-3-3的核保留增加(图5i和5j),同时核细胞周期蛋白B1增加(图5k和补充图S6)。基于这些数据,作者提出了K17是通过B-Myb和14-3-3s来调节G2/M细胞周期转换的。
补充图S5
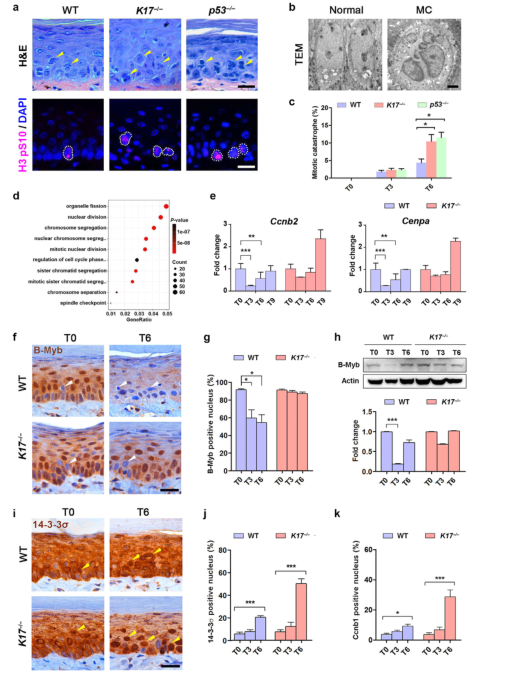
图5
补充图S6
结果六:K17促进IR后的B-Myb降解
为了进一步评估K17在IR损伤中的功能意义,作者使用CRISPR/Cas9敲除HeLa和HaCaT细胞中的K17(补充图 S7a)。在这些细胞系中,单剂量5Gy IR可以有效地将细胞周期阻滞在G2期,随后具有异常核形态的M期细胞数量增加(补充图S8和图6a和6b)。免疫染色显示WT细胞中IR后的16小时和20小时B-MYB减少,这在K17-/-细胞中未观察到(图6b),这一观察结果也得到了蛋白质印迹分析的证实(图6c和6d)。由于IR后B-Myb在mRNA水平上没有表现出差异表达,蛋白酶体抑制剂MG132阻止了B-MYB在蛋白质水平上的减少(补充图S7b),因此推测K17可能参与调节了B-MYB蛋白质降解。最后,作者证明K17可能是通过其卷曲结构域结合到了B-MYB的N末端,但不结合到C末端(图6e和6f)。免疫沉淀实验的结果表面,K17还与HeLa/HaCaT细胞和小鼠体内皮肤中的内源性B-MYB相关(补充图S7e)。相反,作为G2/M 转换中的另一个辅助因子,FOXM1不与K17相互作用(补充图 S7d和7e),表明K17/B-MYB相互作用的特异性。
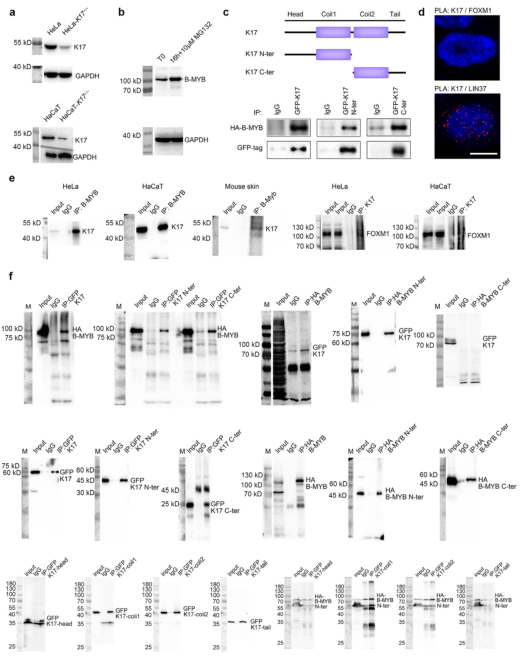
补充图S7
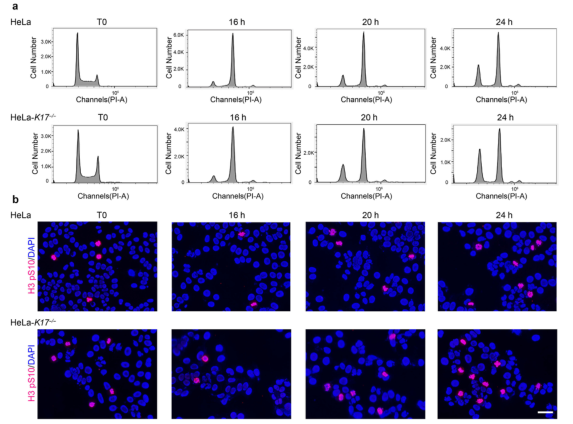
补充图S8
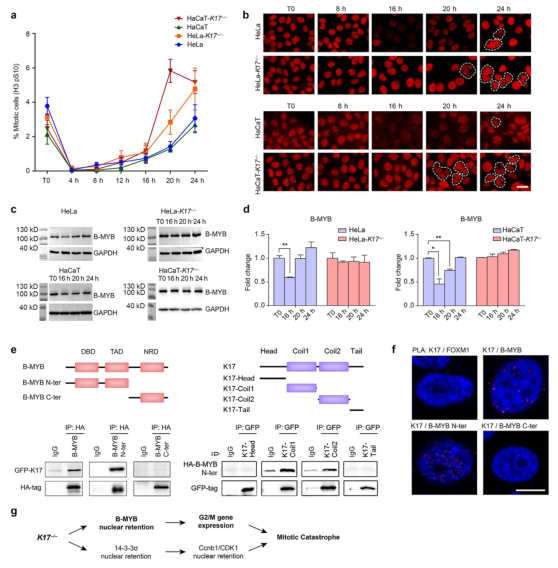
图6
研究结论
K17可以调节辐射引起的脱发和放射性皮炎反应,并直接或间接影响放射性皮肤损伤中的整体基因表达。
K17的缺失会导致表皮角质形成细胞异常的细胞周期进程和有丝分裂突变,从而减少G2/M细胞周期转变的关键调节因子B-Myb的降解。K17是放射性皮肤损伤的关键调控因子和治疗靶点。
原文出处:Yue Z, Lin J, Lu X, et al. Keratin 17 Impacts Global Gene Expression and Controls G2/M Cell Cycle Transition in Ionizing Radiation-Induced Skin Damage. J Invest Dermatol. 2023 Dec;143(12):2436-2446.e13. doi: 10.1016/j.jid.2023.02.043. Epub 2023 Jul 4. PMID: 37414246.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#放射性皮炎# #电离辐射# #放射性皮肤损伤#
52