浙工大毕晓宝/华东理工叶邦策ACS Nano:肠道益生菌来源的免疫细胞衔接器,助力肿瘤免疫治疗
2024-11-01 BioMed科技 BioMed科技 发表于上海
该研究设计制备了一种基于细菌外膜囊泡和纳米抗体的新型免疫细胞衔接器用于治疗实体瘤。
免疫细胞衔接器(Immune Cell Engager, ICE)是一种治疗肿瘤的多特异性抗体,其通过两个分别亲和免疫细胞和肿瘤细胞的抗体臂招募免疫细胞向肿瘤细胞靠近,并激活免疫细胞杀死肿瘤细胞。常见的免疫细胞衔接器是T细胞衔接器,其他细胞衔接器如NK细胞衔接器,巨噬细胞衔接器等也在开发。由于免疫细胞衔接器的蛋白特性,其面临着体内半衰期短,成本高,设计复杂等问题。此外,现有多数衔接器只能招募一种免疫细胞,达不到协同治疗的效果。细菌外膜囊泡(Outer Membrane Vesicle, OMV)由于其纳米尺寸,丰富的免疫原性和易操作性,在肿瘤治疗和疫苗开发上越来越受到关注。
近日,浙江工业大学毕晓宝/华东理工大学叶邦策教授课题组合作在ACS NANO杂志上在线发表了题为“Engineered Outer Membrane Vesicles as Nanosized Immune Cell Engagers for Enhanced Solid Tumor Immunotherapy”的研究成果。该研究设计制备了一种基于细菌外膜囊泡和纳米抗体的新型免疫细胞衔接器用于治疗实体瘤。所开发的新型免疫细胞衔接器可以在肿瘤部位通过外膜囊泡骨架的免疫原性招募多种免疫细胞,并通过负载的两种纳米抗体阻断PD-1/PD-L1和CD47/SIRPα信号通路,增强巨噬细胞和T细胞对肿瘤的杀伤活性,有效抑制肿瘤生长,为免疫细胞衔接器的开发提供了一种新的思路。

该研究首先通过改造尼氏大肠杆菌,纯化获得了表面展示SpyCatcher003蛋白的外膜囊泡OMV-SpC。通过与SpyTag003融合的方式将多聚化的PD-L1和CD47纳米抗体负载到OMV-SpC表面,并在细胞水平测试了不同拷贝数的纳米抗体活性,发现多聚化纳米抗体比单体纳米抗体具有更强的活性。为了更好兼容两种纳米抗体活性,还研究了不同修饰策略对纳米抗体的影响,发现通过SpyCatcher/SnoopCatcher的正交修饰策略能最佳程度的保留纳米抗体的活性,最终成功制备了OMV-NICE免疫细胞衔接器。
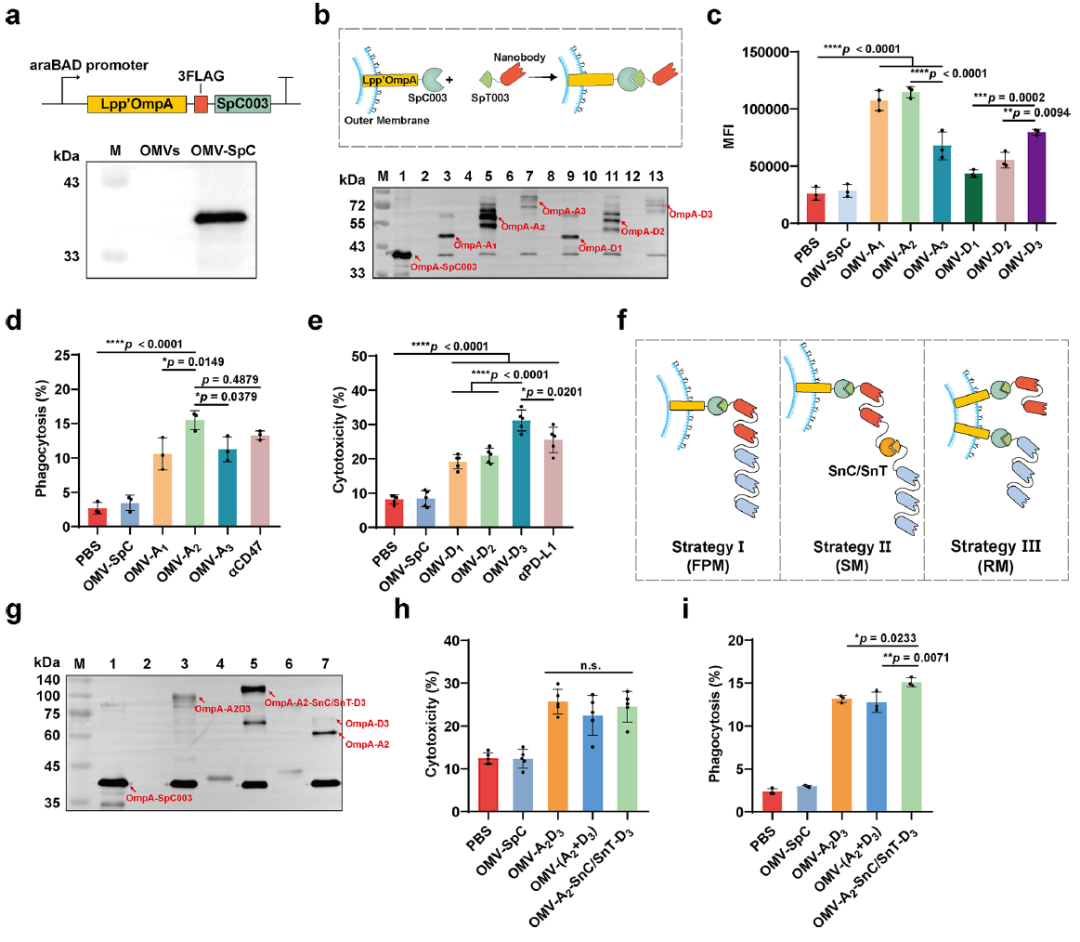
图1. OMV-NICE的制备策略
体外实验证明了OMV-NICE能有效亲和肿瘤细胞,招募原代巨噬细胞(BMDMs)和外周血单核细胞(PBMCs)向B16-F10黑色素瘤细胞的靠近,并通过阻断PD-1/PD-L1和CD47/SIRPα信号通路,发挥了衔接器的作用。研究者对OMV-NICE进行了一系列的表征,并证明OMV-NICE具有良好的生物相容性。此外,OMV-NICE能在体外有效激活原代巨噬细胞和树突状细胞的成熟和分化。
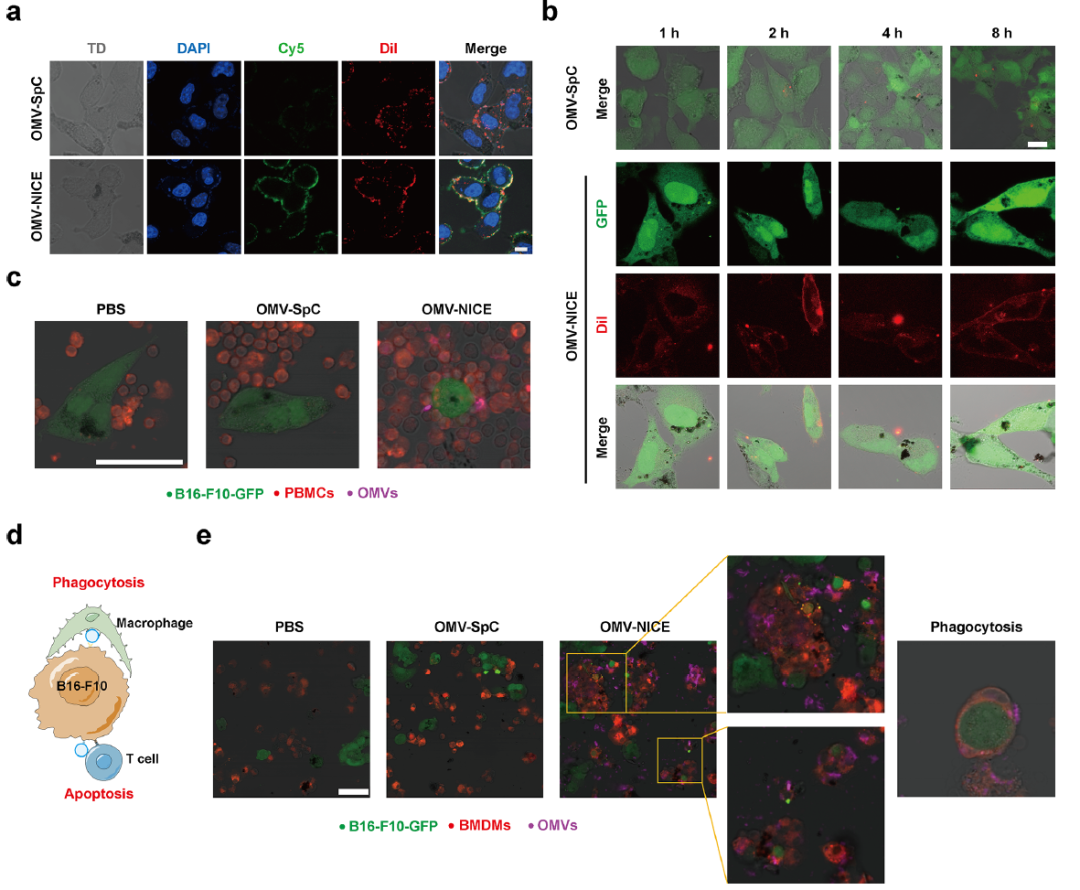
图2. OMV-NICE在体外发挥衔接器作用
作者进一步对OMV-NICE的抗肿瘤作用进行了体内实验,结果显示OMV-NICE在B16-F10黑色素瘤模型上有效抑制了肿瘤的生长,延长了中位生存期。与单独给予纳米抗体(给药剂量100 μg/只)相比,5 μg/只蛋白质量的OMV-NICE就能达到更好的抑制肿瘤的效果,在肿瘤部位提高IFN-γ的浓度。作者还探索了OMV-NICE的作用机制,研究证明了OMV-NICE能在肿瘤部位招募巨噬细胞,提高肿瘤部位M1型巨噬细胞的比例,并且增加巨噬细胞吞噬肿瘤细胞的比例。此外,研究证明了OMV-NICE能在肿瘤部位招募CD4+和CD8+T细胞,并且提高了肿瘤细胞凋亡的比例。以上结论说明OMV-NICE作为新型免疫细胞衔接器,能同时招募巨噬细胞和T细胞,并通过阻断检查点促进巨噬细胞和T细胞对肿瘤的杀伤。
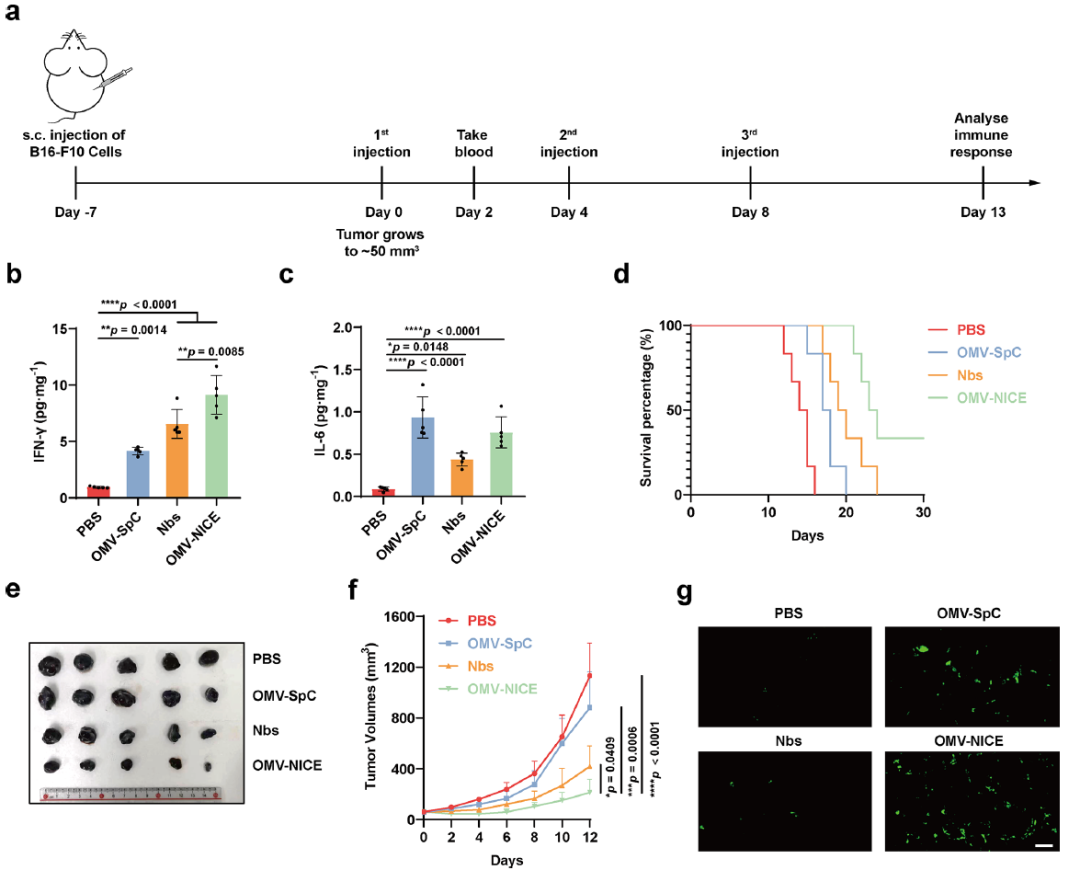
图3. OMV-NICE有效抑制B16-F10肿瘤模型
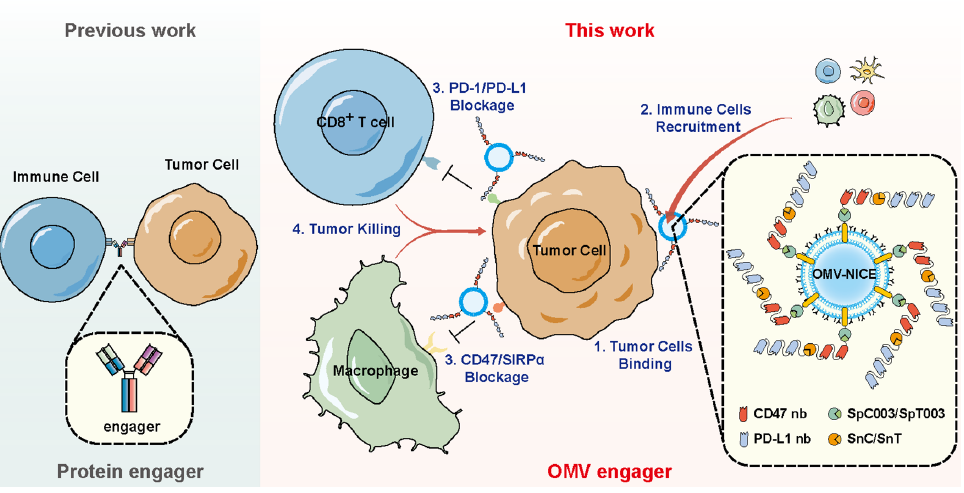
图4. 文章总结图
文章结论与讨论,启发与展望
综上所述,本文构建了一种基于细菌外膜囊泡和纳米抗体的新型免疫细胞衔接器用于实体瘤的治疗。该研究对纳米抗体的修饰方法进行了充分深入的探索,体内外实验证明了OMV-NICE招募免疫细胞和促进免疫细胞杀伤肿瘤的能力,并阐明了其作用机制。作为一种新型的免疫细胞衔接器,进一步阐明其在体内的作用及完善其在体内的代谢是未来进一步需要深入研究的问题。外膜囊泡可以招募多种免疫细胞,针对不同肿瘤和不同免疫细胞制定特定策略和协同治疗,为更多的免疫细胞衔接器开发提供了更加便利有效的方案。
浙江工业大学绿色制药协同创新中心博士研究生孙迦楠为论文第一作者。华东理工大学叶邦策教授、浙江工业大学毕晓宝教授为论文共同通讯作者。浙江工业大学绿色制药协同创新中心为论文第一和通讯单位。
参考文献
1.Tian, Z.; Liu, M.; Zhang, Y.; Wang, X. Bispecific T Cell
Engagers: An Emerging Therapy for Management of Hematologic
Malignancies. J. Hematol. Oncol. 2021, 14, No. 75.
2. Fenis, A.; Demaria, O.; Gauthier, L.; Vivier, E.; NarniMancinelli, E. New Immune Cell Engagers for Cancer Immunotherapy. Nat. Rev. Immunol. 2024, 24, 471−486.
3. Yuan, H.; Jiang, W.; Von Roemeling, C. A.; Qie, Y.; Liu, X.; Chen, Y.; Wang, Y.; Wharen, R. E.; Yun, K.; Bu, G.; Knutson, K. L.; Kim, B. Y. S. Multivalent Bi-Specific Nanobioconjugate Engager for Targeted Cancer Immunotherapy. Nat. Nanotechnol. 2017, 12, 763− 769.、
4. Au, K. M.; Park, S. I.; Wang, A. Z. Trispecific Natural Killer Cell Nanoengagers for Targeted Chemoimmunotherapy. Sci. Adv. 2020, 6, No. eaba8564.
5. Tapia-Galisteo, A.; Álvarez-Vallina, L.; Sanz, L. Bi- and Trispecific Immune Cell Engagers for Immunotherapy of Hematological Malignancies. J. Hematol. Oncol. 2023, 16, No. 83.
6. Sartorio, M. G.; Pardue, E. J.; Feldman, M. F.; Haurat, M. F. Bacterial Outer Membrane Vesicles: From Discovery to Applications. Annu. Rev. Microbiol. 2021, 75, 609−630.
7. Gerritzen, M. J. H.; Martens, D. E.; Wijffels, R. H.; van der Pol, L.; Stork, M. Bioengineering Bacterial Outer Membrane Vesicles as Vaccine Platform. Biotechnol. Adv. 2017, 35, 565−574.
原文链接:
https://pubs.acs.org/doi/abs/10.1021/acsnano.4c07364
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















与单独给予纳米抗体(给药剂量100 μg/只)相比,5 μg/只蛋白质量的OMV-NICE就能达到更好的抑制肿瘤的效果,在肿瘤部位提高IFN-γ的浓度。
28
#肿瘤# #免疫细胞衔接器#
42