Cell Reports:科学家破解癌细胞耐受药物MLN4924秘密
2012-03-23 MedSci MedSci原创
对癌症患者而言,耐药性是一个严重性问题:药物治疗刚开始有一些疗效,但是过一段时间之后,不能发挥作用。如今,来自美国桑福德-伯纳姆医学研究所(Sanford-Burnham Medical Research Institute)的研究人员发现癌细胞如何对药物MLN4924产生耐受性。这种实验性药物当前正在许多I期和II/III期临床试验中接受测试以便确定它抵抗几种不同类型癌症(包括多发性骨髓瘤、白血
对癌症患者而言,耐药性是一个严重性问题:药物治疗刚开始有一些疗效,但是过一段时间之后,不能发挥作用。如今,来自美国桑福德-伯纳姆医学研究所(Sanford-Burnham Medical Research Institute)的研究人员发现癌细胞如何对药物MLN4924产生耐受性。这种实验性药物当前正在许多I期和II/III期临床试验中接受测试以便确定它抵抗几种不同类型癌症(包括多发性骨髓瘤、白血病和淋巴瘤)的疗效。相关研究结果于2012年3月19日在线发表在Cell Reports期刊上。
这项研究显示MLN4924耐受性癌细胞逃避死亡是因为这种药物的作用靶标---NEDD8活化酶(NEDD8-activating enzyme, NAE)存在一个简单的突变从而阻止该药物结合到癌细胞上。为了揭示这种机制,研究人员也开发出一种相对快速和低成本的实验方法,而且它能够被用来预测尚未开始接受治疗的癌症患者对这种药物或其他药物作出的反应,从而实现个人化癌症治疗。
论文通讯作者和美国国家癌症研究所指定的桑福德-伯纳姆医学研究所癌症中心助理教授Matthew Petroski博士说,“由于基因变异,一些肿瘤可能要比其他肿瘤更容易对某种治疗产生抗性。为一个人探索合适的治疗方法是一种令人沮丧的和代价昂贵地反复试错的过程。我们在这项研究中开发出的这种方法能够确定肿瘤细胞耐受一种抗癌药物的机制,从而让我们开始了解这种耐药机制是否对其他药物也是如此,从而潜在性地节省时间和金钱”,
MLN4924:大有希望的抗癌药物
MLN4924通过结合NEDD8活化酶并让它失活的方式杀死大多数癌细胞。泛素结合酶8(NEDD8)和控制它的那些酶是泛素蛋白酶体系统(ubiquitin proteasome system)的一部分。这种复杂的酶网络给蛋白加上一个泛素分子标签。一旦蛋白收到泛素的“死亡之吻(kiss of death)”,它就被送到细胞中的“绞肉机(meat grinder)”,即蛋白酶体,而被降解。根据是哪些蛋白被摧毁,这种途径有助于控制几乎所有的细胞功能,然而在癌症中,该途径却经常发生变化。
当MLN4924关闭NEDD8时,泛素蛋白酶体系统的一个关键性组成部分NEDD8活化酶功能失常,癌细胞不能继续增殖而死亡。
根据Petroski的说法,找到新的方法来靶向泛素蛋白酶体系统并阻止它降解关键性蛋白是一个大希望的研究领域,有可能导致人们开发出强效的新抗癌疗法。
癌细胞如何逃避MLN4924作用
Petroski与他的实验室研究人员(包括论文第一作者Julia Toth博士)发现MLN4924在实验室测试中杀死99%以上的癌细胞。然而也有少量癌细胞存活下来。
在这些少量但是比较重要的耐受药物MLN4924的癌细胞群体中,Petroski领导的研究小组发现NEDD8活化酶存在一个突变。这些癌细胞只需在编码这种酶的基因上单个核苷酸发生单个突变而就可以存活下来。
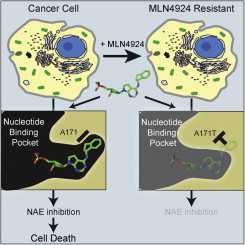
癌细胞抵抗药物MLN4924机制。
“格列卫(Gleevec,译者注:目前治疗一种特殊类型白血病的最有效的药物)和其他抗癌药物通过结合另一类酶即激酶并让它们失活而发挥作用,然而当它们的靶蛋白发生突变时,这些药物也失去了药效。但是这是第一次在一种药物靶向泛素蛋白酶体系统的一个酶组分的过程中鉴定出这种机制。”
理解癌细胞如何成功地逃避MLN4924导致的死亡,可能有助于科学家们对这种药物或者其他靶向泛素蛋白酶体系统的药物进行改造以便进一步增强它们的疗效性。接下来,除了开发实验室测试方法来确定一种药物的疗法之外,Petroski和他的研究小组如今正在利用这种知识发现新的抗癌药物,特别是能够规避这种新发现的耐药性机制的药物。(生物谷:towersimper编译)
Copyright ©版权Bioon.com所有,若未得到生物谷授权,请勿转载。

doi:10.1016/j.celrep.2012.02.006
A Gatekeeper Residue for NEDD8-Activating Enzyme Inhibition by MLN4924
Julia I. Toth, Li Yang, Russell Dahl, Matthew D. Petroski
Inhibition of NEDD8-activating enzyme (NAE) has emerged as a highly promising approach to treat cancer through the adenosine sulfamate analog MLN4924. Here, we show that selective pressure results in HCT116 colorectal carcinoma cells with decreased MLN4924 sensitivity and identify a single-nucleotide transition that changes alanine 171 to threonine (A171T) of the NAE subunit UBA3. This reduces the enzyme's affinity for MLN4924 and ATP while increasing NEDD8 activation at physiological ATP concentrations. Expression of UBA3 A171T is sufficient to decrease MLN4924 sensitivity of naive HCT116 cells, indicating that it is a dominant suppressor of MLN4924-mediated cell death. Our data suggest that the on-target potency of MLN4924 selects for a point mutation in NAE that overcomes the molecule's inhibitory effects, allowing cancer cell survival.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#CEL#
49
#Cell#
65
#癌细胞#
65