脓毒症的心血管管理:改善心脏和血管功能
2023-12-26 重症医学 重症医学 发表于上海
血管加压素和兰地洛尔是确保血管和心脏系统在感染性休克期间尽可能接近最佳状态的关键疗法。脓毒性休克患者更好的心血管管理有助于改善脓毒性休克的治疗。
血管加压素和兰地洛尔是确保血管和心脏系统在感染性休克期间尽可能接近最佳状态的关键疗法。脓毒性休克患者更好的心血管管理有助于改善脓毒性休克的治疗。
脓毒症是由宿主对感染反应失调引起的危及生命的器官功能障碍(Singer等人2016)。脓毒性休克被定义为脓毒症的一个子集,伴有循环和细胞/代谢功能障碍,死亡风险较高。脓毒症的进展通常使用顺序器官衰竭评估(SOFA)评分(Vincent等人1996)或三参数qSOFA评分(Koch等人2020)来评估,其中心血管评估是这两个量表的关键参数。在脓毒症患者中,MAP持续低于65 mmHg阈值的时间长度是死亡率的一个强有力的预测指标,在阈值以下的最长发作时间每增加2小时,死亡率就会逐渐增加(Vincent等人2018)。因此,拯救脓毒症运动指南(SSCG)推荐血管内液体给药(使用晶体)作为对抗脓毒症患者低血压的第一步(Evans等人2021)。
首次液体复苏后的难治性低血压
当单独给予液体复苏不足以达到目标MAP时,应开始给予血管升压药以解决低血压问题(Rhodes等人2017)。早期使用血管升压药(距离最初低血压小于6小时)对于避免因低灌注而导致的长期低血压和重要器官的不可逆损害至关重要。SSCG建议将去甲肾上腺素作为一线血管升压药,用于治疗初始液体复苏后难以控制的低血压,以维持MAP≥65 mm Hg(Evanset等人2021)。脓毒症休克患者的临床特征是:在没有低血容量的情况下,需要使用血管升压药治疗以维持MAP≥65mmHg和血清乳酸水平>2 mmol/L(>18 mg/dL)(Singer等人2016)。去甲肾上腺素是一种儿茶酚胺,可激活α1和β1肾上腺素受体,对心率的影响很小(Evans等人2021)。据报道,早期使用血管升压药可增加MAP,缩短低血压持续时间,从而改善重要脏器灌注并降低血清乳酸水平,从而改善患者预后并降低死亡率(Baiet等人2014;Colon Hidalgo等人2020)。
儿茶酚胺难治性脓毒症休克
然而,有些患者由于α1肾上腺素能受体的下调或解耦,导致血管对儿茶酚胺的反应性受损,成为儿茶酚胺难治性患者。尽管给予去甲肾上腺素治疗,在患者心排血量充足且对液体无反应时,持续低血压提示存在儿茶酚胺难治性脓毒性休克(Jentzer和Hollenberg 2021)。SSCG指出,对于MAP水平不足的去甲肾上腺素脓毒性休克的成人,建议加用血管加压素,而不是增加去甲肾上腺素的剂量(Evans等人2021)。因此,建议使用具有替代作用模式的二线血管加压药来增加血管张力。有人提出,早期联合使用中等剂量的多种血管加压剂并互补作用机制,可以避免高剂量单一药物相关的毒性产生(Jentzer和Hollenberg 2021)。
血管加压素是一种非儿茶酚胺内源性肽激素,它激活位于血管平滑肌上的V1受体,导致血管张力增加和动脉血压升高。当去甲肾上腺素的剂量在0.25–0.5μg/kg/min范围内时,通常开始使用血管加压素(剂量为0.01-0.03 IU/min)(Evans等人2021)。血管加压素和去甲肾上腺素的联合输注可以增加儿茶酚胺难治性(抵抗性)脓毒性休克的MAP水平,而单独用去甲肾上腺素增加MAP效果不佳(Dünser等人2003)。此外,使用血管加压素可以减少去甲肾上腺素的剂量,同时保持MAP(Evans等人2021;Russell 2011)。去甲肾上腺素/儿茶酚胺的不良反应包括心肌缺血和心律失常,因此,使用血管加压素通过减少儿茶酚胺药物需求量,从而减少了对导致心律失常心肌β1-受体和相关增加心肌氧需求的刺激(McIntyre等人2018)。脓毒性休克患者早期使用血管加压素的积极结果包括去甲肾上腺素需求量减少(Russell 2011)、心房颤动风险降低(McIntyre等人2018)、儿茶酚胺诱导的抗炎作用减少(Stolk等人2020)、减少了对肾脏替代治疗的需求(Gordon等人2010;Russell等人2008)、减少了肺动脉的收缩(Currigan等人2014)。此外,在较轻的脓毒性休克患者(去甲肾上腺素剂量<15μg/min)中,在较低乳酸水平(Sacha等人2018)或脓毒症患者较高动脉pH (pH≥7.4)水平(Bauer等人2022)下,使用血管加压素治疗的生存率明显更高(Russell等人2008),这共同支持了脓毒性休克期间血管加压素与去甲肾上腺素的早期联合治疗策略。
代偿性心动过速
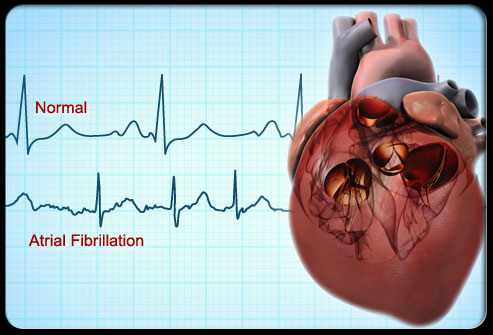
心动过速在ICU患者中非常常见,并与脓毒性休克的不良预后相关(Leibovici等人2007;Parker等人1987)。在脓毒症期间,交感神经系统在维持心输出量和血压方面发挥着关键作用。这是通过心率(HR)、收缩力和血管张力的变化来实现的(Morelli等人2016)。压力反射是一种稳态机制,通过调节交感神经张力来对抗MAP波动,以维持MAP (Jentzer和Hollenberg 2021)。压力反射功能的完整性对维持血流动力学稳态至关重要。因此,在脓毒症的早期阶段,心动过速成为代偿脑卒中容量减少的关键机制,并表明了压力反射活动的有效性(Morelli等人2016)。由于这种心动过速的代偿性起源,适当的容量复苏通常会导致心率降低。然而,代偿性心动过速可能导致心律失常(Boriani等人2019),尤其是心房颤动(AF)。据报道,脓毒症与心律失常之间存在明确的关联,与未患脓毒症的患者相比,新发房颤在脓毒症住院患者中很常见(5.9% vs 0.65%: OR 6.82, 95% CI 6.54-7.11),并且与院内卒中风险增加(2.7倍)相关(Walkey et al. 2011)。心律失常确诊后,危及生命的血流动力学不稳定(即:出现症状性低血压和/或重要器官灌注不足的迹象时),需要立即电转复(ECV)或除颤(Dan等. 2022)。在ECV故障或房颤即时复发的情况下,最佳的下一步是使用兰地洛尔进行急性心率控制,这已被证明优于感染患者房颤的标准心率控制治疗,并且无低血压或心动过缓相关的明显并发症(Dan et al. 2022;Okajima et al. 2015)。
非代偿性心动过速
尽管获得了血流动力学的稳定,但在许多脓毒性休克患者中,即使在充分的液体复苏和血管加压治疗后,非代偿性心动过速仍可能持续存在。在脓毒症休克患者中,当高水平的内源性和外源性儿茶酚胺导致压力反射反应受损时,非代偿性心跳过速会持续存在,从而导致肾上腺素能亢进状态的出现。这是交感过度刺激的表现(Domizi等人2020;Dunser and Hasibeder 2009)。开始输注去甲肾上腺素24小时后出现心动过速的患者的死亡风险是没出现心动过速患者的三倍,这可能是由于代偿反射机制耗尽所致(Domizi等人2020)。持续性心动过速会增加心肌耗氧量、减少舒张充盈,并诱导心脏毒性,从而对心脏产生不利影响(Domizi等人2020)。因此,在容量复苏和开始使用血管升压药后24小时持续出现非代偿性心动过速的患者是脓毒症休克患者中一个特别严重的亚群,死亡率非常高,几乎没有可供选择的治疗措施。
兰地洛尔治疗非代偿性窦性心动过速
兰地洛尔是一种新型的超短效(T1/2=4分钟)静脉超选择性β1阻滞剂,用于治疗室上性快速心律失常,如房颤、房扑和非代偿性窦性心动过速(SmPC Rapibloc)。兰地洛尔是一种β1-拮抗剂,由于其纯Senantiomer分子结构(McKee等人2014),对血压和肌力的影响很小(Shibata等人2012),而艾司洛尔和美托洛尔会引起低血压并具有负性肌力作用。兰地洛尔即使在低剂量下也具有良好的疗效(Krumpl等人2018),其还具有低体积分布和低毒性风险的优点(Abialbon 2019)。由于兰地洛尔的代谢物无活性,且可被血浆酯酶分解,因此兰地洛尔对于肾脏和肝脏合并症患者具有良好的安全性(Yokoyama 2016),对于肾功能不全的患者无需调整剂量。兰地洛尔主要由假胆碱酯酶和羧酸酯酶代谢,而不是由细胞色素酶P450代谢,其有两种无活性代谢产物(M1和M2),并且它们可以通过尿液排出。由于兰地洛尔具有较高的心脏选择性(β1/β2-选择性=255:1),所以其对呼吸功能(Shibata等人2012)和β2-受体介导的冠状动脉充血的影响很小(Maman等人2017)。
一项兰地洛尔与常规治疗的随机对照研究(对照组)研究了兰地洛尔治疗151名患者脓毒症相关快速性心律失常的疗效和安全性(Kakihana等人2020)。在该研究中,非代偿性心动过速被定义为在儿茶酚胺剂量不变的情况下,心率保持在100 bpm或以上至少10分钟。此外,只有当研究者在随机分组前24小时内确认了上述症状和体征时,患者才被纳入。在研究期间,兰地洛尔的平均剂量为4.15µg/kg / min,平均累积剂量为1526.20 mg (SD 2110.36),总输注时间为94.5 h。据报道,在接受兰地洛尔治疗的患者中,达到了MAP的大多数患者的心率为60-94 bpm。与对照组的常规治疗相比,兰地洛尔组在24小时内心率达到60-94 bpm的患者数量显著增加(55%[41/75]vs 33%[25/75];p=0.0031),证实兰地洛尔治疗优于常规心率控制治疗(Kakihana等人2020)。与常规治疗相比(9%[7/75]vs 25%[19/75];p=0.015),兰地洛尔显著降低了脓毒症相关快速性心律失常患者的新发心律失常发生率(Kakihana等人2020)。此外,兰地洛尔的疗效和安全性不受患者特征的影响,如脓毒症休克、LVEF≤50%、代谢性或呼吸性酸中毒或急性肾衰竭,这支持了兰地洛尔在广泛的脓毒症相关心律失常且预后较差的患者中使用(Matsuda等人2020)。此外,接受兰地洛尔治疗的呼吸道感染患者在28天时的死亡率低于对照组(Matsuda等人2020)(危险比0.259;95%CI 0.071至0.943)。在对61名严重脓毒症患者的进一步研究中,兰地洛尔可降低脓毒症患者的心率,但不会对血液动力学产生负面影响(Okajima等人2015)。
结论
使用血管加压素和兰地洛尔是确保脓毒症休克期间血管和心脏系统尽可能接近最佳条件的关键疗法。血管加压素可确保儿茶酚胺难治性患者的血管反应得到改善,大量证据表明,尽早使用血管加压素可改善患者的预后。兰地洛尔可确保在非代偿性窦性心动过速期间安全降低心率,同时减少不必要的窦性激活和心脏压力,还可降低新发心房颤动的风险,提高患者生存率。通过改善脓毒症休克的心血管管理,可以进一步提高感染性休克的整体管理水平。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












学习。
37
学习。
40
#脓毒症# #脓毒性休克#
59