揭秘甘草酸的神奇力量:如何逆转肝纤维化并抑制氧化应激!
2024-10-14 梅斯循证中医药 MedSci原创 发表于上海
文章探讨了GA在CCI4诱导的肝纤维化小鼠模型中的药效学效应。
全球范围内,肝纤维化的高患病率约为4.5%至9%,且在某些严重情况下,可能进一步发展为肝硬化及肝癌。肝纤维化发病机制的复杂性不容忽视,其中,慢性肝损伤所引发的细胞外基质异常沉积,以及肝星状细胞(HSCs)的持续活化,构成了该病发展的主要病理过程。尽管当前有多种治疗策略被提出,但至今尚未有确切的药物能够有效逆转肝纤维化进程。因此,对于肝纤维化的治疗与预防,仍需进一步深入研究与探索。
甘草酸(GA)是甘草根及其根茎的关键成分,具有显著的肝脏解毒、抗炎、抗氧化及抗病毒等多种生物活性。研究表明,GA通过下调UGBP1的表达水平,并精确调控IFN-γ/STAT1/Smad7信号通路,有效抑制了小鼠体内HSC的活化状态,以及由CCl4所诱发的肝纤维化病理过程。尽管如此,关于GA具体作用靶点的全面解析,尚需后续深入研究加以明确。
近日,一篇名为“Glycyrrhizic acid ameliorates hepatic fibrosis by inhibiting oxidative stress via AKR7A2”的文章探讨了GA在CCI4诱导的肝纤维化小鼠模型中的药效学效应。

图1 论文首页
GA改善了CCI4诱导的小鼠肝纤维化
该研究用20%四氯化碳(CCI4)制备肝纤维化小鼠模型,并连续给予GA4周。具体分组见图2。按照相关实验操作后,结果显示,在治疗周期内,各实验组的体重均未展现出统计学上的显著差异(图2B)。值得注意的是,CCI4处理的小鼠其肝脏与脾脏的重量显著增长,相应的肝、脾系数亦显著上升,但肾脏并未受到显著影响。然而,在给予高剂量GA后,CCI4处理小鼠的肝脏与脾脏的变化趋势发生了明显的逆转(图2C)。
此外,肝纤维化过程中常伴随有ALT和AST的显著升高。同时,HA、LN、P III P和Col IV作为细胞外基质的关键组成部分,其水平变化直接映射了肝纤维化的严重程度。模型建立后,实验小鼠血清中的ALT、AST、HA、P III P、Col IV、LN等指标均有所上升,但在GA给药后,这些指标均呈现出下降趋势(图2D)。
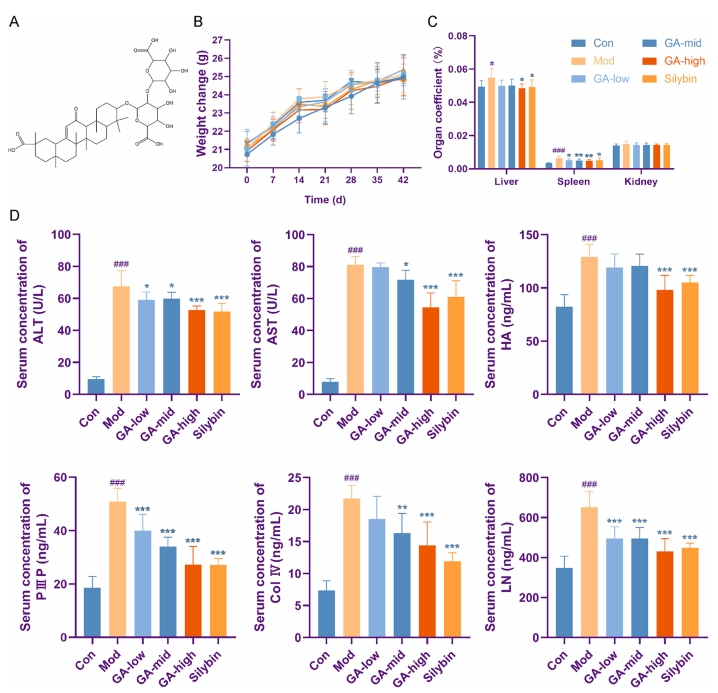
图2 GA对CCI4小鼠生化指标的影响
GA改善了CCI4诱导的小鼠肝脏病理
HE染色结果表明,Mod组小鼠肝脏中存在显著的炎症细胞浸润现象,肝细胞分布散乱且排列不规整,同时伴随纤维组织的明显出血性改变。GA干预后,肝脏炎症细胞浸润情况显著减轻,肝细胞排列恢复有序,肝小叶结构更趋完整,肝脏整体形态得到显著改善(图3A)。Masson染色结果进一步揭示,Mod组小鼠肝脏中富含深染的蓝色胶原纤维及增厚的纤维条带。相比之下,GA给药后,中央静脉周边及全视野范围内的蓝色胶原蛋白显著减少(图3B)。
天狼星红染色则直观展示了红色胶原纤维在黄色肌肉及肝纤维组织神经胶质沉积周围的显著沉积现象。GA给药后,红色胶原沉积受到显著抑制(图3C)。此外,偏振光镜观察下,纤维化肝脏中的胶原纤维展现出黄色、红色、彩色及绿色等多种色彩,其中I型、II型、III型及IV型胶原纤维均有分布,尤以I型和III型胶原纤维为主,并伴有少量II型和IV型胶原纤维沉积。经GA处理后,各类胶原纤维的色彩均有所减弱,尤以I型和III型胶原的变化最为显著(图3D)。
综上所述,通过对多种病理染色结果的综合分析,可以明确GA在显著改善小鼠肝脏形态、有效减少肝组织中炎症细胞浸润及胶原沉积方面展现出显著效果,从而有效逆转小鼠肝纤维化进程。
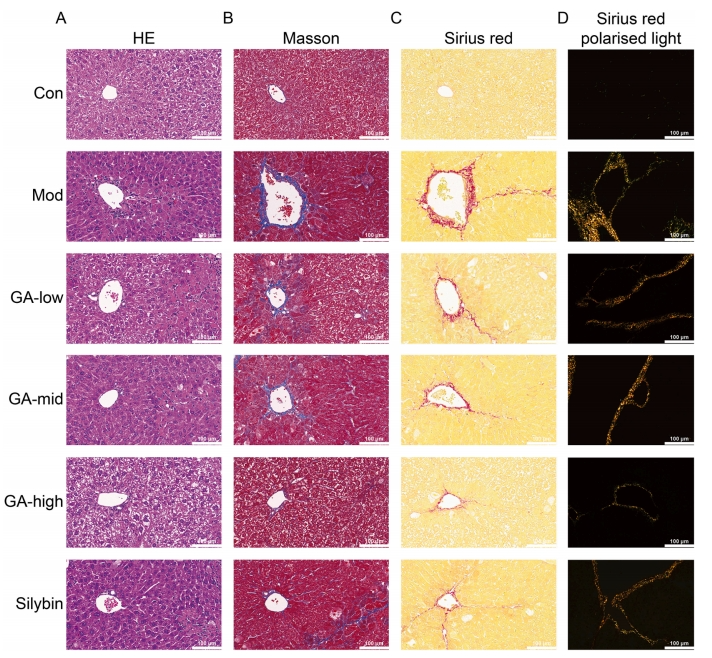
图3 GA对CCl4诱导的肝纤维化小鼠的代表性(A)HE、(B) Masson和(C,D)天狼星红染色的影响(40×)
蛋白质组学鉴定肝纤维化小鼠GA的关键通路
针对Con、Mod及GA-H组肝组织,研究进行了全面的蛋白质组测序。质谱(MS)分析结果显示,相较于Mod组,Con组与GA给药组中存在14种蛋白质的表达显著上调,其上调比值均大于2(图4A)。这些上调的蛋白质具体包括Mmrn2、Cggbp1、Pld1、Gstm3、Cbr3、Gsta1、Gstm1、Gstm2、Ighg1、Nqo1、Ighv1-72、Gstm4、Hspa1l以及Orm2(图4B)。
GO分析结果揭示了这些差异表达蛋白(DEPs)的主要生物学功能及参与的细胞成分。具体而言,Gstm1、Gstm2、Gstm3、Gstm4及Gsta1等蛋白主要涉及谷胱甘肽(GSH)代谢、异种生物分解代谢以及脂质代谢等生物学过程。在细胞成分层面,这些蛋白主要与细胞间桥、细胞质及细胞外区域相关联。而在分子功能方面,它们则展现出GSH结合、GSH转移酶活性、NADPH脱氢酶(醌)活性、蛋白同源二聚体活性以及酶结合位点等特性(图4C)。
此外,KEGG分析结果显示,那些Con/Mod与GA/Mod比值大于2的DEPs主要参与调控GSH代谢、化学致癌物-ROS生成以及异种生物代谢等生物过程。相反,Con/Mod与GA/Mod比值均小于0.8的DEPs则主要参与调控花生四烯酸代谢、视黄醇代谢以及类固醇激素生物合成等生物过程(图4D)。
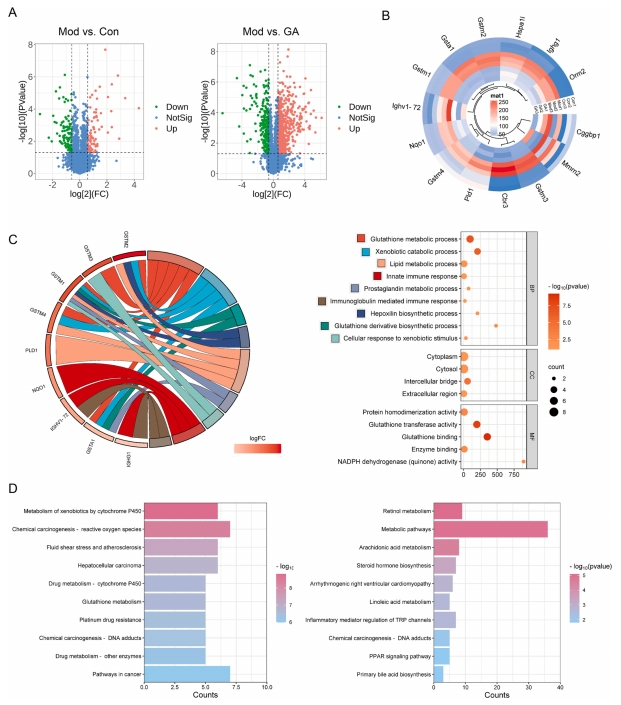
图4 GA对CCl4小鼠肝组织蛋白表达谱的影响
GA清除LX-2细胞内的ROS,以维持活化的星状细胞的稳态
在探究GA在肝损伤进程中的效应变化时,该研究针对正常肝细胞BLR-3A、造血干细胞LX-2以及肝癌细胞HepG2进行了细胞活性评估。CCK8实验结果显示,GA对BLR-3A细胞未展现出显著作用,而对LX-2细胞的抑制效应始于12.5μM浓度,且在216.4μM时达到50%抑制率;对于HepG2细胞,其50%抑制浓度则为284.7μM(图5A、B)。这些数据表明,GA对正常肝细胞无明显影响,却对肝癌细胞及造血干细胞具有抑制效果,且后者对GA的敏感度更高。
进一步地,荧光成像分析揭示,在50、100及200µM GA处理下,LX-2细胞内代表ROS的绿色荧光强度显著减弱(图5C)。随后,研究利用流式细胞术精确测定细胞内ROS含量,结果指出,不同浓度的GA均能有效降低LX-2细胞内ROS水平,尤以100和200µM浓度效果最为显著且相近(图5D、E)。这些发现强烈提示,GA可能通过减少活化造血干细胞内ROS的产生,进而抑制其持续增殖过程。
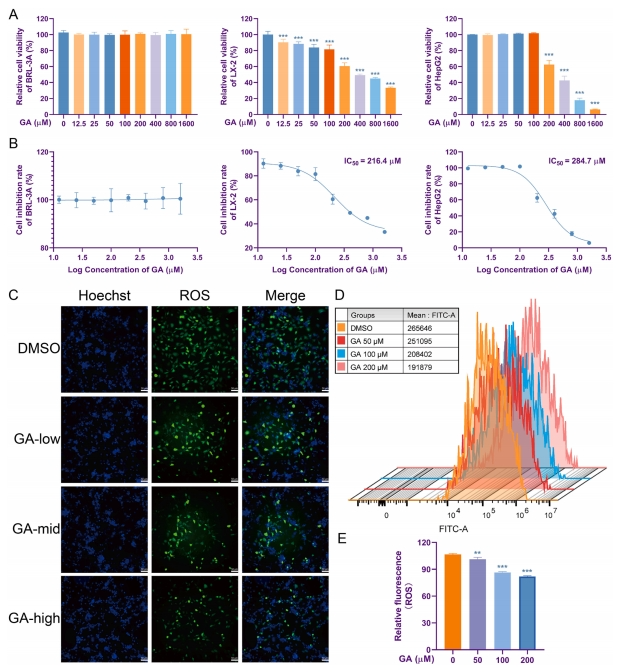
图5 GA对细胞活力的影响
结论
GA通过其机制,有效抑制了活化造血干细胞中由ROS介导的氧化应激过程,从而显著促进了肝纤维化的逆转。这一具有创新性的研究成果,为GA在临床应用中改善肝纤维化状况提供了坚实的数据支持。
参考文献:
Wang Q, Lu T, Song P, Dong Y, Dai C, Zhang W, Jia X, Guo Z, Zhao M, Zhang J, Wang P, Wang J, Guo Q. Glycyrrhizic acid ameliorates hepatic fibrosis by inhibiting oxidative stress via AKR7A2. Phytomedicine. 2024 Oct;133:155878. doi: 10.1016/j.phymed.2024.155878
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#氧化应激# #肝纤维化# #甘草酸#
87