Cell:李晓淳/冯亮等揭示溶酶体胱氨酸的转运机制
2022-09-18 “小柯生命”公众号 “小柯生命”公众号
这些发现不仅揭示了构象转变在转运过程中的重要作用,也为如何提高转运活性的研究方向提供了新的思路。另一个有趣的发现是cystinosin的构象会影响与Ragulator-Rag复合物的相互作用。
2022年9月15日,德克萨斯西南医学研究中心李晓淳课题组、斯坦福大学医学院冯亮课题组和加州大学圣克鲁斯分校Glenn Millhauser课题组合作,在 Cell 期刊发表了题为:Structure and mechanism of human cystine exporter cystinosin 的研究论文,报道了溶酶体胱氨酸的转运机制。

冯亮课题组郭雪、李晓淳课题组 Philip Schmiege、Glenn Millhauser 课题组 Tufa E. Assaf 为论文共同第一作者。
维持酸性pH对溶酶体行使物质的降解与循环这两项基本功能起着至关重要的作用:一方面,酸性pH赋予溶酶体内各种水解酶最佳的生物活性,用于将生物大分子消化成小分子;另一方面,跨溶酶体膜的质子浓度梯度为水解产物的跨膜运输提供能量,使小分子得以排出再利用。尽管人们很早就认识到溶酶体功能的缺陷会导致溶酶体贮积症,但对溶酶体上的转运过程,尤其是质子驱动的氨基酸转运机理所知有限。
胱氨酸贮积症(Cystinosis)是第一个被记载的由于溶酶体转运功能异常所导致的遗传疾病。溶酶体胱氨酸是细胞内半胱氨酸的主要来源。另外,胱氨酸/半胱氨酸通过调控RNA修饰,抗氧化物谷胱甘肽合成以及mTOR信号通路,在维持细胞稳态中发挥重要作用。
胱氨酸贮积症的发生是编码溶酶体胱氨酸转运蛋白cystinosin的基因突变所致。cystinosin的功能缺失会引发胱氨酸在溶酶体内异常积累,进而导致全身多器官的功能障碍。因此,cystinosin结构和功能的研究对揭示溶酶体氨基酸的转运机制,以及理解胱氨酸贮积症发生的分子基础和mTOR信号转导具有重要意义。
这项最新研究利用晶体学和冷冻电镜两种技术手段解析了人源cystinosin的结构,这一结构提供了PQ转运体家族的三维结构信息,为理解该蛋白家族外排溶酶体氨基酸的工作机制奠定了基础。
为了研究物质跨膜运输核心的两个问题:(1)转运蛋白如何特异性的识别底物;(2)转运蛋如何通过构象转变将底物从膜的一侧运输到另一侧,研究人员捕获了cystinosin三种不同的状态。
其中,cystinosin与底物胱氨酸结合的状态揭示了底物结合口袋同时结合胱氨酸的两个氨基与羧基,阐明了cystinosin 识别胱氨酸而非其他氨基酸的结构基础。同时,研究人员通过比较cystinosin 处于溶酶体内开放(装载底物)和细胞质开放(卸载底物)的两种构像和功能研究,提出了调控构象转变的分子机制。
为了探究了质子在转运过程中的作用,研究人员利用double electron-electron resonance spectroscopy(DEER)技术获取了蛋白质的构象转变信息。质子的结合催化cystinosin转向细胞质开放的状态。有意思的是,偏好细胞质开放状态的突变体转运胱氨酸的能力显着提升,而偏好溶酶体内开放的突变体活性严重受损或者缺失。
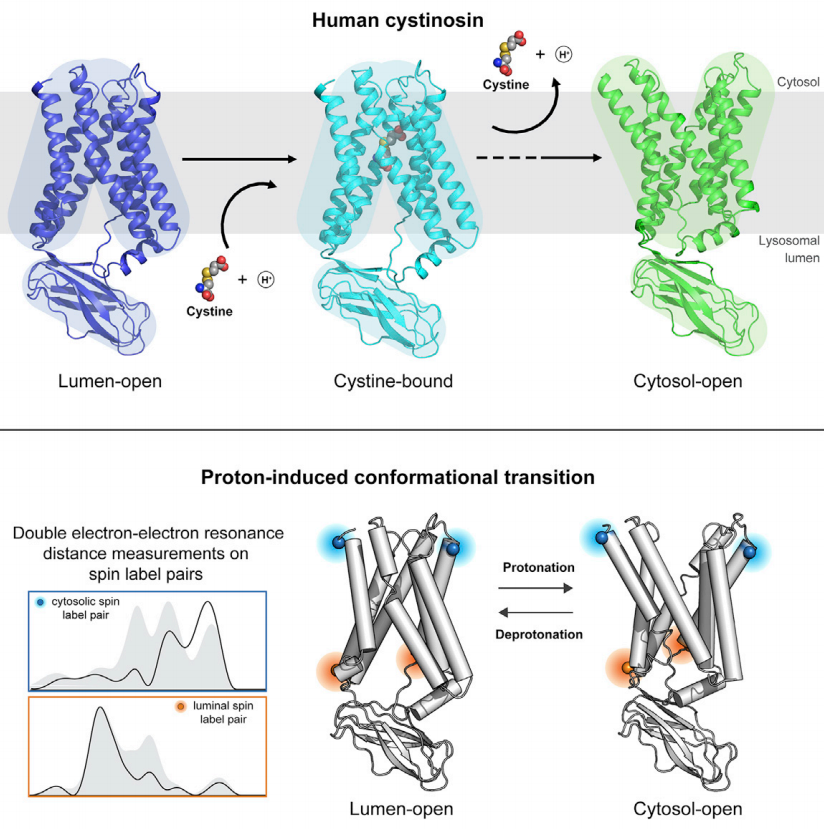
这些发现不仅揭示了构象转变在转运过程中的重要作用,也为如何提高转运活性的研究方向提供了新的思路。另一个有趣的发现是cystinosin的构象会影响与Ragulator-Rag复合物的相互作用,这对理解mTOR信号转导提供了新的信息。
原始出处:
Xue Guo, et al. Structure and mechanism of human cystine exporter cystinosin. Cell, 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












李晓淳/冯亮等揭示#溶酶体胱氨酸#的转运机制,#胱氨酸贮积症#
68
#CEL#
76
#Cell#
95
学习了
80
签到学习
76