中山大学刘杰教授Biomaterials:多功能杂交外泌体通过激活STING通路增强癌症化学免疫治疗
2023-08-03 BioMed科技 BioMed科技 发表于上海
研究表明利用CD47和M1表型外泌体促进TAM向M1表型再极化有望缓解ITM以改善癌症免疫治疗。
由于肿瘤特异性细胞毒性T淋巴细胞(CTL)浸润不足调节性T (Treg)细胞和肿瘤相关巨噬细胞(TAM)等造成的免疫抑制性肿瘤微环境(ITM),导致目前的免疫疗法应答率低。越来越多的研究证据表明,先天免疫是机体抵御感染和癌症的第一线防御机制,激活先天免疫可以缓解ITM,促进CTL浸润,增强抗肿瘤免疫应答。最近,环鸟苷单磷酸腺苷(GMP-AMP)合成酶/干扰素基因刺激因子(cGAS/STING)通路已成为增强抗肿瘤先天免疫的一种有前景的策略。
研究发现,Mn2+可通过增强cGAS对胞质DNA的敏感性、促进酶活性以及增强cGAMP-STING的结合亲和力来激活cGAS/STING信号,从而促进DC成熟和抗原呈递。另外多项研究表明化疗药物引起的DNA损伤可刺激IFN分泌,并通过STING信号激活DC。结合Mn2+和DNA损伤靶向药物可能达到激活STING信号的协同作用。然而,TAM作为ITM中最丰富的肿瘤浸润免疫细胞,通常呈现为M2表型,已被证明会损害癌症免疫治疗,而M1型巨噬细胞则通过释放促炎因子直接攻击肿瘤细胞。研究表明利用CD47和M1表型外泌体促进TAM向M1表型再极化有望缓解ITM以改善癌症免疫治疗。
为此,中山大学刘杰教授将来自M1巨噬细胞(M1-exos)的外泌体与来自CD47过表达的基因工程化肿瘤细胞的外泌体(GT-exos)融合,设计并合成了基因工程化杂交外泌体(gHE),并进一步包裹DNA损伤化疗药物SN38和MnO2纳米颗粒(NPs)以激STING通路。相关工作以题为“Multifunctional hybrid exosomes enhanced cancer chemo-immunotherapy by activating the STING pathway”发表在期刊Biomaterials上中山大学生物医学工程学院刘杰教授为该论文的通讯作者,中山大学生物医学工程学院博士生程利利和张鹏为该论文的共同第一作者。

该工作将来自M1巨噬细胞(M1-exos)的外泌体与来自CD47过表达的基因工程化肿瘤细胞的外泌体(GT-exos)融合,设计并合成了基因工程化杂交外泌体(gHE)。为了激活STING通路,进一步包裹DNA损伤化疗药物SN38和MnO2纳米颗粒(NPs)。我们证明了SN38和MnO2负载的gHE(SN/Mn@gHE)可通过CD47伪装有效逃避免疫清除,实现长循环,同时将TAM再极化为M1表型,并通过抑制来自肿瘤细胞的“不要吃我”信号促进巨噬细胞的吞噬。同时,SN/Mn@gHE通过SN38的化疗作用诱导免疫原性细胞死亡(ICD),同时产生胞质DNA,而NPs在酸性TME中分解成Mn2+,两者协同激活GAS/STING通路,促进DCs成熟、CTL浸润和NK细胞募集,同时上调了记忆T细胞的比例,有效抑制了肿瘤的生长、复发和转移。这项研究强调了通过杂交外泌体调节巨噬细胞、刺激STING途径来激活先天免疫、改善ITM从而实现抗肿瘤免疫应答的巨大前景(图1)。

图1. SN/Mn@gHE通过调节TAM和激活cGAS/STING通路改善ITM的示意图
【文章要点】
首先,研究人员从CD47过表达的细胞中获得基因工程外泌体(GT-exos),从M1巨噬细胞获得M1-exos,利用FRET效应探索最佳融合比例为1: 1,并利用激光共聚焦显微镜和纳米流式细胞术证明了成功融合。进一将SN38和MnO2 纳米颗粒负载到gHE中,得到SN/Mn@gHE。得到的杂交外泌体形状规则,粒径均一,并可在酸性条件下有效释Mn2+以便后续激活STING通路(图2)。
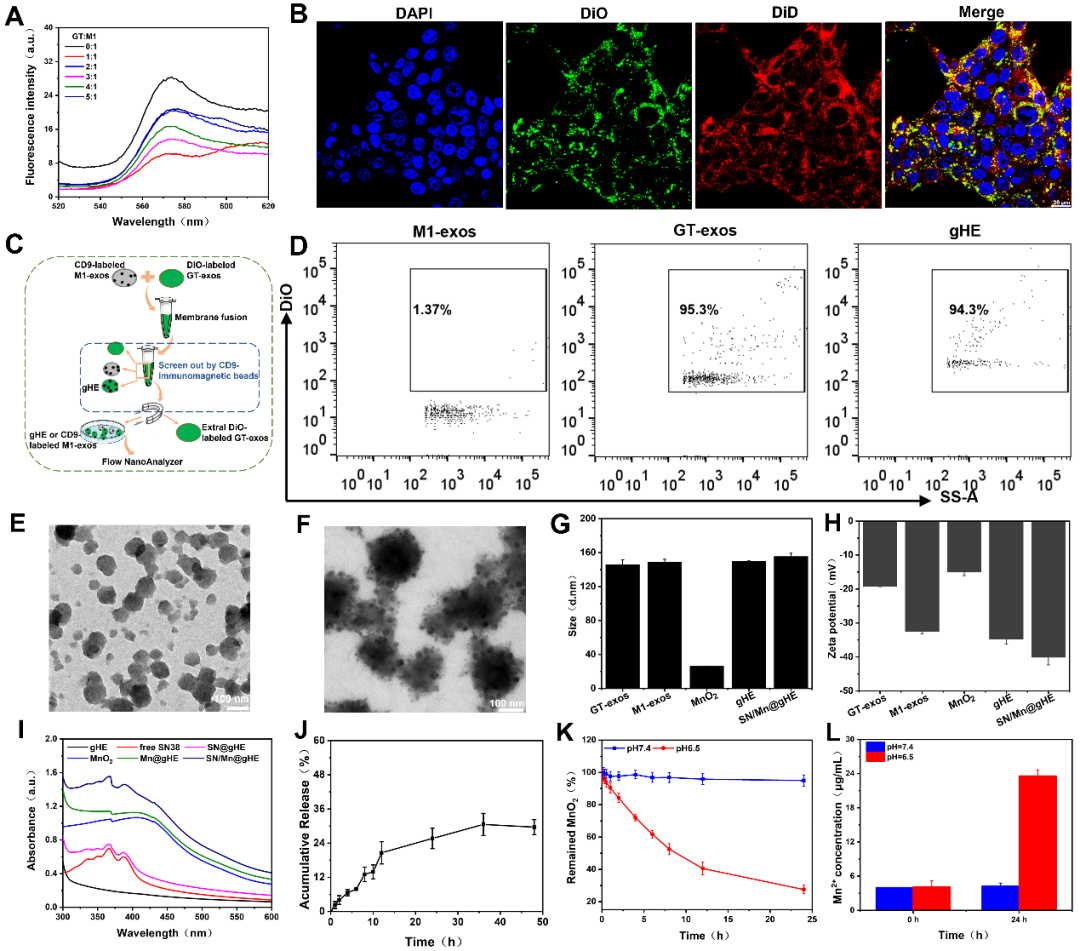
图2. SN/Mn@gHE的制备和表征
研究人员通过动物模型评估了SN/Mn@gHE的治疗效果。SN/Mn@gHE治疗显著抑制了双侧肿瘤的生长,可诱导肿瘤组织明显的组织学损伤和细胞凋亡,抑制细胞增值,同时也可抑制肺部转移,具有良好的生物安全性(图3)。

图3. SN/Mn@gHE的抗肿瘤作用
研究人员进一步探究了抗肿瘤免疫机制。SN/Mn@gHE可有效将TAM重编程为M1表型,通过释放促炎因子直接攻击肿瘤细胞。同时通过STING通路激活和免疫原性细胞死亡诱导DC成熟,促进NK细胞的募集,提高CTL在肿瘤部位的浸润比例,显著降低Tregs的数量,改善了肿瘤免疫抑制性的肿瘤微环境,并通过记忆T细胞诱导长期免疫效应,防止肿瘤复发(图4)。
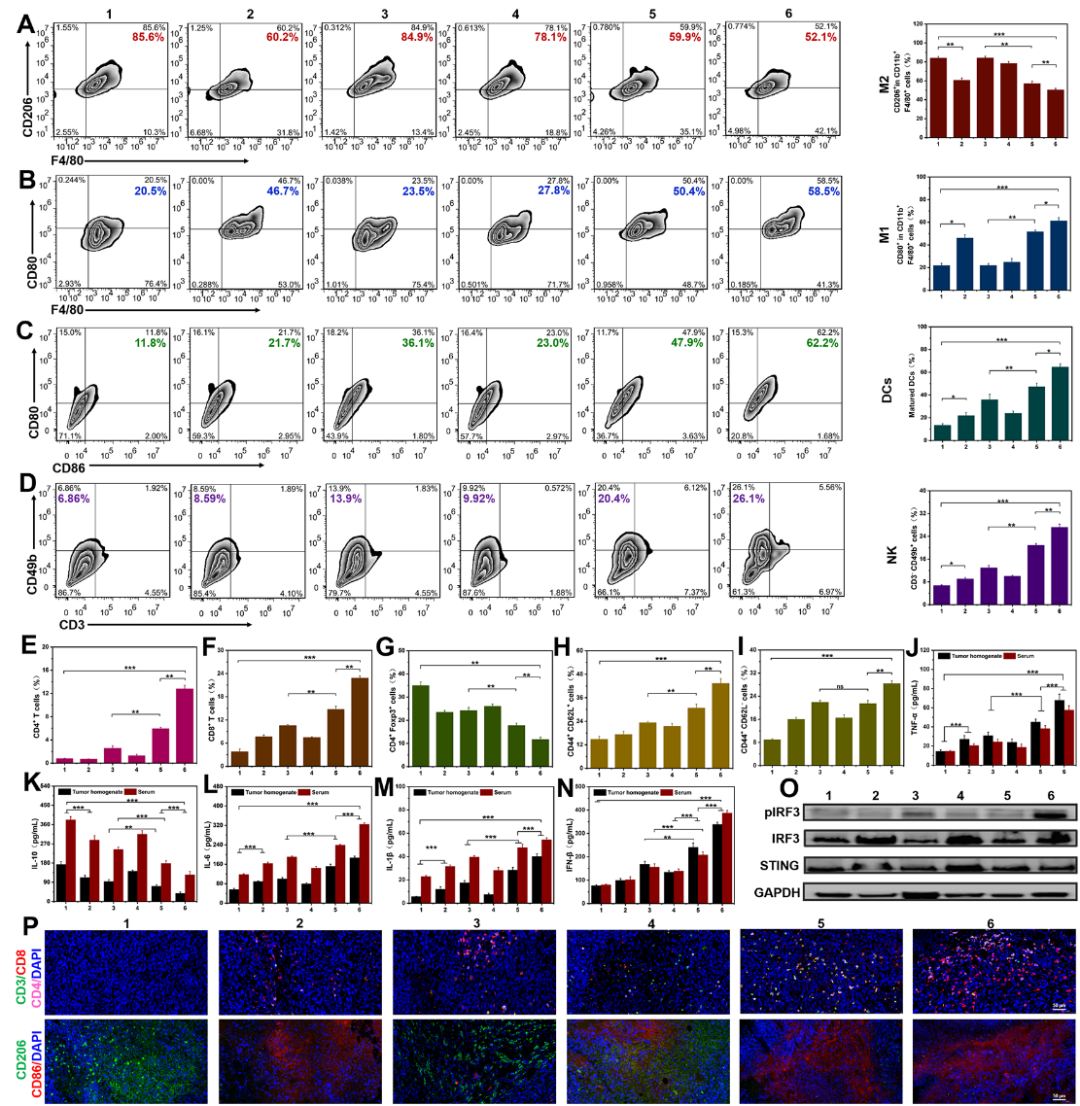
图4. 多功能杂交外泌体诱导抗肿瘤免疫应答。
【通讯作者信息】
中山大学生物医学工程学院刘杰教授:博士生导师,中山大学“百人计划”引进人才,华中科技大学和美国耶鲁大学联合培养博士。入选广州市“珠江科技新星”, “广东特支计划”科技创新青年拔尖人才等。目前主持包括国家自然科学基金面上项目、广东省自然科学基金等10余项国家、省市科研项目。近年来针对恶性肿瘤治疗,采用合成高分子材料或外泌体等,开发系列能够用于癌症治疗的纳米药物、基因输送体系,为肿瘤的靶向治疗提供新的方法和策略;结合3D打印、微流控技术以及类器官技术,开发一系列能够用于肿瘤治疗药物或纳米材料评价的体外类组织器官;通过天然材料改性构建可用于组织粘附、止血、修复的先进水凝胶体系、干细胞水凝胶体系以及3D生物打印水凝胶体系等。以第一作者或通讯作者在国际高水平期刊上发表70余篇SCI论文,其中包括领域高水平期刊Nature Materials,Biomaterials,Advanced Science,Nano-Micro Letters,Bioactive Materials,Advanced Healthcare Materials等;编写专著章节1章;申请11项国家发明专利,授权9项。
参考文献
Lili Cheng#, Peng Zhang#, Yadong Liu, Zhuoyin Liu, Junjie Tang, Langtao Xu, Jie Liu*. Multifunctional hybrid exosomes enhanced cancer chemo-immunotherapy by activating the STING pathway. Biomaterials 2023. DOI: 10.1016/j.biomaterials.2023.122259
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









