Science Advances:铁死亡再获突破,揭示实体瘤致命缺陷
2021-08-30 “生物世界”公众号 “生物世界”公众号
实体瘤依靠血液供应来输送氧气和营养。随着肿瘤的生长,这些血管无法为肿瘤的每个部分提供氧气和营养,从而导致区域缺氧。随着时间的推移,这种缺氧环境会导致肿瘤细胞内的酸积聚。为了克服这种压力,癌细胞通过释放
实体瘤依靠血液供应来输送氧气和营养。随着肿瘤的生长,这些血管无法为肿瘤的每个部分提供氧气和营养,从而导致区域缺氧。随着时间的推移,这种缺氧环境会导致肿瘤细胞内的酸积聚。为了克服这种压力,癌细胞通过释放中和环境酸性条件的酶来适应,使癌细胞不仅能够存活,而且最终会扩散到其他器官。其中一种酶称为碳酸酐酶。
碳酸酐酶是一种金属酶,其中的 IX 和 XII(CAIX/XII)是缺氧诱导的pH调节酶,可催化二氧化碳可逆性水合为碳酸氢盐和质子。CAIX还在癌细胞的存活、侵袭以及转移中发挥关键作用。确定由CAIX控制的生存机制以及改善治疗反应和限制耐药性的联合方法至关重要。
受调控的细胞死亡是癌症治疗成功的关键决定因素。缺氧会富集对细胞凋亡抵抗的细胞。幸运的是,已经出现了其他受调节的细胞死亡模式,可以用来克服对细胞凋亡的抵抗。铁死亡是一种铁依赖性的、非凋亡形式的细胞死亡,由磷脂过氧化作用的毒性积累引起。铁死亡与细胞代谢状态密切相关。然而,其中涉及的分子机制尚不清楚。
2021年8月27日,加拿大英属哥伦比亚肿瘤研究所的研究团队在 Science 子刊 Science Advances 上发表了题为:Genome-wide synthetic lethal screen unveils novel CAIX-NFS1/xCT axis as a targetable vulnerability in hypoxic solid tumors 的研究论文。
该研究发现,由肿瘤缺氧诱导的pH调节剂碳酸酐酶 IX(CAIX)可以阻止癌细胞发生铁死亡,确定了CAIX调控细胞生存的分子机制。这一发现将帮助研究人员开发实体瘤治疗的新策略。
2021年1月,世界卫生组织(WHO)国际癌症研究署(IARC)发布了2020年全球最新癌症负担数据。这项最新预估数据显示,2020年全球新发癌症病例1929万例,其中乳腺癌新发病例高达226万例,超过了肺癌的220万例,乳腺癌取代肺癌,成为全球第一大癌。
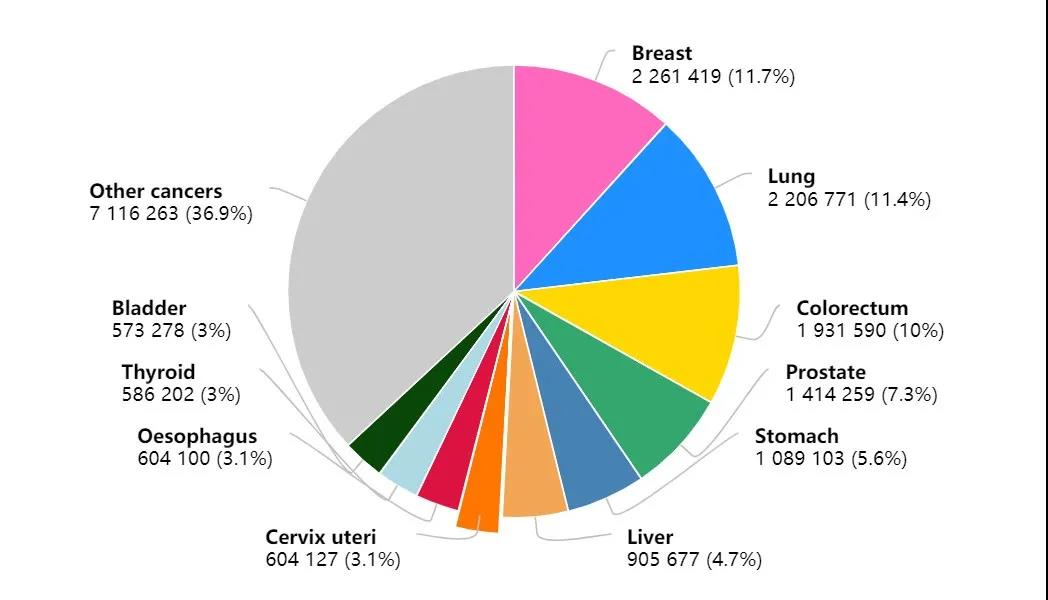
2020年癌症新发病例数前十的癌症类型
研究团队在缺氧的三阴性乳腺癌(TNBC)细胞中进行了无偏、全基因组CAIX合成致死CRISPR筛选,以识别与CAIX相互作用的基因。受CA9缺失影响的基因显着富集于RNA 代谢、无义介导的衰变、核糖体RNA加工、硒代半胱氨酸合成、硒代氨基酸代谢、三羧酸(TCA)循环和电子传递途径。进一步的功能通路网络分析确定了氧化还原稳态基因,其中,参与铁硫簇生物发生的基因半胱氨酸脱硫酶(NFS1)受到研究团队的重视。
接下来,研究团队对由三阴性乳腺癌队列组成的小型乳腺肿瘤组织微阵列进行染色,发现CAIX在该阵列中约 65% 的病例中表达,而NFS1在几乎所有病例中表达。
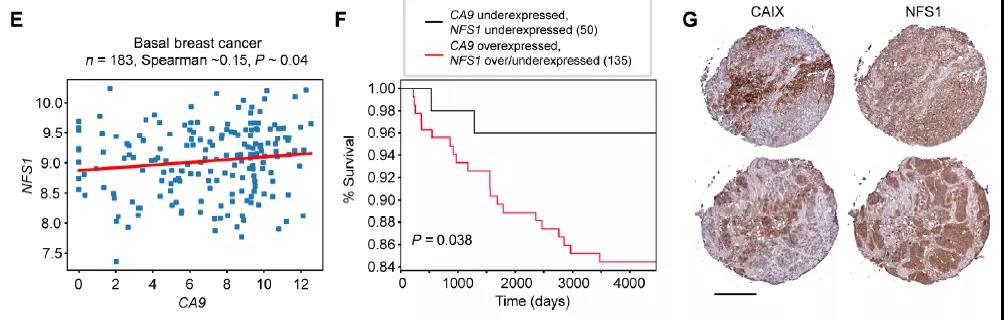
以上数据表明CAIX和NFS1在乳腺癌患者的一个子集中表达,那么共靶向可能对患者有益。于是研究团队在TNBC癌细胞中同时敲除了CA9和NFS1,发现细胞的铁水平升高,伴随着脂质过氧化增加,这是铁死亡的标志,表明了癌细胞在CAIX和NFS1双敲除后发生了铁死亡。
研究团队接下来试图评估将CAIX/XII抑制与限制胱氨酸可用性(NFS1 的底物)结合是否会通过抑制胱氨酸谷氨酸反向转运蛋白xCT导致铁死亡增强。CAIX/XII抑制本身也很少导致细胞死亡。然而,联合CAIX/XII抑制和xCT抑制治疗导致细胞死亡显着增加,表明铁死亡是由组合诱导的细胞死亡的主要模式。
随后研究团队在临床相关模型中共同靶向CAIX/XII和xCT,与在细胞系模型中的发现类似,这种组合导致来自多个患者的类器官细胞死亡显着增加,优于单独使用任一化合物的治疗。因此,共同靶向CAIX/XII和xCT会增强铁死亡,是在药理学上利用CAIX和NFS1之间合成致死相互作用的有效策略。
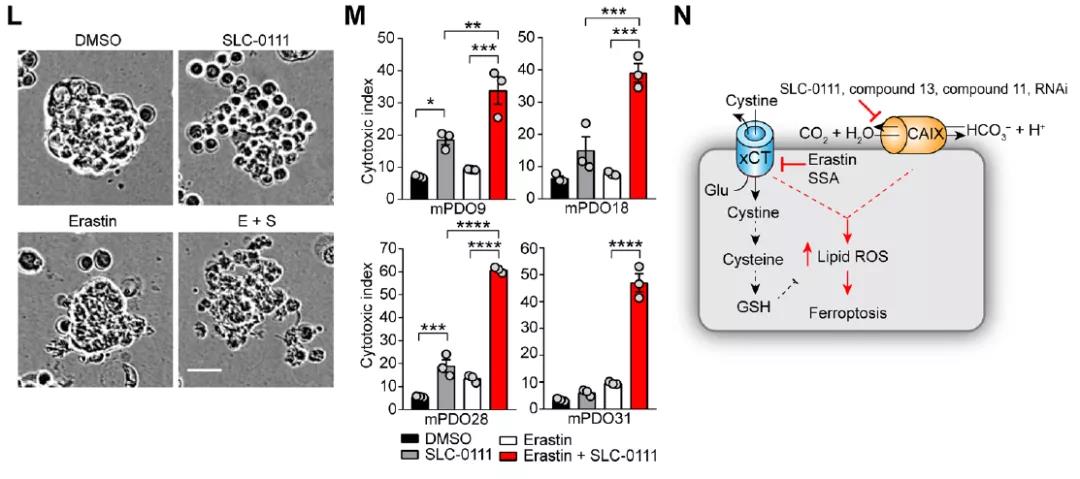
在深入的分子机制研究中,研究团队发现CAIX抑制剂导致了pHi的酸化,CAIX/XII 产生的碳酸氢盐通过碳酸氢盐转运蛋白输入,保护细胞免于铁死亡,表明 pHi调节在调节铁死亡中很重要。
AMPK信号传导对于维持代谢稳态至关重要,研究团队在共同靶向CAIX/XII和xCT后观察到了AMPK失活,这种失活与AMPK靶标ACC1的磷酸化减少相呼应,表明该组合疗法正在激活ACC1,从而导致铁死亡增强。以上数据还暗示了AMPK/ACC1/ACSL4轴在共靶向缺氧诱导的CAIX和xCT下游的重要性。
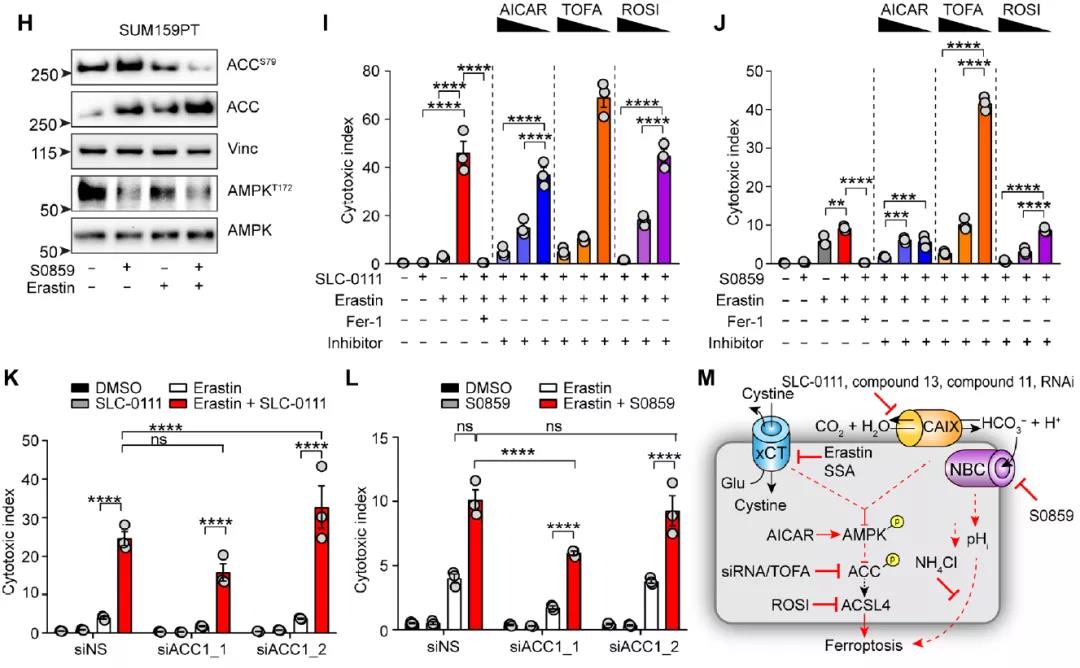
总而言之,这项工作确定了CAIX和NFS1之间的新型合成致死相互作用,xCT的抑制和 CAIX/XII抑制是在药理学上利用这种合成致死相互作用的一种非常有效的替代方法。该研究使人们意识到CAIX在氧化还原稳态和通过pH调节防止铁死亡中起到重要作用,并将帮助研究人员开发实体瘤治疗的新策略。
原始出处:
Shawn C. Chafe, et al. Genome-wide synthetic lethal screen unveils novel CAIX-NFS1/xCT axis as a targetable vulnerability in hypoxic solid tumors. Science Advances 27 Aug 2021: Vol. 7, no. 35, eabj0364. DOI: 10.1126/sciadv.abj0364.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#SCIE#
104
#铁死亡#与#肿瘤#的关系,未来可能成为新的治疗靶点
171