武汉大学黄世文教授AM:根除肿瘤、增强免疫-低功率LED驱动的持续温和光热疗法
2024-12-21 BioMed科技 BioMed科技 发表于陕西省
武大团队制备高光热转换效率金纳米聚集体 AuNAs,结合低功率 LED 光源提出持续温和光热疗法 smPTT,可根除肿瘤、诱导免疫反应,介绍其制备表征、效果、安全性、机制等。
实体肿瘤的光热疗法(PTT)因其微创性、高时空可控性、特异性和可重复性而备受关注。传统的高温光热疗法通常需要较高的局部温度(50 - 60℃)和高功率激光才能有效地根除肿瘤。然而,这种策略面临着许多挑战,包括剧烈疼痛、皮肤损伤、对周围组织的热损伤以及可能增加的转移风险。为了克服这些问题,提出了温和光热疗法(mPTT),在低于45℃的温度下实施,减少了副作用。尽管如此,癌细胞的耐热性以及热休克蛋白(HSPs)的上调限制了温和光热疗法的效果,因此这种疗法通常需要与其他治疗手段联合使用,或与抑制细胞保护机制的策略结合,但在彻底根除肿瘤方面,其疗效仍不及高温光热疗法(hPTT)。

为解决上述问题,武汉大学黄世文教授课题组提出了持续温和光热疗法(smPTT)。该疗法将具有高光热转换效率(92.8%)的金纳米聚集体(AuNAs)与低功率(约0.1 W/cm²)的便携可穿戴LED光源相结合。通过单次持续照射,在不同动物模型(如小鼠乳腺癌和黑色素瘤)中成功实现了肿瘤的完全根除,并在超过180天的长期监测中未见复发。与常规的温和光热疗法相比,这一新策略具有更显著的治疗效果,且在安全性上优于高温光热疗法。此外,smPTT还能诱导强烈的免疫反应和免疫记忆效应,这对于防止肿瘤复发和转移至关重要。这项新型光热疗法可能对浅表肿瘤的临床治疗产生重大影响,并为免疫疗法的进一步发展提供新思路。
该研究成果于近日以“High-Efficiency Gold Nanoaggregates for NIR LED-Driven Sustained Mild Photothermal Therapy Achieving Complete Tumor Eradication and Immune Enhancement”为题发表在Advanced Materials。武汉大学化学与分子科学学院24届硕士研究生祁明辉为论文的第一作者,黄世文教授为通讯作者。该研究成果得到了国家自然科学基金项目的资助。
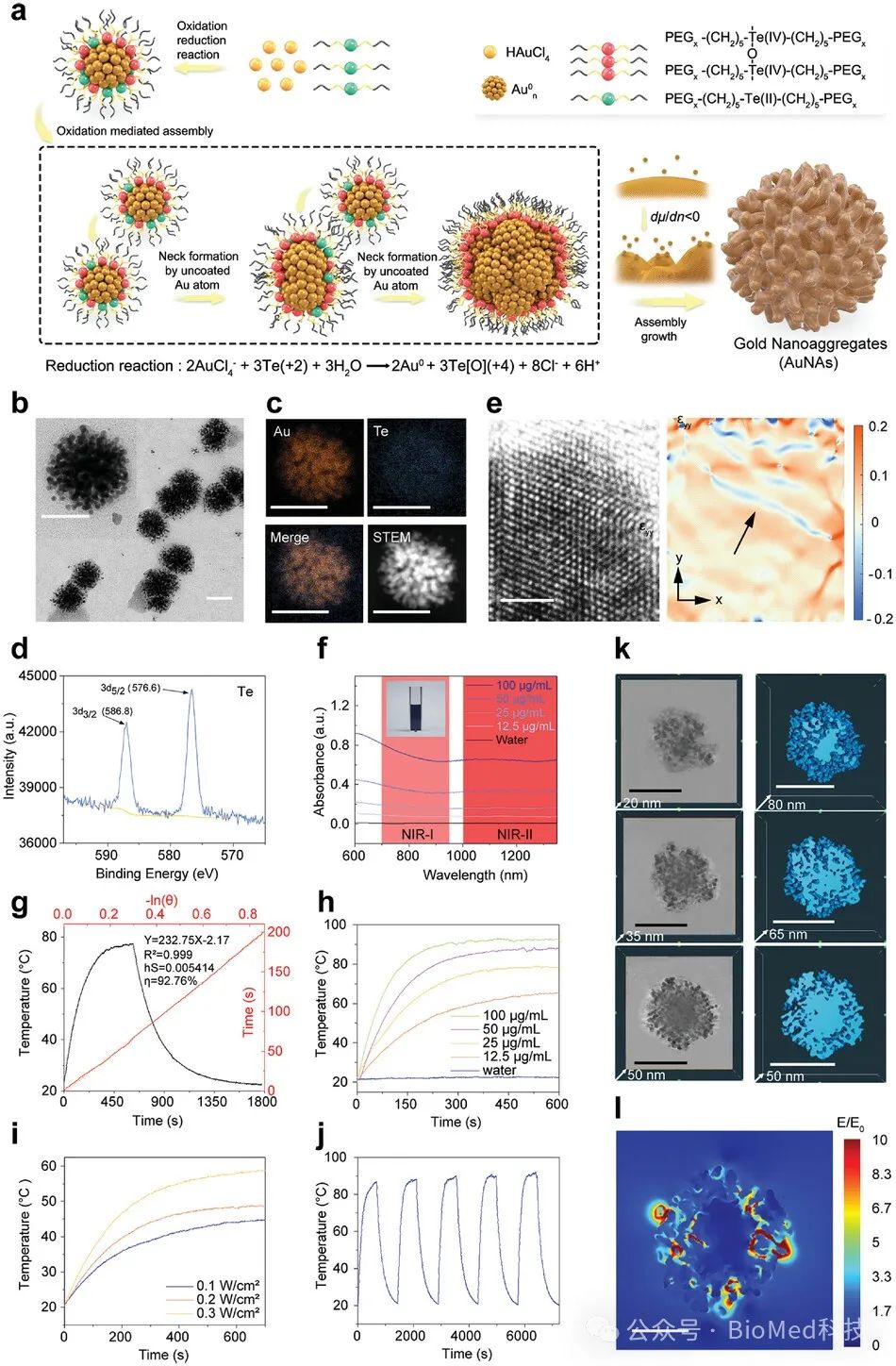
图1. 高效光热剂金纳米聚集体(AuNAs)的制备与表征
作者通过不同分子量的有机碲化物配体调控金纳米颗粒的生长过程,成功制备了具有极高光热转换效率(92.8%)的金纳米聚集体结构。该结构在具有较强组织穿透能力的近红外光一区(700 - 950 nm)和近红外光二区(1000 - 1350 nm)波段展现出广泛而强烈的光吸收,这对于深层肿瘤的治疗及临床转化至关重要。研究表明,即便在较低浓度(25 μg/mL)和较低光照功率(0.1 W/cm²)下,AuNAs也能实现超过20℃的温升,并且具有良好的光热稳定性。通过冷冻电子显微镜对AuNAs进行三维重构,发现其内部存在大量孔隙结构,这极大地增强了局域表面等离子体共振效应。
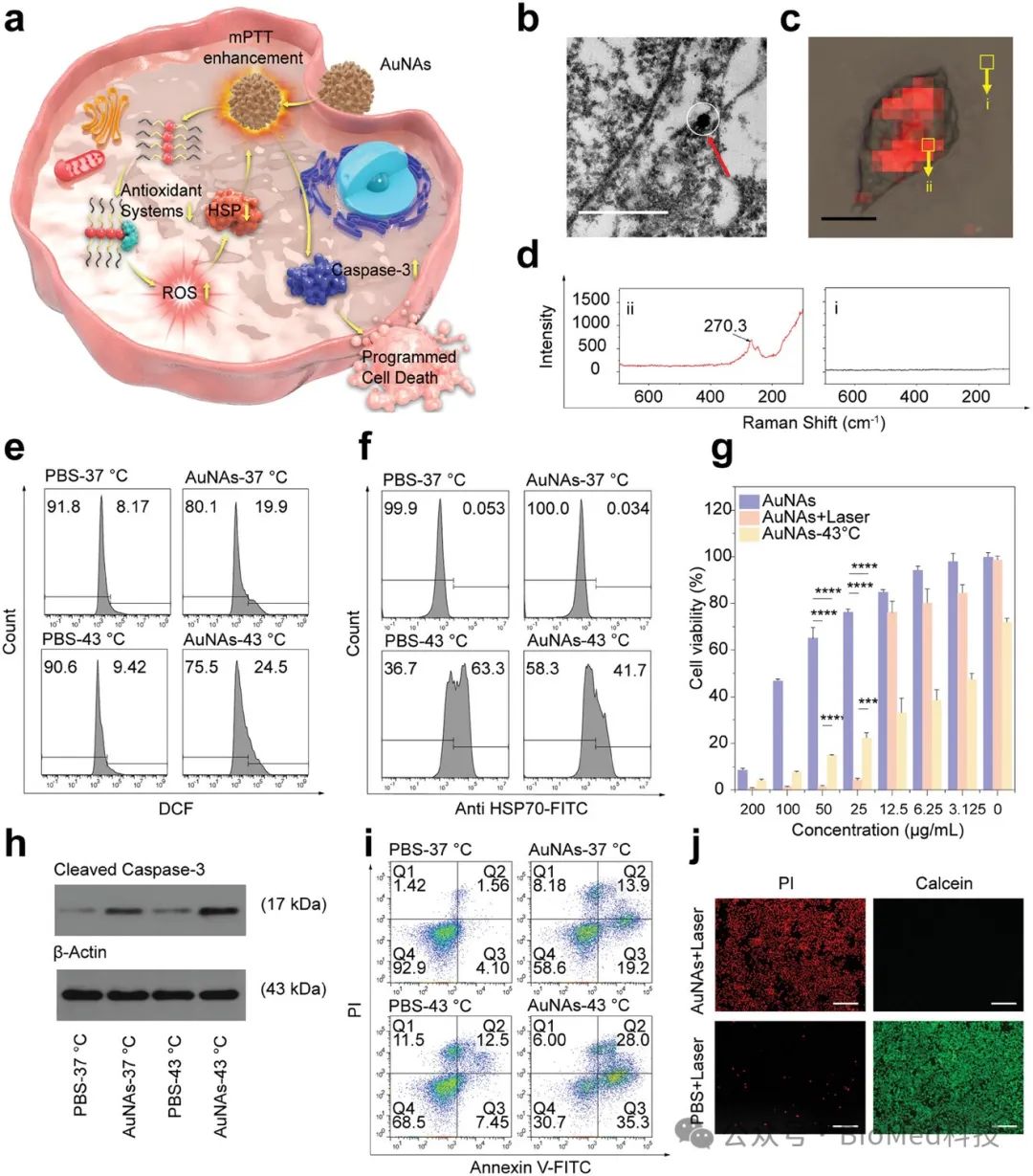
图2. AuNAs的体外抗肿瘤实验
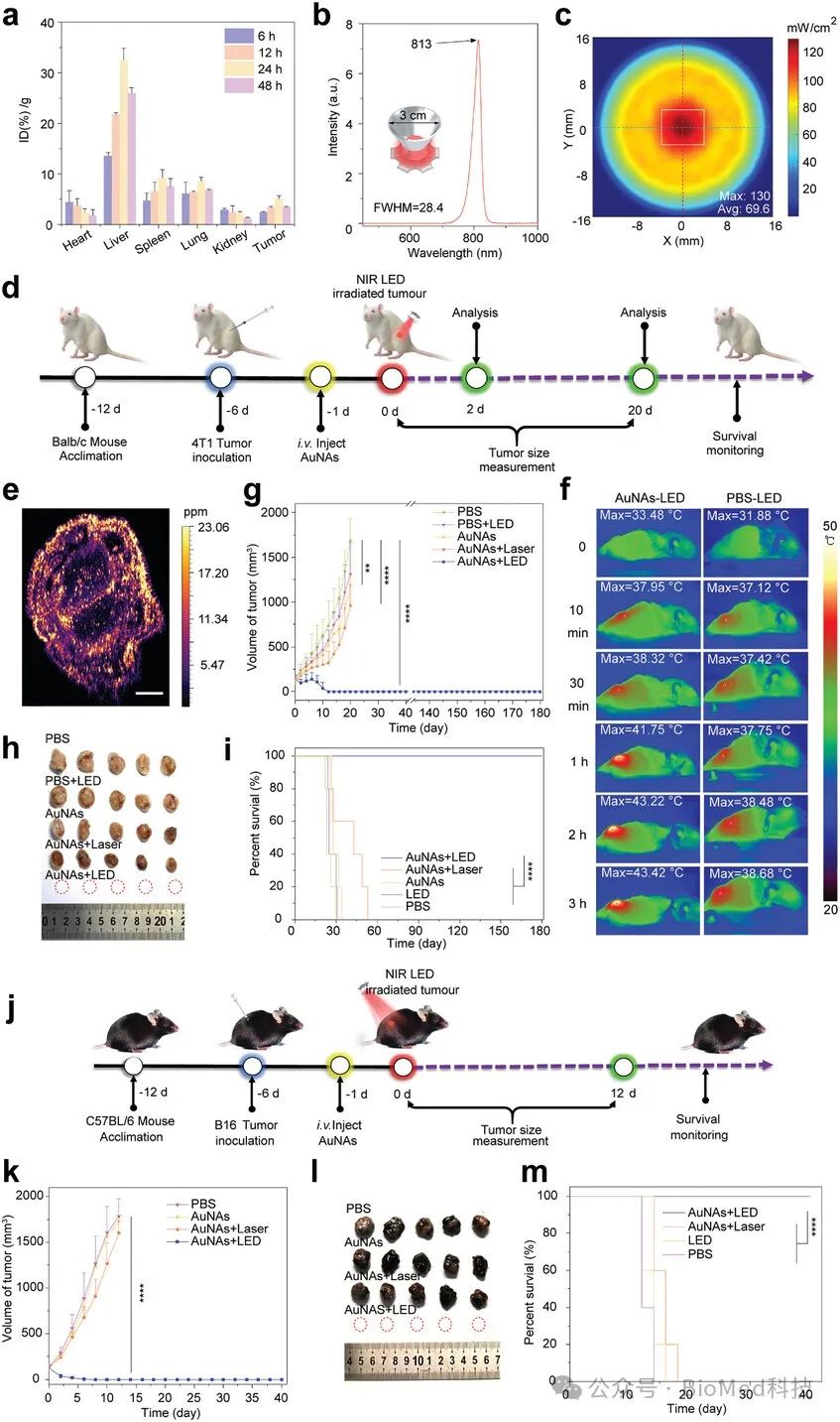
图3. smPTT的体内治疗效果
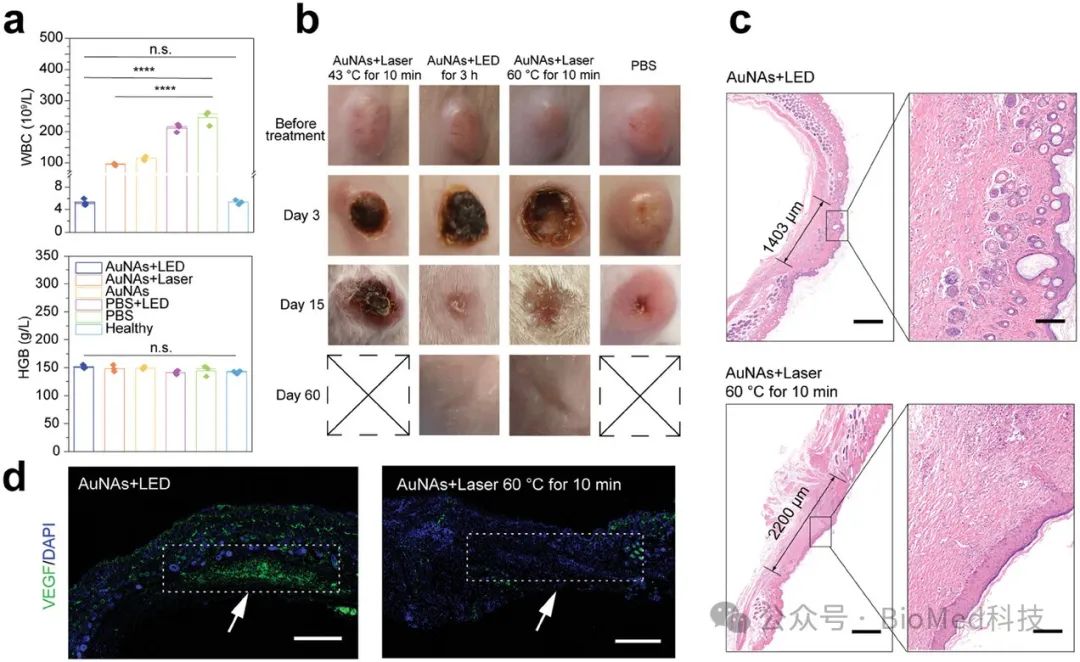
图4. smPTT的安全性评价
AuNAs通过其有机碲化物配体破坏肿瘤细胞内的氧化还原平衡,诱导过量活性氧(ROS)生成,并抑制由热效应引发的HSPs,从而克服肿瘤细胞的耐热性,使其对热杀伤更加敏感。通过诱导细胞凋亡,AuNAs有效杀伤肿瘤细胞。在小鼠乳腺癌和黑色素瘤动物模型中,smPTT疗法能够通过单次治疗实现肿瘤的完全根除,并在超过180天的长期监测中未见复发,明显优于常规的温和光热疗法(mPTT)。与高温光热疗法(60°C,10分钟)相比,smPTT所造成的损伤较小,安全性更高。此外,smPTT治疗后的实验小鼠体重无显著变化,血常规指标与健康小鼠无异,主要器官未见明显损伤,进一步证明了AuNAs和smPTT策略的生物安全性。
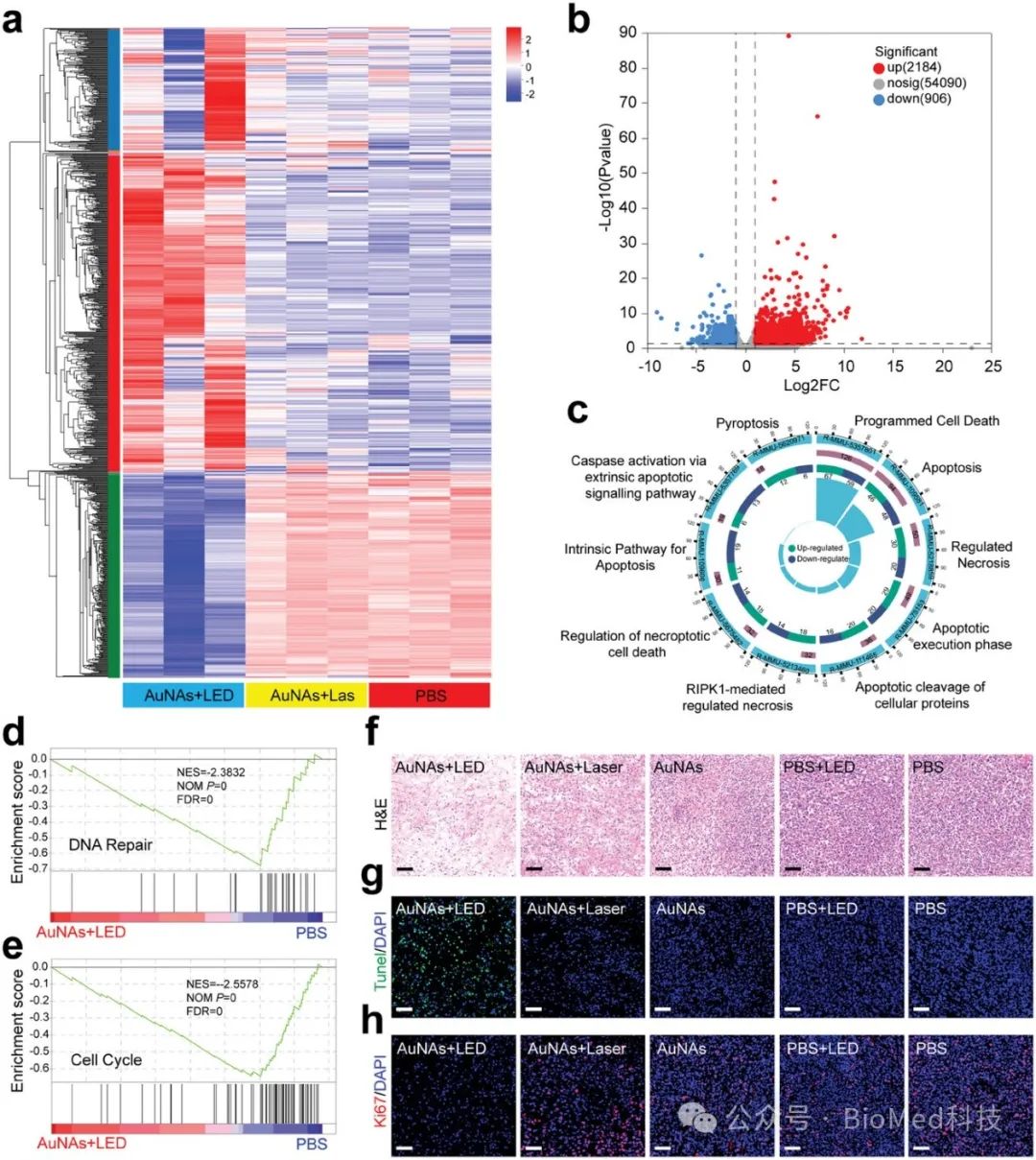
图5. smPTT后基因转录差异与细胞死亡途径
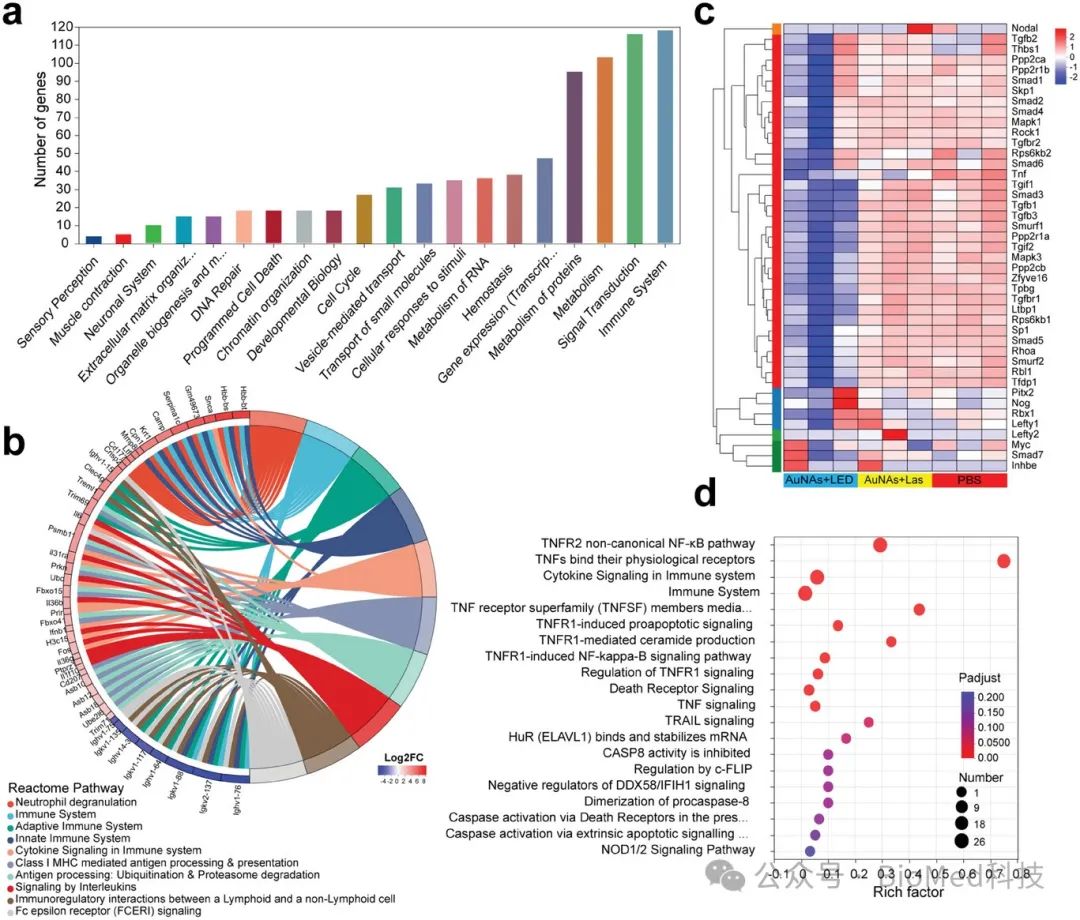
图6. smPTT诱导的免疫相关基因变化
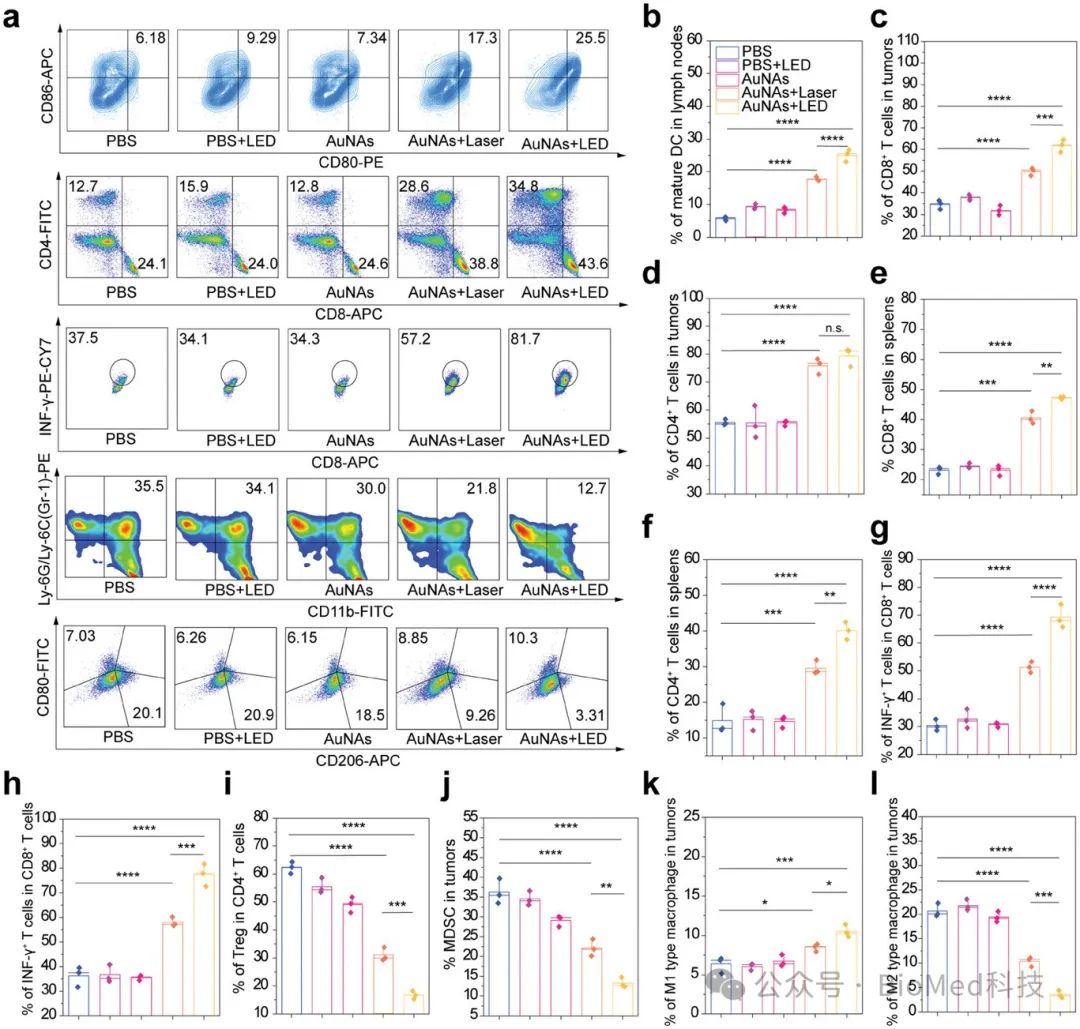
图7. smPTT诱导的免疫反应
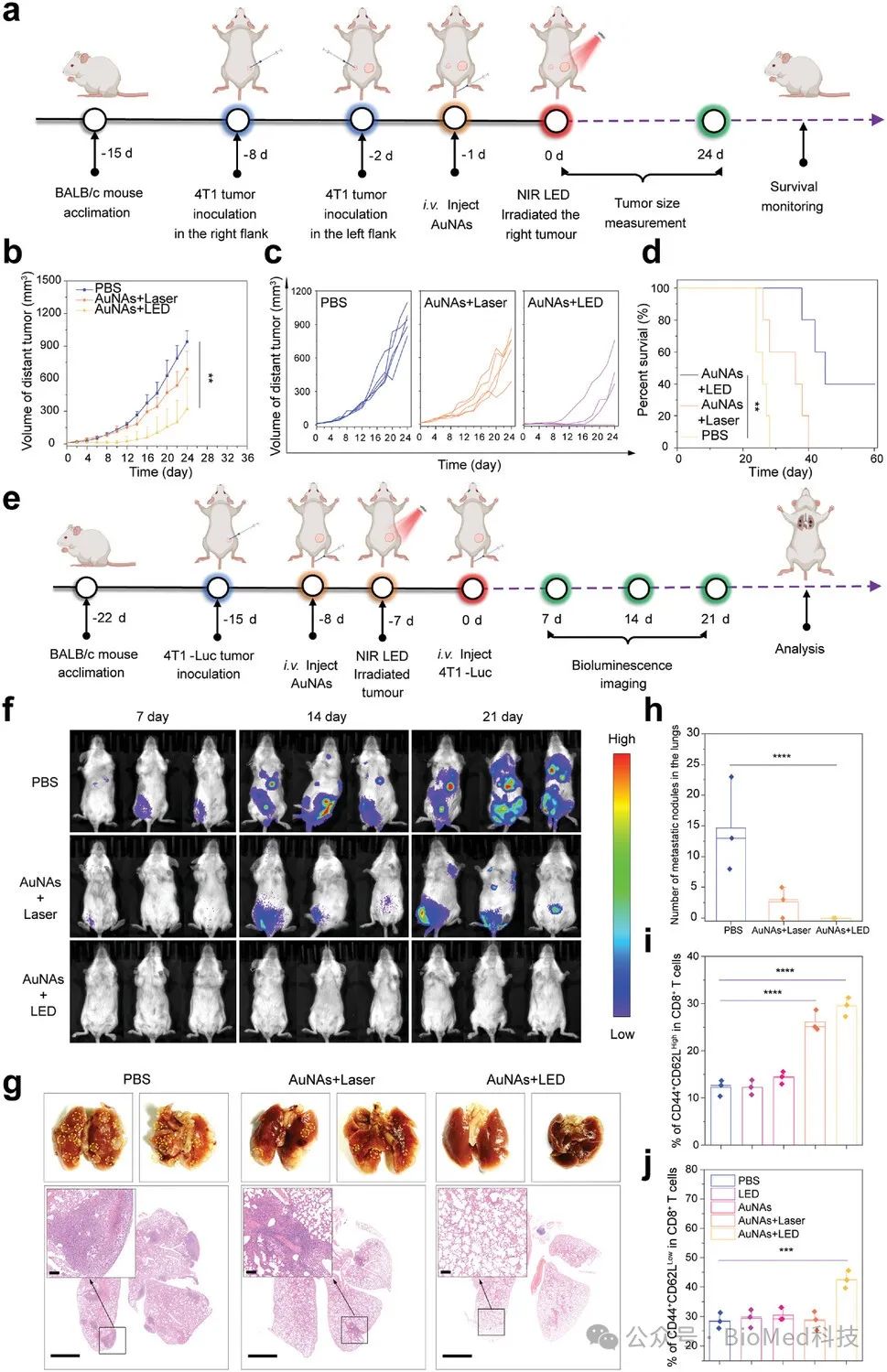
图8. SmPTT抑制肿瘤远端生长和肺转移
基因转录组学分析揭示,smPTT能够有效诱导肿瘤细胞的程序性死亡,并显著激活免疫反应,减弱肿瘤微环境中的免疫抑制。通过监测肿瘤组织及重要免疫器官中的免疫细胞变化,发现smPTT能够有效启动抗肿瘤免疫反应。这一反应通过增强效应T细胞的激活和募集,以及细胞因子的分泌,进一步强化免疫系统的肿瘤杀伤作用。此外,smPTT显著改善了具有免疫抑制性的肿瘤微环境,从而有力促进了肿瘤的完全根除、无复发并延长了生存期。更重要的是,smPTT可以通过增强的免疫反应抑制远端肿瘤的生长和肺部转移,增强免疫记忆效应。
总结
本研究通过有机碲化物配体调控金离子(Au³⁺)还原过程,成功构建了具有极高光热转换效率和HSPs抑制功能的金纳米聚集体(AuNAs)结构。同时,将低功率、可穿戴LED光源与高效光热剂结合,提出了持续温和光热疗法(smPTT)策略,成功实现了4T1和B16皮下肿瘤的完全根除。与高温光热疗法(hPTT)相比,smPTT展现出更高的安全性,且相比现有的温和光热疗法(mPTT),该策略具有更显著的治疗效果。此外,smPTT能够在局部和全身诱发强烈的抗肿瘤免疫反应和免疫记忆,抑制远端肿瘤生长及预防肿瘤转移。未来的研究应关注开发更先进的可穿透组织的光照系统,优化药物递送和光照方案,并进一步与免疫疗法结合,以提升治疗效果和安全性。此外,smPTT策略可能为智能植入式光控设备的研发提供有价值的思路,实现对深部肿瘤、心血管疾病及神经系统疾病等其他疾病的持续精准调控与治疗。
原文链接:
https://doi.org/10.1002/adma.202412191
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肿瘤根除# #温和光热疗法#
6