重大发现!黄苏云/何川发现乳腺癌脑转移的潜在分子机制
2020-10-31 椰子 inature
脑转移是癌症死亡的主要原因,但其分子机制知之甚少。另外,关于m6A阅读器YTHDF3在人类疾病中的作用还知之甚少。
脑转移是癌症死亡的主要原因,但其分子机制知之甚少。另外,关于m6A阅读器YTHDF3在人类疾病中的作用还知之甚少。
弗吉尼亚联邦大学黄苏云及芝加哥大学何川共同通讯在Cancer Cell 在线发表题为“YTHDF3 Induces the Translation of m6A-Enriched Gene Transcripts to Promote Breast Cancer Brain Metastasis”的研究论文,该研究显示YTHDF3过表达在临床上与乳腺癌患者的脑转移相关。
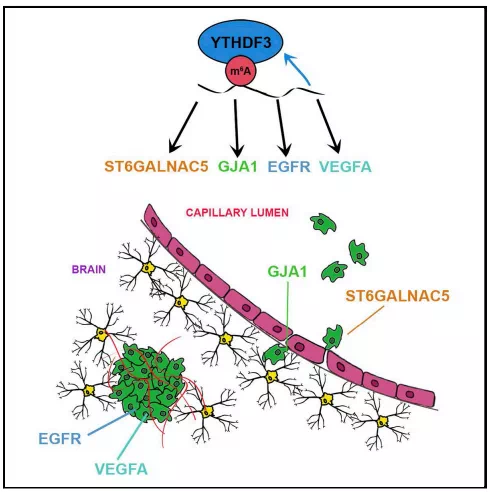
YTHDF3促进癌细胞与脑内皮细胞和星形胶质细胞的相互作用,血脑屏障的外渗,血管生成和生长。从机制上讲,YTHDF3增强了ST6GALNAC5,GJA1和EGFR的m6A富集转录物的翻译,这些转录物均与脑转移有关。此外,YTHDF3在脑转移瘤中的过表达归因于基因拷贝数的增加和YTHDF3帽非依赖性翻译的自动调节,其方式是与其自身5'UTR中的m6A残基结合。 该研究工作揭示了YTHDF3在控制癌细胞与脑微环境之间的相互作用从而诱导脑转移能力方面的重要作用。
脑转移发生在所有癌症患者中的20%以上,每年在美国大约发生20万次。乳腺癌,肺癌和黑色素瘤是最常见的转移到大脑的原发肿瘤类型。15%至30%的乳腺癌患者发生脑转移,这种疾病的严重程度通过其极低的存活率来反映。脑转移的高发生率及其对生存的影响提出了一个亟待满足的需求,即需要进一步了解其机制和新疗法。
癌细胞进行遗传和表观遗传学改变以获得转移能力。这样的变化之一是mRNA转录物的修饰。N6-甲基腺苷(m6A)是内部RNA修饰的最丰富形式。m6A-RNA修饰在多种细胞功能(如昼夜节律,热休克反应,干细胞维持和分化以及神经元功能)中的调节作用已开始显现。识别,写入或清除m6A的蛋白质发生改变可导致细胞过程发生变化,并在包括癌症在内的病理状况中发挥关键作用。最近的研究报道了m6A-RNA甲基化在维持胶质母细胞瘤和其他癌症的肿瘤发生方面的因果作用。m6A RNA甲基化和调节这一过程的蛋白质在乳腺癌脑转移中的作用尚待探索。
m6A甲基化RNA的命运和功能主要通过阅读器介导,包括YTH域家族蛋白(YTHDF1,YTHDF2,YTHDF3和YTHDC1),它们可以直接结合并读取mRNA上的m6A位点。这些识别蛋白会影响mRNA的稳定性和翻译以及RNA剪接和输出。多项研究报告称YTHDF3可以提高其靶标的翻译效率,并依赖于m6A甲基化。但是,目前关于YTHDF3的生物学功能和相关性知之甚少,关于YTHDF3在癌症发病机理中的确切功能和作用,实际上还一无所知。
在这里,该研究报告YTHDF3表达增加与乳腺癌脑转移形成和乳腺癌患者生存率下降直接相关。该研究结果表明,YTHDF3的敲低导致小鼠模型中脑转移形成的明显减少。从机制上讲,确定了一组对乳腺癌脑转移至关重要的YTHDF3靶基因。此外,YTHDF3介导的脑转移形成取决于m6A甲基化状态及其靶转录本的翻译效率提高。此外,该研究确定了脑转移中YTHDF3过表达的机制。
具体而言,YTHDF3促进癌细胞与脑内皮细胞和星形胶质细胞的相互作用,血脑屏障的外渗,血管生成和生长。 从机制上讲,YTHDF3增强了ST6GALNAC5,GJA1和EGFR的m6A富集转录物的翻译,这些转录物均与脑转移有关。 此外,YTHDF3在脑转移瘤中的过表达归因于基因拷贝数的增加和YTHDF3帽非依赖性翻译的自动调节,其方式是与其自身5'UTR中的m6A残基结合。 该研究工作揭示了YTHDF3在控制癌细胞与脑微环境之间的相互作用从而诱导脑转移能力方面的重要作用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#重大发现#
63
机制研究离临床仍然有距离,不过与临床结合思考,仍然有帮助的,不能仅仅是纯临床思维,转化思维同样重要
83
哇
110