Cell:微生物菌群通过触发免疫应答促进神经元修复再生
2023-04-17 brainnew神内神外 网络 发表于上海
组织功能的恢复和多系统修复的协调对宿主至关重要。对微生物群免疫的复杂功能的探索,可能为这些关键的公共卫生需求提供治疗靶点。
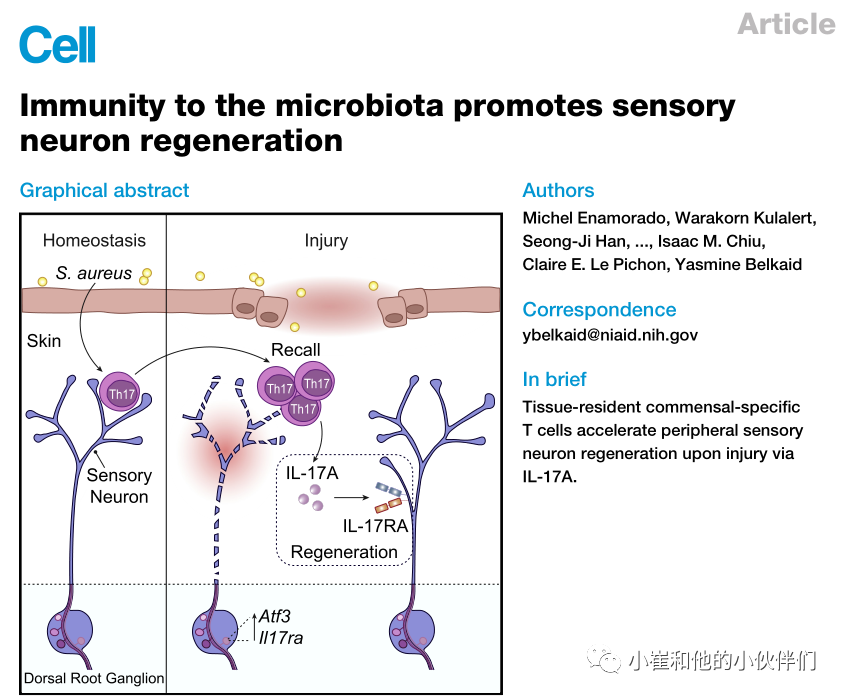
组织免疫和对损伤的反应依赖生理系统间的协调行动和沟通。组织受损后,对微生物群的适应性反应促进了感觉神经元的再生。在体内平衡时,组织驻留的共生特异性T细胞与真皮内的感觉神经纤维共存,表达与神经元相互作用和修复相关的转录程序,并促进损伤后轴突生长和局部神经再生。近期,《Cell》期刊发表了题为“Immunity to the microbiota promotes sensory neuron regeneration”的论文,作者团队揭示了损伤后由共生特异性Th17细胞释放的细胞因子白介素-17A (IL-17A)通过IL-17受体A直接向感觉神经元发出信号,IL-17受体A的转录在损伤的神经元中特异性上调。总的来说,作者团队揭示了在组织损伤的情况下,对微生物群的免疫可以通过直接促进神经元修复来快速桥接生物系统,同时也将IL-17A确定为这一基本过程的主要决定因素。
损伤或感染后组织完整性和功能的恢复对宿主的生存至关重要。屏障组织不仅是环境应激源的组成目标,也是居住微生物的生态位,被称为微生物群。因此,保护屏障的完整性对宿主和微生物群均有利。
微生物群在哺乳动物免疫系统的诱导、培养和功能方面发挥着基本作用。相反,在微生物或环境暴露的情况下,免疫系统运作以维持和恢复组织功能。屏障位点既是微生物群的家园又是环境压力源的主要目标,宿主-微生物群对话在屏障位点上特别重要。与这种控制相关的机制之一是通过诱导持久的微生物反应性T细胞发生的,这些T细胞可以广泛促进组织功能,包括抗菌防御和上皮再生。
所有的屏障组织,包括皮肤,都是密集的感觉神经纤维网络的家园,这些神经纤维参与了触觉、温度、疼痛和瘙痒的感知。最近的研究表明,除了这些基本功能外,感觉神经元还可以影响其他生物过程,包括宿主代谢、炎症和保护性免疫。这些研究结果加深了作者团队对生物系统之间,特别是免疫系统和神经系统之间相互联系的理解。
在感染或损伤的情况下,宿主的生存需要保护和修复所有组织成分,每个组织成分都需要特定的修复程序。
周围神经系统的修复和组织的神经再生对于感觉的恢复以及组织再生、新生血管和伤口愈合的协调尤为重要。因此,确定周围神经恢复的关键机制是一个活跃的研究领域,对于减少残疾和提高生活质量具有重要意义。为了应对微生物的定植,屏障位点组成了组织常驻的共生特异性T细胞。这意味着损伤或感染是在对微生物群的回忆反应的背景下发生的。在这种情况下,适应性免疫,特别是对微生物群的适应性免疫,是否有助于周围神经再生仍是未知的。基于微生物群与其宿主之间的深刻联盟,作者团队假设微生物群也可以作为加强组织保护的一种手段,在连接生物系统方面发挥重要作用。
在这里,对宿主-微生物群相互作用的探索让作者团队揭示了由共生特异性T细胞协调的外周神经元修复机制。具体地说作者团队揭示了组织常驻微生物群特异性T细胞可以直接促进损伤后的神经元修复,并确定IL-17A是这一基本过程的主要决定因素。
金黄色葡萄球菌(S.aureus)在作为病原体之前可以作为共生菌存在数十年。在这种情况下,在共生期间获得的先发免疫对于在随后的损伤和/或感染时保护和/或恢复组织完整性可能特别重要。
为了探索这种可能性,作者团队利用以前从健康小鼠皮肤中分离出的金黄色葡萄球菌菌株(42F02)。局部接触(TA)后,金黄色葡萄球菌42F02定植于皮肤数周,表皮厚度无变化,有少量中性粒细胞浸润。这种稳态关系与皮肤腔室中T细胞的强烈聚集有关,这些细胞主要是表达RORγt的CD4+T (Th17)细胞(图1A和1B)。这些反应在2周达到峰值,并持续至少2个月(图1A)。相比之下,对同一种微生物作为病原体的反应(皮内感染[ID]后)以组织损伤、炎症和高度极化的Th1反应为特征(图1B)。与T细胞对其他皮肤共生生物的反应一致,Th17细胞在皮肤中的积累依赖于细胞因子IL-1、活微生物和完整的淋巴结构。
为了评估Th17对金黄色葡萄球菌定植反应的特异性,作者构建了T细胞受体(TCR)转基因小鼠(SA1Tg),其中产生的所有T细胞都对金黄色葡萄球菌有反应。进一步强调了金黄色葡萄球菌的高度多样性,转基因T细胞的扩增仅在42F02菌株中被观察到,而对其他金黄色葡萄球菌菌株则没有反应。在局部接触金黄色葡萄球菌之前,SA1Tg细胞被转移到小鼠体内,与多克隆反应一致,金黄色葡萄球菌特异性T细胞在皮肤内积聚,主要发育为Th17细胞(图1C和1D)。这与感染同一细菌形成鲜明对比,在同一细菌中,SA1Tg主要以Th1细胞的形式发育(图1D)。
先前的报道提出了IL-17对金黄色葡萄球菌感染的保护作用。为了评估Th17对金黄色葡萄球菌的反应是否能提供对后续感染的保护性免疫,非相关小鼠和先前定植金黄色葡萄球菌的小鼠被金黄色葡萄球菌皮内感染(分别为TA单独感染和TA+ID感染)。先前定植的小鼠(TA+ID)感染促进了高度极化的Th17召回反应(包括多克隆和抗原特异性),在皮内感染后持续至少7天(图1E和1F)。这些Th17在皮内感染后的召回反应在先前与金黄色葡萄球菌共生的小鼠中占主导地位,而在先前感染相同细菌的小鼠中则不是这样(图S1H)。相比之下,先前的感染主要召回Th1细胞。尽管有强烈的Th17召回反应,但先前的局部关联对皮肤内的细菌负担没有影响(图1G)。此外,在这些设置下,仅在局部淋巴结内观察到保护作用(图1H),令人惊讶的是,全身细菌控制不依赖IL-17a,正如IL-17a-/-小鼠、抗IL-17a阻断抗体处理的小鼠和Th17细胞缺乏的小鼠(Ox40Cre+ Rorcf/f)所证明的那样。
因此,Th17对金黄色葡萄球菌作为共生体的反应对宿主产生局部或全身保护以抵御随后金黄色葡萄球菌感染的能力没有影响。这些观察结果指出共生体诱导的Th17细胞在组织生理学中的替代作用。
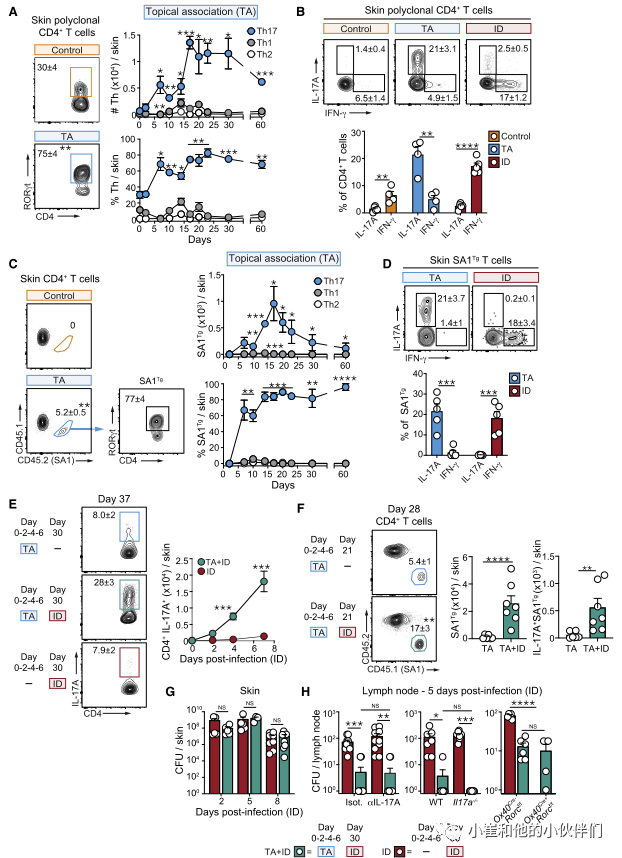
图1:金黄色葡萄球菌定殖诱导Th17细胞不影响宿主保护
为了探索金黄色葡萄球菌诱导的Th17细胞的生理作用,作者团队重点分析了与每种治疗相关的主要免疫反应,即TA诱导的Th17和皮内感染(ID)诱导的Th1(图1A和1B)。为此,作者分别从感染(ID)后2周和感染后1周的小鼠皮肤中分离Th17 (CCR6+ CD4+ Foxp3-)和Th1富集细胞(CCR6- CD4+ Foxp3-)进行RNA-seq分析(图2A)。作为对照,CD4+T细胞(T效应记忆[TEM]: CD44highCD62LlowCD4+ Foxp3-)也从非相关小鼠的区域(耳)淋巴结中分离出来。与来自ID的Th1相比,来自TA的Th17细胞显示了超过3000个差异表达的转录本。和预期一样,与17型相关的基因(II17a、II17f、Il22、Ccr6、Rorc和Rora)在Th17 (TA)中表达更高(图2A)。与共生特异性T细胞在上皮再生中的作用一致,与Th1细胞(ID)相比,Th17细胞(TA)中上调的许多转录物与组织修复有关,包括Tgfb1、Vegfa、Pdgfb、Furin、Mmp10、Mmp25和Areg(图2A)。
特别有趣的是,与Th1细胞(ID)相比,从金黄色葡萄球菌相关小鼠(TA)皮肤分离的Th17细胞表达了更高水平的与神经元相互作用和再生相关的转录物,包括Neu3、Lif、Marveld1、Ramp1、Ramp3、Ccr4和Tnfsf8(图2A)。与抗原体验细胞(TEM)相比,在Th17 (TA)的3168个差异表达基因中也发现了这些特征。
皮肤上神经密集地分布着感觉神经元,它们将感觉信息从环境传递到中枢神经系统(CNS)。基于此,作者团队接下来追踪金黄色葡萄球菌特异性T细胞与感觉神经元的潜在关系。为此,SA1Tg细胞被转移到感觉神经元可视化的小鼠(alphaCGRP-GFP报告小鼠)。随后将小鼠与金黄色葡萄球菌联系起来,并利用活体双光子显微镜进行成像。在确定的活体记录时间内,对SA1Tg T细胞与神经纤维之间的距离进行量化,结果显示部分SA1Tg T细胞与真皮层内的感觉神经元直接接触或接近(<10 mm, 75%)。在所有评估的时间点上金黄色葡萄球菌特异性T细胞明显更接近alphaCGRP+神经纤维(平均±SEM, 5.9±0.2 mm),而不是血管(平均±SEM, 14±0.4 mm)(图2B)。这与感染背景下诱导的金黄色葡萄球菌特异性Th1细胞形成对比,后者与感觉神经元无关。因此,在稳态条件下金黄色葡萄球菌局部联合促进了与皮肤内感觉神经元共定位的Th17细胞的积累。
在感染或损伤的情况下,共生特异性T细胞由于暴露于微生物抗原的增加而被召回。Th17细胞存在于各种构型中,从稳态到致病性,其特征是由确定的核心基因。与共生特异性T细胞的替代功能一致,局部联合诱导的Th17细胞表现出稳态转录组特征,而单独感染诱导的Th17细胞则表现出更具致病性的特征(ID)(图2C)。与Th1细胞(ID)相比,感染关联后(TA+ID)召回的Th17细胞的功能富集分析也显示了与神经相互作用和再生相关的三种不同的基因本体(GO)富集,特别是髓系白细胞激活(小胶质细胞调节)、细胞投射组织调节(轴生)和神经递质转运(图2C、D)。此外,与Th1细胞(ID)相比感染后关联(TA+ID)召回的Th17细胞也丰富了其他7个与组织修复广泛相关的GO富集,包括上皮细胞的形态建成、ECM受体相互作用和对损伤的反应(图2D)。当将召回的Th17细胞(TA+ID)与抗原体验细胞(TEM)进行比较时,也证实了GO术语在神经相互作用、再生和组织修复方面的富集。
与单纯感染后关联(TA或ID)的Th17细胞相比,感染后关联(TA+ID)的Th17细胞也表达了更高水平的典型Th17相关基因以及与Th17细胞代谢相关的多个基因,包括转运体(Tmem176a和Tmem176b)(图2C-2F)。此外,与单独感染TA或ID的Th17相比,先前局部相关(TA+ID)的感染小鼠召回的Th17细胞表达了更高水平的与组织修复和伤口愈合以及神经相互作用和再生相关的转录本(Neu3, Ramp1, Lif, Ccr4, Tnfs8和Marveld1)(图2F)。因此,在侵入性感染的情况下,共生体诱导的Th17细胞表达了更多的神经相互作用和再生基因特征。
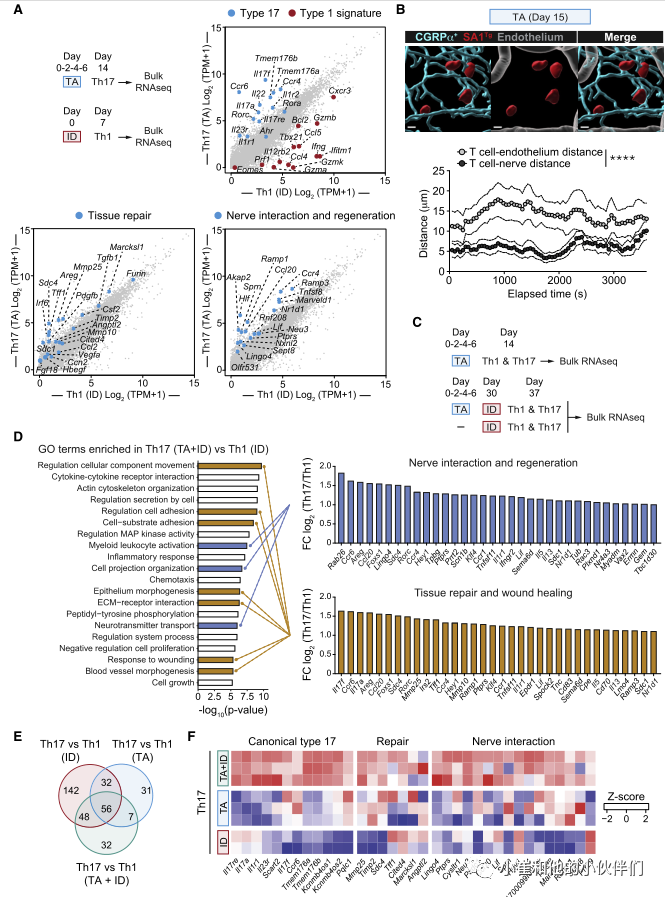
图2:金黄色葡萄球菌诱导的T细胞表达神经元再生转录组特征。
为了测试金黄色葡萄球菌诱导的T细胞有助于周围神经再生的可能性,作者团队接下来采用导致轴突损伤的皮肤损伤模型。在这个模型中,受损的轴突生长回来,在损伤部位周围形成神经纤维环(再生环)。与未接触的小鼠相比,先前局部接触金黄色葡萄球菌可增加CD4+ T细胞的数量(图3A和3B),特别是Th17细胞积聚在再生环周围。值得注意的是TA显著增加了损伤部位周围神经纤维的面积和体积,表明神经元再生增强(图3A和3B)。
另一方面,与对照组相比先前与表皮葡萄球菌(LM087)的联系降低了损伤时的纤维密度,这支持了定义菌株和/或微生物分离株可能对神经元修复有不同影响的观点。为了测试IL-17A可能导致这一现象的可能性,作者评估了用抗IL-17A阻断抗体处理的金黄色葡萄球菌相关WT小鼠和IL-17A-/-小鼠的神经元再生。两种方法都表明,金黄色葡萄球菌加速损伤后神经再生的能力依赖IL-17A(图3C, 3D)。尽管皮肤内的多种细胞类型都可以产生IL-17A,但T细胞中RORγt的选择性消融显示Th17细胞是支持这一过程所必需的(图3E)。总之,这些数据表明金黄色葡萄球菌特异性Th17细胞(1)靠近真皮神经元,(2)在损伤部位边缘富集,(3)能以IL-17a依赖的方式促进局部神经再生。

图3:葡萄球菌诱导的Th17细胞促进局部神经再生
先前的研究表明,在秀丽隐杆线虫中IL-17直链蛋白可以直接作用于中间神经元,从而调节行为。脑和肠内神经元的IL-17RA表达也影响社会行为。为了评估皮肤感觉神经元对IL-17A产生反应的可能性,作者团队分离了背根神经节(DRG)感觉神经元。这些神经元包含着轴突,它们支配皮肤,也投射到脊髓,将感觉信息传递给中枢神经系统。由于解剖对神经元轴突有很强的损伤,培养的DRG神经元细胞体已被证明是研究神经元损伤和再生的相关模型。因此,他们将从WT小鼠分离的DRG神经元体外暴露于IL-17A(图4A)。24小时后,IL-17A诱导7个基因的离散性上调,96小时后,与对照相比IL-17A处理的DRG中有61个差异基因表达 (图4A)。值得注意的是,IL-17A促进了涉及神经元维持和再生的许多方面的基因的表达,包括神经元发育、迁移、分化和轴突生长(Ccl11、Ccl2、Ereg、Mmp13、Il6、Mmp3、Fgf7和Cxcl5)(图4A)。第二类基因上调与神经元反应/功能相关,包括神经元兴奋、突触和神经元代谢(Steap4、Mme、Hsd11b1、Cxcl1、Prg4、Slc7a11和Lgi2)(图4A)。此外,IL-17A促进基质金属蛋白酶(MMP)和表皮生长因子(EGF)转录本的表达(图4A),两者之前都被报道与伤口愈合和角质细胞分化有关。因此,IL-17A可以直接向感觉神经元发出信号,并诱导与神经元和上皮修复相关的转录组程序。
先前的研究表明,神经损伤后,神经元会进行转录重编程,这需要激活转录因子3 (Atf3)的表达。该因子在损伤后迅速上调,促进轴突再生和功能恢复。在他们的实验系统中(图4B), Atf3在穿孔活检后颈椎DRG2神经元中特异性上调(图4C, 4D)。虽然DRG神经元在稳定状态下表达低水平的II17ra,但损伤引发了II17ra的显著上调,并持续至少96小时(图4C和4D)。值得注意的是,Atf3和II17ra的上调伴随着类似的损伤后动力学(图4D)。损伤神经元(Atf3+)表达的II17ra也明显高于未损伤神经元(Atf3-)(图4E)。坐骨神经横断后,腰DRG感觉神经元也观察到II17ra在mRNA(图4F、4G)和蛋白水平(图4H和S4C)上的上调。此外,对公开数据的再分析证实了坐骨神经横断模型中受损神经元的II17ra表达上调。损伤后,Atf3缺陷神经元中II17ra的表达显著降低,支持Atf3与II17ra表达之间的潜在联系。因此,IL-17RA的上调可能是神经元损伤的保守反应。
接下来,为了正式评估损伤神经元上直接IL-17A信号在体内修复过程中的贡献,作者团队在损伤神经元中特异性敲除II17ra (Atf3Cre Il17raf/f)。使用这种方法,作者证实在先前与金黄色葡萄球菌相关的小鼠中,损伤神经元中II17ra的缺失显著损害神经再生。因此,作者证明神经元IL-17RA信号通路促进神经元损伤后的感觉神经元再生。
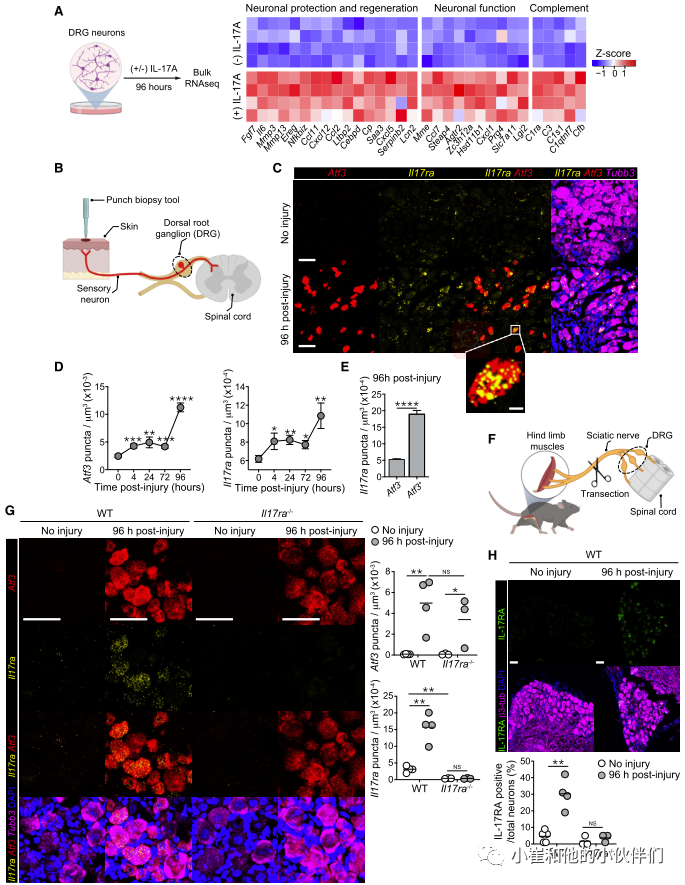
图4:II17ra在损伤神经元中表达上调
如前所述,颈椎DRG神经元中有部分细胞体是Trpv1+感觉神经元(图5A)。穿刺活检后,作者团队发现Trpv1+神经元中II17ra表达丰富(图5A)。在这些设置下,强化再生不需要TRPV1的表达。与金黄色葡萄球菌相关的损伤后神经元再生增加,包括CGRP阳性和阴性纤维。值得注意的是,金黄色葡萄球菌还增加了抗GFRA-2抗体染色的非肽能感觉神经元的密度,支持了这种现象可能广泛适用于大多数C纤维感觉神经元的观点。为了评估IL-17A信号在需要修复的感觉神经元中的作用,他们在TRPV1+感觉神经元中特异性地敲除II17ra (Trpv1Cre Il17raf/f)。在先前与金黄色葡萄球菌相关的小鼠中,与穿孔活检后的对照组相比TRPV1+感觉神经元中II17ra的缺失显著损害了神经元纤维的再生(通过泛神经元标记物b3-微管蛋白可见)(图5B和5C)。特别有趣的是,缺乏IL-17RA时感觉神经元(α-CGRP表达纤维)的增强修复完全消失(图5B和5D)。
接下来,作者团队评估了金黄色葡萄球菌诱导的神经元修复对皮肤内痛觉的影响。机械感(机械性异响痛)采用von Frey试验进行评估。在损伤后7天观察到与未损伤和非相关损伤小鼠相比,相关损伤小鼠的机械性异常痛水平更高。机械感增强依赖于Th17(图5E)。接下来,作者评估了先前与金黄色葡萄球菌相关或不相关的小鼠神经元修复。值得注意的是,在穿孔活检后的第30天,相关和非相关小鼠的神经元修复水平都达到了相当的水平(图S5D)。与这一观察结果一致,与对照小鼠相比,先前与金黄色葡萄球菌相关的小鼠并没有表现出增强的机械异位痛(图5F),这支持了加速修复并不以感官改变为代价的观点。总而言之,这些数据表明,IL-17/IL-17RA轴对共生菌群的反应是在不影响长期机械感觉的情况下调节损伤后的感觉神经再生。

图5. 神经元IL-17RA信号通路促进感觉神经元再生,与异常机械感觉无关
作者发现了适应性免疫在外周组织神经元修复中的一个以前不被重视的作用。更具体地说,作者发现由组织常驻共生特异性T细胞释放的局部作用细胞因子可以协调皮肤内的神经元修复。
宿主的行为、代谢和炎症可以被神经系统和免疫系统之间的对话深刻影响。尽管目前大多数认识是强调先天免疫是免疫系统和神经系统之间的主要桥梁,但最近的研究发现,适应性免疫在控制宿主感觉处理和社会行为方面发挥重要作用。值得注意的是,作者发现对常驻微生物群的适应性免疫也可被重新利用来介导神经元修复。
损伤后外周神经系统的修复需要在各种支持细胞介导的许可环境下迅速激活受损神经元的再生程序。周围神经系统的修复和组织的神经再生对于感觉恢复,以及协调上皮组织再生、新生血管和伤口愈合尤为重要。周围神经系统修复失败会对宿主产生严重后果,包括神经性疼痛以及运动和感觉功能的丧失。
先前的工作揭示了巨噬细胞和中性粒细胞在神经元完整性恢复中的基本作用。在皮肤内部,真皮巨噬细胞监视并塑造神经纤维中的髓鞘,从而促进轴突在机械损伤时萌发。在肠道内,肌层巨噬细胞诱导神经元保护,并通过β-2肾上腺素能受体减少感染引起的神经元损失,这表明适应性免疫也可以促成这种现象。
屏障组织是环境应激源的组成目标,也是暴露于共生和致病微生物的主要部位。所有屏障表面的微生物都被免疫系统积极识别,与共生微生物相遇促进同源T细胞反应和损伤后角质形成细胞再上皮化的诱导。因为屏障组织是由共生体和共生反应性组织常驻淋巴细胞组成的共存所定义的,任何感染或损伤都发生在对微生物群,尤其是Th17细胞的召回反应的背景下。他们的工作提出,这些典型的共生特异性Th17细胞可以通过IL-17A作为神经元修复的主要介质。
IL-17A促进神经元修复的机制仍有待充分研究,可能涉及多种途径。例如作者团队发现神经元对IL-17A的反应促进了能够与神经元和上皮细胞通信的因子的产生(例如Fgf7, Mmp3和Mmp13)。先前的研究表明,体感神经元在应对各种神经损伤时经历了保守的转录重编程,其中ATF3是损伤后神经元重编程的核心。虽然ATF3协调这些过程的精确机制仍有待完全了解,但这种转录因子已被证明可以促进轴突再生并抑制损伤神经元的细胞同一性。ATF3在细胞存活和维持中的作用也延伸到其他类型的细胞。例如在应激状态下,上皮细胞可以诱导ATF3作为生存/愈合相关的有丝分裂介质。他们的工作揭示了Atf3在损伤后的快速上调与II17ra的表达同时发生,支持了Atf3在神经元中协调IL-17RA表达的观点。在缺乏Atf3的损伤神经元中,II17ra的表达显著降低,提示II17ra可能受Atf3的直接转录控制,Atf3可能促进感觉神经元获得IL-17A的响应性。
作者的数据还显示除了肽能感觉神经元(CGRP+)外,其他感觉纤维(非肽能)也表现出与金黄色葡萄球菌相关的加速修复,支持IL-17A可能广泛促进C纤维感觉神经元修复的观点。虽然加速修复并没有以长期改变机械感觉为代价,但可以推测在IL-17A过度表达的高炎症环境下,作者发现的现象也可能是疼痛加剧的基础。
组织功能的恢复和多系统修复的协调对宿主至关重要。对微生物群免疫的复杂功能的探索,可能为这些关键的公共卫生需求提供治疗靶点。在这种情况下,作者团队发现IL-17A/IL-17RA轴的上调代表了受伤神经元的保护反应,这种治疗方法打开了大门,以增强损伤后的感觉恢复或限制糖尿病和化疗背景下的神经病变。
编译仅供参考,精读文献请下载原文:
Enamorado M, Kulalert W, Han SJ, Rao I, Delaleu J, Link VM, Yong D, Smelkinson M, Gil L, Nakajima S, Linehan JL, Bouladoux N, Wlaschin J, Kabat J, Kamenyeva O, Deng L, Gribonika I, Chesler AT, Chiu IM, Le Pichon CE, Belkaid Y. Immunity to the microbiota promotes sensory neuron regeneration. Cell. 2023 Feb 2;186(3):607-620.e17.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








谢谢分享
81