Nature子刊:上海体育大学郭亮课题组揭示Cdo1促进运动对非酒精性脂肪肝的缓解作用及机制
2023-12-20 iNature iNature 发表于上海
该研究运用小鼠模型发现,运动通过cAMP/PKA/CREB信号通路诱导肝脏I型半胱氨酸双加氧酶(Cdo1)的表达。
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他明确的肝脏损伤因素外所致的以肝细胞内脂肪过度沉积为主要病理特征的慢性肝脏疾病(肝脏重量的5%以上是脂肪),是引发肝纤维化、肝硬化和肝癌等肝脏疾病的重要原因之一。预计目前全球NAFLD的患病率约为25%,而我国现有超2.4亿的NAFLD患者,占全球NAFLD患者总数的1/5以上[2]。作为一种有效预防和治疗NAFLD的方法,运动锻炼逐渐受到人们的重视[3]。阐明运动锻炼缓解NAFLD的分子机制,对于个性化和精准化干预NAFLD运动处方的制定具有重要意义。
2023年12月18日,上海体育大学运动健康学院郭亮教授课题组在Nature Communications 上发表了题为“Cdo1-Camkk2-AMPK axis confers the protective effects of exercise against NAFLD in mice”的研究成果,该研究运用小鼠模型发现,运动通过cAMP/PKA/CREB信号通路诱导肝脏I型半胱氨酸双加氧酶(Cdo1)的表达。肝细胞Cdo1能够促进Camkk2与AMPK的相互作用以激活AMPK信号通路,促进了肝细胞线粒体的生物合成和脂肪酸氧化,从而促进运动对高脂饮食诱导的非酒精性脂肪肝的缓解作用。

I型半胱氨酸双加氧酶(Cdo1)作为哺乳动物非血红素Fe(II)双加氧酶家族中的一员,在多种组织与器官中有不同程度的表达,尤其在肝脏和脂肪组织中的表达最为丰富。Cdo1主要催化体内半胱氨酸的分解代谢以调控机体含硫氨基酸水平。Cdo1能够将半胱氨酸氧化为半胱氨酸亚磺酸,后者又进一步代谢为牛磺酸或硫酸盐[4]。团队前期合作研究发现,小鼠脂肪细胞特异性敲除Cdo1会抑制脂肪组织脂解基因的表达,削弱小鼠能量消耗和寒冷耐受能力,加剧高脂饮食诱导的肥胖、糖耐量受损和胰岛素抵抗。小鼠脂肪细胞特异性过表达Cdo1则产生相反的效应。上述工作于2022年发表在Nature Metabolism杂志[5]。Cdo1的沉默或异常表达与多种疾病的发生发展密切相关[4]。然而,迄今为止,Cdo1在NAFLD中的作用鲜有报道。
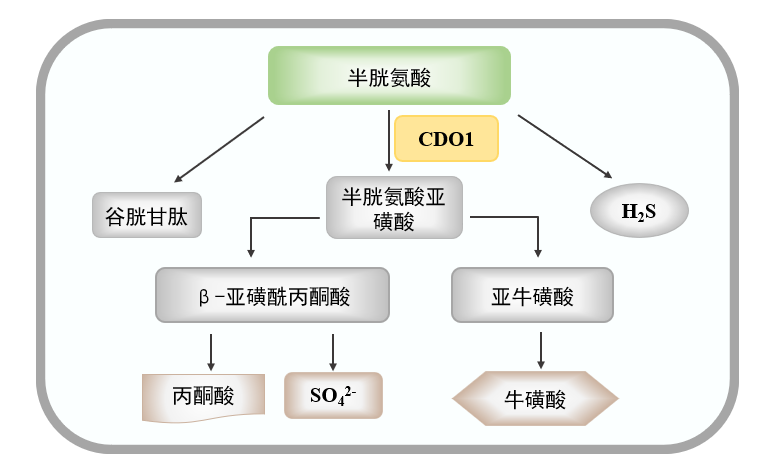
Cdo1是催化半胱氨酸分解和牛磺酸生成的重要代谢酶。
研究团队此次最新的研究发现,有氧运动(8周跑台锻炼)能促进肝脏Cdo1的基因和蛋白表达,且伴随着小鼠肝脏cAMP水平的升高和CREB磷酸化的激活。通过Cdo1启动子荧光素酶报告基因实验和染色质免疫共沉淀实验发现,cAMP/PKA通路活化的CREB能够结合到Cdo1基因启动子上,进而促进Cdo1基因的转录表达。这些结果提示肝脏Cdo1是一个潜在的运动响应因子。通过对NCBI的GEO相关数据分析发现,与非NAFLD个体相比,NAFLD病人肝脏Cdo1的表达显著降低。在高脂饲料(HFD)喂养的NAFLD小鼠肝脏中,同样发现Cdo1的表达相较于对照非NAFLD的小鼠显著降低。这些结果提示肝脏Cdo1表达的异常可能在NAFLD中发挥潜在作用。
为了深入研究Cdo1在运动缓解NAFLD中的可能作用和分子机制,研究团队运用肝细胞特异性敲除Cdo1(Cdo1LKO)或肝细胞特异性过表达Cdo1(Cdo1LTG)的小鼠以及对照小鼠先进行8周HFD喂养,然后进行为期8周的跑台运动,运动干预过程中依然进行HFD喂养。结果发现,Cdo1LKO抑制了小鼠的基础代谢率并显著削弱了运动锻炼缓解NAFLD的作用。而Cdo1LTG能够增强小鼠的基础代谢率并缓解小鼠的NAFLD,并且Cdo1LTG和运动锻炼能够协同缓解NAFLD。与在体实验一致的是,体外细胞实验发现肝细胞特异性敲除Cdo1抑制肝细胞的线粒体生物合成和脂肪酸氧化(FAO),进而加重脂肪酸诱导的肝细胞脂肪变性。而过表达野生型Cdo1(Cdo1-WT)或酶活性缺失的Cdo1(Cdo1-MUT)都能促进肝细胞线粒体功能和FAO,从而减轻肝细胞脂肪变性。上述研究同时揭示了Cdo1不依赖于其酶活性的新的非经典功能。
通过对小鼠肝脏RNA-Seq数据进行KEGG通路分析,发现AMPK信号通路在显著下调的基因中富集(Cdo1LKO vs WT)。这提示Cdo1可能参与调控AMPK信号通路的活化。进一步研究发现在肝细胞中敲低AMPKα阻断了Cdo1促进线粒体功能和FAO的作用,以及对肝细胞脂肪变性的缓解作用。这些结果证实了AMPK信号通路在Cdo1对NAFLD的缓解作用中是至关重要的。在进一步的分子机制研究中,研究团队通过免疫共沉淀、激光共聚焦和体外激酶实验等,证明了Cdo1及其酶活性缺失的突变体可以作为脚手架蛋白(Scaffold protein)同时与Camkk2和AMPK的相互作用,促进Camkk2对AMPKα的磷酸化,从而激活AMPK信号通路。敲低Camkk2显著抑制Cdo1对AMPK信号通路的激活作用,而敲低LKB1则无上述效应。
该研究首次发现肝细胞Cdo1是运动的潜在下游效应分子,其可促进运动对高脂饮食诱导的小鼠非酒精性脂肪肝的缓解作用;揭示了Cdo1-Camkk2-AMPK轴抑制肝细胞脂肪变性的新机制;有助于阐明运动缓解非酒精性脂肪肝的分子机理,为运动干预脂肪肝进展、精准运动防治脂肪肝提供理论依据和新的分子靶点。
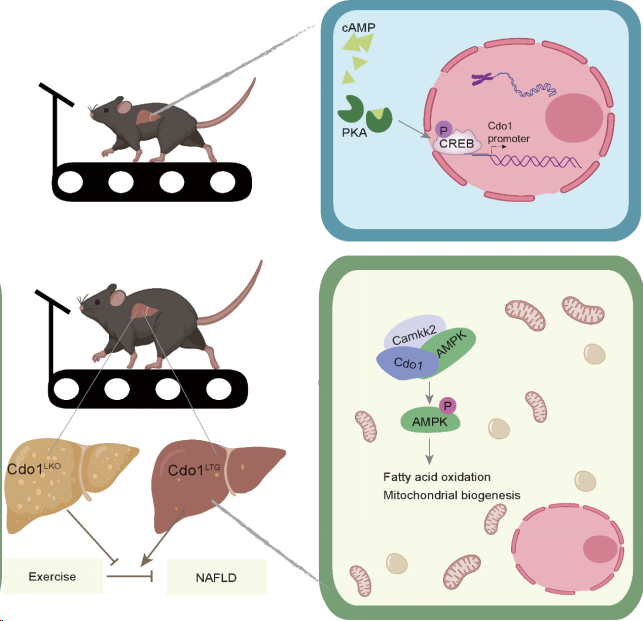
Cdo1促进运动对非酒精性脂肪肝缓解作用的分子机制模式图(图源自Nature Communications)。
上海体育大学2021级博士研究生陈敏为该论文的第一作者。上海体育大学运动健康学院教授、上海市东方学者特聘教授郭亮为本文的通讯作者。上海体育大学为该论文的第一通讯单位。
原文链接:
https://www.nature.com/articles/s41467-023-44242-7
参考文献
[1] Lee E, Korf H, Vidal-Puig A. An adipocentric perspective on the development and progression of non-alcoholic fatty liver disease. Journal of hepatology 78, 1048-1062 (2023).
[2] Riazi, K., et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 7, 851-861 (2022).
[3] Gao, Y., et al. Effect of Long-Term Exercise on Liver Lipid Metabolism in Chinese Patients With NAFLD: A Systematic Review and Meta-Analysis. Frontiers in physiology 12, 748517 (2021).
[4] Chen M, Zhu J-Y, Mu W-J, Guo L. Cysteine dioxygenase type 1 (CDO1): Its functional role in physiological and pathophysiological processes. Genes & Diseases 10, 877-890 (2023).
[5] Guo YY, Li BY, Xiao G, Liu Y, Guo L, Tang QQ. Cdo1 promotes PPARγ-mediated adipose tissue lipolysis in male mice. Nature metabolism 4, 1352-1368 (2022).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#非酒精性脂肪肝# #肝脏I型半胱氨酸双加氧酶#
63