Cell Discov:汤楠/陈静瑜发现百草枯损伤肺上皮再生程序
2023-09-28 iNature iNature 发表于上海
该研究分析了一名摄入百草枯的18岁女性患者的肺实质样本,该患者在中毒后第34天接受了双肺移植。研究发现在百草枯损伤的人肺中,出现了上皮祖细胞的异常分化并伴随着缺氧微环境。
百草枯是一种有毒的除草剂,可引起严重的肺损伤,导致肺泡上皮细胞死亡,随后的肺纤维化和呼吸衰竭。了解百草枯损伤后的修复过程对于制定治疗百草枯中毒患者的潜在治疗策略至关重要。然而,百草枯在损伤肺中的修复程序目前尚不清楚。
2023年9月26日,NIBS/清华大学汤楠及浙江大学/南京医科大学陈静瑜共同通讯在Cell Discovery在线发表题为“Aberrant differentiation of epithelial progenitors is accompanied by a hypoxic microenvironment in the paraquat-injured human lung”的研究论文,该研究分析了一名摄入百草枯的18岁女性患者的肺实质样本,该患者在中毒后第34天接受了双肺移植。研究发现在百草枯损伤的人肺中,出现了上皮祖细胞的异常分化并伴随着缺氧微环境。

组织学分析显示,百草枯毒性严重破坏了肺泡结构。在百草枯损伤的肺中,PDPN+肺泡1型(AT1)上皮细胞缺失,而proSPC+肺泡2型(AT2)上皮细胞显著减少。相反,这些区域充满α-SMA+肌成纤维细胞。存活的proSPC+ AT2细胞主要聚集在百草破损伤肺的周围,少数分散在远端气道周围。为了研究严重损伤肺的修复程序,作者进行了单细胞RNA测序(scRNA-seq)分析。共获得了19,171个转录组的全面收集,这些转录组被注释为四种广泛的细胞类型组:EPCAM+上皮细胞(n = 4120), DCN+基质细胞(n = 2491), PTPRC+免疫细胞(n = 10,431)和CDH5+内皮细胞(n = 2129)。基于典型谱系标记和个体细胞类型的不同分子特征,在百草枯损伤的肺中共鉴定出45种细胞类型/状态。
EPCAM+上皮细胞的无偏聚类分析揭示了十个不同的亚群。与免疫染色结果一致,没有PDPN+ AT1细胞群,表明百草枯损伤肺中完全失去了气体交换单位。这10个亚群包括SFTPC+ AT2细胞和气道上皮细胞的9个亚群,后者包括7种经典定义的细胞类型(基底细胞、MUC5AChigh杯状细胞、SAAhigh杯状细胞、scgb1a11low杯状细胞、棒状细胞、纤毛细胞和肺神经内分泌细胞)和两种中间状态(分化基底细胞和分化棒状细胞)。分化的基底细胞同时表达基底细胞标记物(KRT5和KRT15)和杯状细胞标记物(SERPINB3、SERPINB4和CLCA2) ,表明它们是杯状细胞的祖细胞。新鉴定的分化俱乐部细胞表达俱乐部细胞(SCGB3A2和SCGB1A1)和杯状细胞(MUC5B)的标记物。鉴于杯状细胞被认为是终末分化的细胞类型,正在分化的俱乐部细胞可能代表俱乐部细胞向杯状细胞分化的中间阶段。
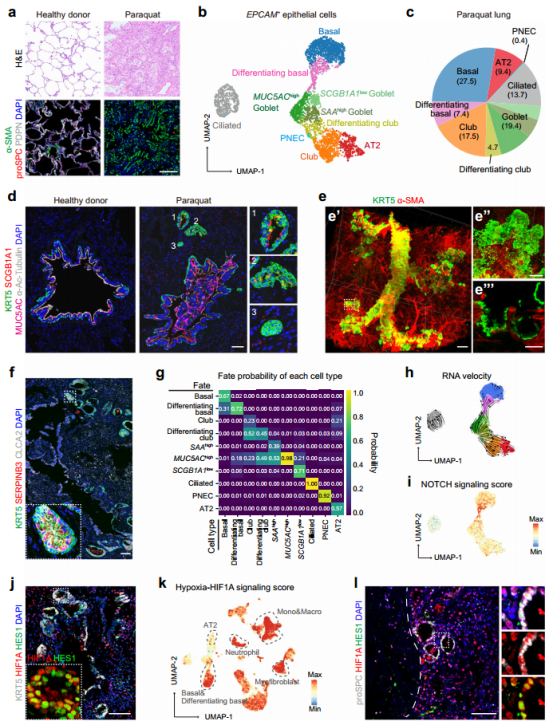
百草枯损伤的人肺异常上皮修复程序(图源自Cell Discovery)
在健康供肺中,EPCAM+上皮细胞包括肺泡上皮细胞(AT1和AT2细胞)和气道上皮细胞,肺泡上皮细胞占EPCAM+细胞总数的40%以上。然而,在百草枯损伤的肺中,肺泡上皮细胞(AT2细胞群)的比例显著下降至9.4%,而气道上皮细胞的比例则增加到90.6%。具体而言,气道干/祖细胞的比例,包括基底细胞(27.4%)、俱乐部细胞(17.5%)、分化基底细胞(7.4%)和分化俱乐部细胞(4.7%),显著增加。这些发现表明,百草枯损伤的肺经历了积极的气道修复程序,但肺泡修复程序不充分。
研究分析显示,基底细胞具有更高的分化基底细胞的倾向。俱乐部细胞可以通过分化的俱乐部细胞分化为杯状细胞,这支持了俱乐部细胞分化为杯状细胞的中间阶段的观点。先前利用小鼠肺损伤模型的研究表明,气道祖细胞可以分化为AT2和AT1细胞。然而,分析显示,在百草枯损伤的肺中,基底细胞、分化的基底细胞和俱乐部细胞分化为AT2细胞的概率有限。相反,在百草枯损伤的肺中,AT2细胞表现出更高的分化为俱乐部细胞的倾向。综上所述,这些结果表明,副损伤肺中的AT2细胞和气道干/祖细胞再生肺泡上皮的能力显著降低,最终导致气体交换单位的不可逆转损失。
该研究通过实验证明,百草枯损伤肺上皮再生程序。百草枯中毒后大量细胞死亡,导致免疫细胞显著浸润,气体交换单元丧失,肺纤维化,导致肺组织广泛缺氧微环境。这种微环境可能通过激活NOTCH信号和破坏气道和肺泡干细胞/祖细胞的分化来促进异常修复程序,从而加剧肺组织损伤。该研究结果表明,肺移植可能是严重百草枯中毒患者唯一可行的治疗方法。重要的是,作者研究强调了适当的微环境在再生功能肺泡单位中的关键作用,这取决于新形成的AT1细胞的分化。由于缺氧是严重肺部疾病的共同特征,未来针对缺氧肺微环境的治疗策略,如减少缺氧或抑制NOTCH信号,可能有望治疗严重肺损伤。
原文链接:
https://www.nature.com/articles/s41421-023-00598-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言