尤启冬/王磊:2022 年首创性小分子药物研究实例浅析
2023-03-01 精准药物 网络 发表于上海
首创性药物研究仍是我国新药创制的主要方向,需要在基础科学研究和制药核心技术上获得更多原创性的突破。
2022年首创性小分子药物研究实例浅析

来源

《药学学报》2023年(排版转自凡莫谷公众号)

作者

王磊,尤启冬
中国药科大学江苏省药物分子设计与成药性优化重点实验室
中国药科大学药学院药物化学系

摘要

2022年,是全球经历新冠疫情侵扰的第三个年头,其对药物研发的影响也逐渐显现。美国FDA药物评价和研究中心(CDER)在过去一年里共计批准了37款新药,相比2021年50款新药获批的历史峰值有了明显下降。首创性(first-in-class)药物仍是新药获批的主力军,本年度共计有21款,其中小分子的首创性药物有7款。今年新药获批的总数虽大幅下降,但其中不乏多款具有重要借鉴意义的首创性小分子药物,例如首款口服丙酮酸激酶(PK)激活剂米他匹伐(mitapivat),首个选择性心肌β肌球蛋白三磷酸腺苷(ATP)酶变构抑制剂玛伐凯泰(mavacamten),首个靶向TYK2(酪氨酸激酶2)的氘代变构抑制剂氘可来昔替尼(deucravacitinib),首个靶向HIV衣壳的长效抑制剂来那帕韦(lenacapavir)等。首创性药物的研究需要聚焦临床难点问题,通过全新的作用靶标和生物机制实现对特定疾病的治疗效果。在生物机制研究、靶标选择、分子筛选、先导物确定、成药性优化等多方面研究过程中均存在巨大挑战,成功的首创性药物研发过程具有重要的学习和借鉴意义。本文通过浅析本年度3个首创性小分子药物的研发背景、研发过程和治疗应用,以期为更多的首创性药物提供研究思路与方法。

关键词

首创性药物;新药创制;小分子药物
|
正文 |
新冠病毒的肆虐,对新药研发人员不仅是一场严峻的考验,也是一次痛彻心扉的思考过程。虽然科技的进步与药物研发的积累使得人类面对疾病挑战时已有一些招架之力,但在自然和生命面前,仍有太多的空白和未知等待研究者去学习与探索。面对新冠疫情,接种疫苗可以高效地建立免疫屏障并大幅降低重症率,但随着病毒的不断变异,多数疫苗和中和抗体的效力也在不断下降。在这种情况下,小分子抗病毒疗法又表现出重要意义。目前,辉瑞公司的主蛋白酶抑制剂Paxlovid[主要成分为奈玛特韦(nirmatrelvir)和利托那韦(ritonavir)]通过FDA的紧急使用授权,成为了重要的小分子治疗药物。Paxlovid可以在早期抑制病毒的复制,减少轻度或中度患者进展为重症[1]。其中,奈玛特韦是2002年辉瑞公司针对SARS疫情暴发而设计的SARS-CoV-1主蛋白酶抑制剂的结构优化产物。由于SARS-CoV-1和SARS-CoV-2(COVID-19)的主蛋白酶底物结合位点具有100%的序列同源性,以及SARS-CoV-2主蛋白酶在病毒复制中的关键作用,设计针对性的SARS-CoV-2主蛋白酶抑制剂成为研究热点。在强大的药物设计团队与多年的分子优化的经验积累下,辉瑞公司以SARS-CoV-1主蛋白酶抑制剂PF-00835231为基础,开展基于结构的分子设计,快速并高效地获得了奈玛特韦,其对所有已知可感染人类的冠状病毒的主蛋白酶均具有较强的体外抑制活性,而对哺乳动物的半胱氨酸、丝氨酸和天冬氨酸蛋白酶没有明显抑制活性。此轮结构优化大幅提高了奈玛特韦抗SARS-CoV-2病毒活性、透膜性、代谢稳定性和口服生物利用度。CYP3A4是奈玛特韦的主要代谢酶,为进一步增强药效,通过使用CYP3A4的强效抑制剂利托那韦作为药代动力学增强剂,最终奈玛特韦和利托那韦以药物联用的方式组合成为Paxlovid[2, 3]。从以上研究可以看到,新药研发是一项耗时长、投入大、风险高的创造性工作,需要大量的基础研究和技术积累。全新的药物设计从来不会一蹴而就,而是需要日积月累的沉淀与思考。同时,新药研发从立项或第一项专利申请开始,也是一场与时间的赛跑。因此,如何更高效地进行药物分子设计,是一个值得不断积累、思考并试错的挑战性工作。
目前,通常将新药创制的类型划分为首创性药物(first-in-class)和跟随性药物(me-too, me-better),二者都具有重要的意义[4]。首创性药物的研究是生物学驱动的,需要全新的作用机制、药物靶标和新药分子,往往需要大量的基础研究作为铺垫,不断探索生物新机制与疾病之间的关联,从中找到药物设计的突破口。为避免在热门靶点上的无谓消耗和重复研究,首创性药物得到国家政策的鼓励,并受到制药企业和科研院所的追捧。首创性药物的研究意义和基本流程在作者前期的文章中已有所述及[5-8],一方面要充分学习成功药物分子的研发经验;另一方面也应不断探索高效药物设计的方法。
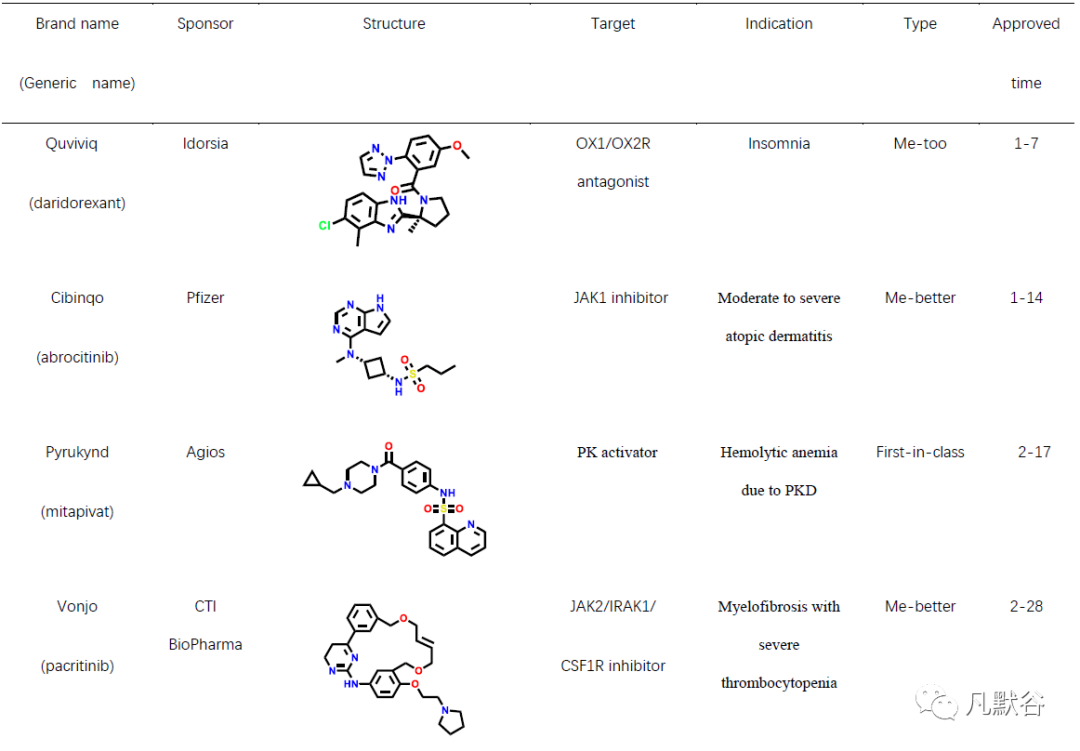
2022年,美国FDA药物评价和研究中心(Center for Drug Evaluation and Research, CDER)共批准上市新药37款,包括22款新分子实体和15款生物药物。此外还批准上市了2款疫苗、1款细胞疗法、4款基因疗法及1款微生物组疗法。相比2021年的50款新药获批,今年的新药总数大幅度下降。从获批新药的适应症分布可以发现,抗肿瘤药物仍占比最高(10款,占比27%),其次是神经系统类疾病(6款,占比16%)和皮肤类疾病药物(5款,占比14%)。从获批新药的评审特点上可以发现,2022年获批的新药分子中有13个新药获得了“优先评审”资格,5个新药获得了加速审批上市资格。本年度获批新药分子中孤儿药仍有较高的占比(49%),获批18款,连续多年占据了获批总数的半数以上[9],另外还有13款药物获得了突破性疗法认证。2022年共有21款首创性药物获批,占比57%,为历年最高,其中的10款药物获得了突破性疗法认定。今年,21个首创性药物中包括7个首创性小分子药物(表1)。
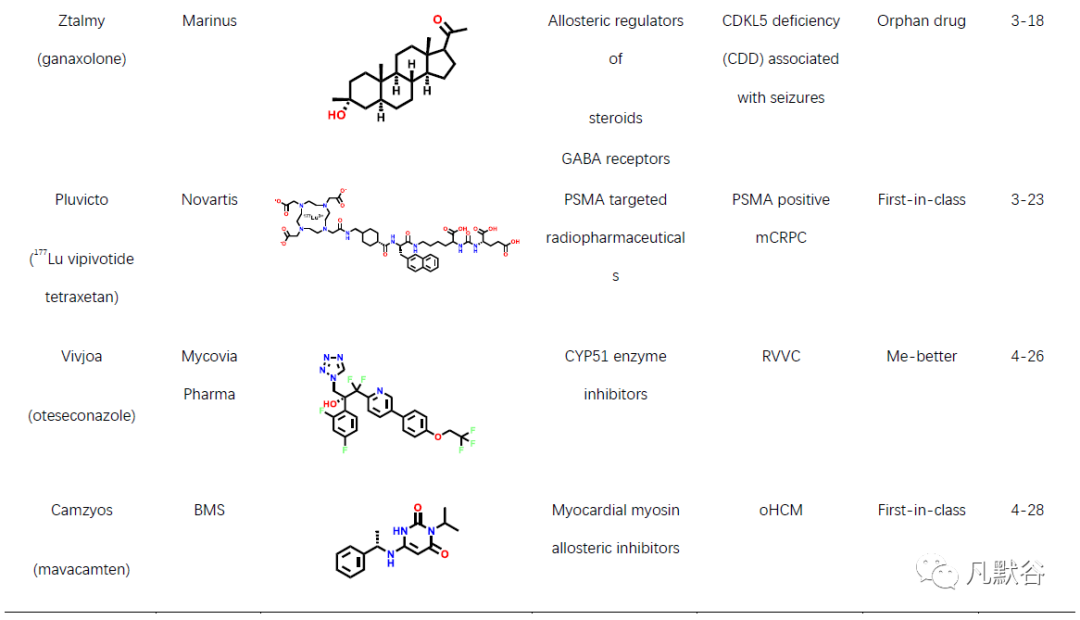
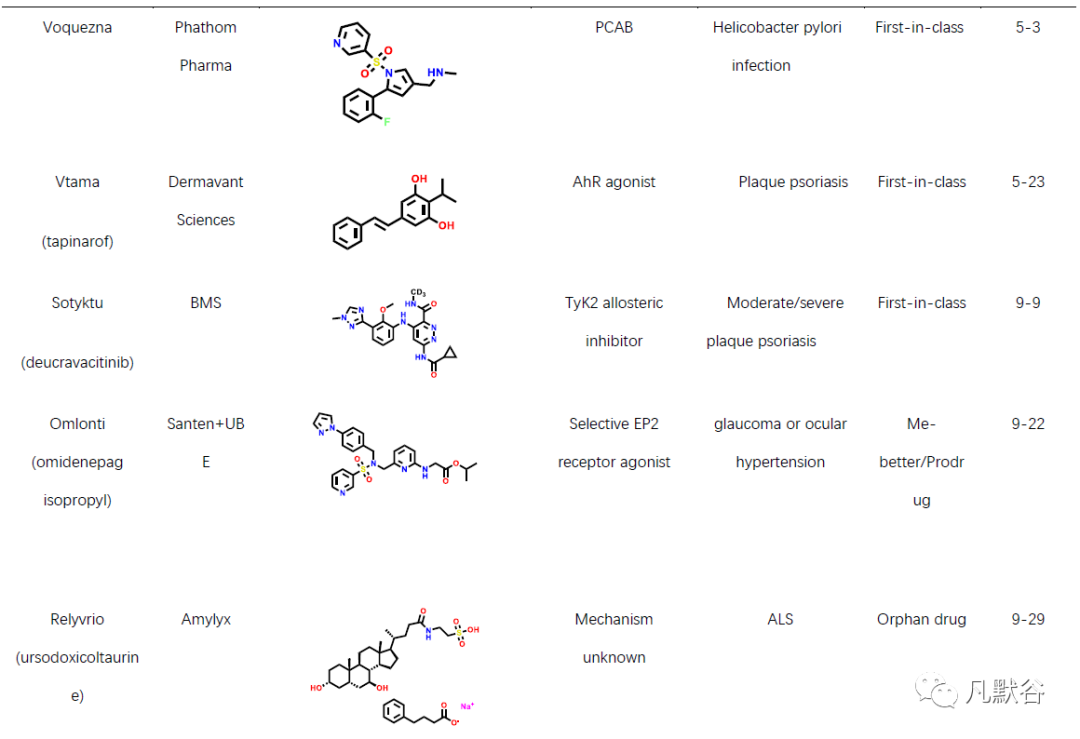
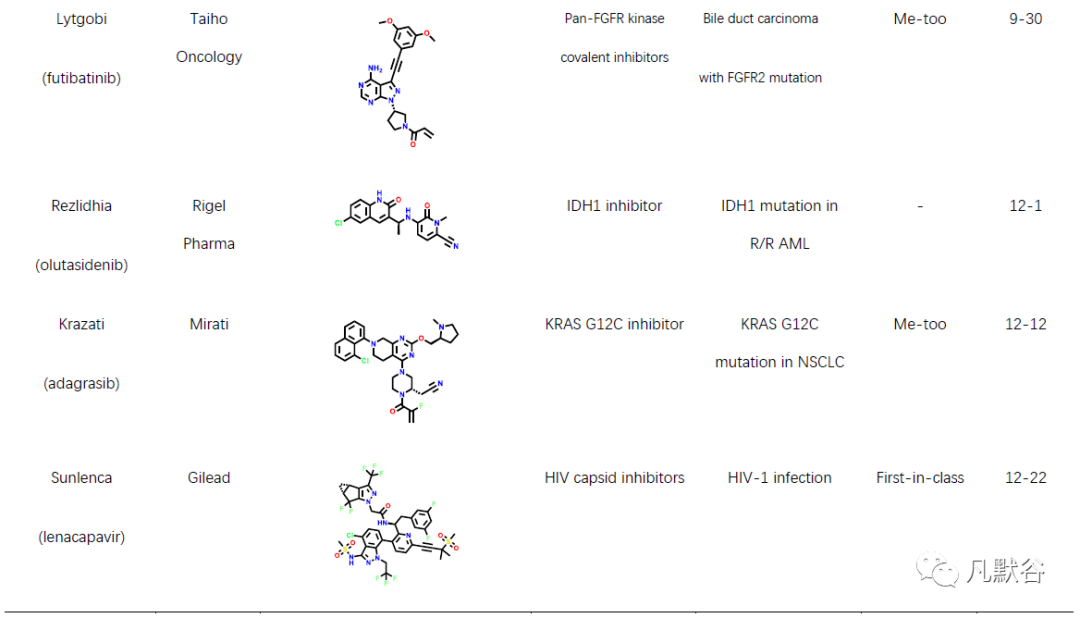
虽然本年度新药获批总数大不如前,但不乏多款重磅新药分子,例如首款获批的T细胞受体(TCR)疗法kimmtrak,用于治疗不可切除或转移性葡萄膜黑色素瘤;首个国产CAR-T细胞疗法carvykti,用于治疗复发/难治性多发性骨髓瘤;首款新型葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂mounjaro,用于辅助饮食和运动,改善成人Ⅱ型糖尿病患者的血糖控制;首个治疗性芳香烃受体调节剂(TAMA)他匹那罗(tapinarof),用于局部治疗成人斑块型银屑病;首个TYK2变构抑制剂氘可来昔替尼(deucravacitinib),用于治疗斑块状银屑病;首个治疗百年顽疾的复方制剂新疗法relyvrio,用于治疗肌萎缩侧索硬化;首款BCMA/CD3双抗特立妥单抗(teclistamab),用于治疗复发或难治性多发性骨髓瘤;首个获批治疗B型血友病的基因疗法地艾可基(etranacogene dezaparvovec),其每剂的价格高达350万美元,也成为全球最贵药物;首个粪便微生物组疗法rebyota,用于治疗艰难梭菌感染;首个CD20/CD3双抗mosunetuzumab-axgb,用于治疗复发或难治性滤泡性淋巴瘤患者。以上药物均通过全新的作用机制实现了对多种难治疾病的治疗目的,在多种疾病上实现了“首次”的突破,为无药可用的患者提供了新希望。很多首创性药物分子的研究过程,也为后续的药物研发提供了广阔的思路与研究借鉴。
本文选取米他匹伐(mitapivat)、玛伐凯泰(mavacamten)和氘可来昔替尼(deucravacitinib)3个具有代表性的首创性小分子药物,通过药物化学视角阐述其研发背景、药物设计思路及治疗学应用,以期为更多的首创性小分子药物设计提供思路与帮助。
1
米他匹伐(mitapivat)
全球首款口服丙酮酸激酶(PK)变构激动剂用于治疗PK缺乏的成人溶血性贫血
1.1 研发背景
丙酮酸激酶缺乏症(PKD)是一种罕见的遗传性疾病,临床中较为少见,每100万人中约有3~9名患者,常被误诊或漏诊,导致其发病率难以确认。丙酮酸激酶的缺乏会导致红细胞受损的速度大于生成的速度,最终导致溶血性贫血。PKD患者往往伴随有疲劳、皮肤异常苍白、黄疸(皮肤和眼睛发黄)、呼吸短促和心率加快等严重的症状,部分患者还出现脾脏肿大、反复输血导致血液中铁含量过高、以及胆结石(胆囊或胆管中的小沉积物)等[10]。PKD也会导致生活质量问题,包括工作和学习活动、社会生活和情绪健康方面的挑战。当前的PKD治疗策略非常有限,主要包括红细胞输注和脾切除术,但均伴随着较大的生物风险。
生物机制研究表明,PKD患者中红细胞型丙酮酸激酶(PK-R)编码基因发生突变,导致PK酶活降低、三磷酸腺苷(ATP)水平下降和上游代谢物的积累,最终使得红细胞寿命缩短并导致慢性溶血[11]。因此,通过全新的作用机制实现PK的激活成为潜在的药物设计策略。
1.2 研发过程
PKD诱发各类疾病的根源在于丙酮酸激酶的功能受到抑制,多数为基因突变所致。目前发现了4种丙酮酸激酶亚型,但大多数组织的表达源自PK基因的两种亚型之一(PK1和PK2)。PK2的基因突变会导致其酶活性大幅下降,进而诱发红细胞受损(图1A)。2012年,来自Agios Pharmaceuticals公司的研发人员报道了一类化学结构与作用机制全新的PK2激动剂,与内源性激动剂1, 6-双磷酸(FBP)具有完全不同的结合位点[12]。进一步的结构生物学证据表明,此类分子与内源性激动剂FBP结合于不同的分子位点,通过稳定PK2的四元复合物构象而增加PK受体与底物的亲和力,产生较好的PK的激活效应(图1B)。
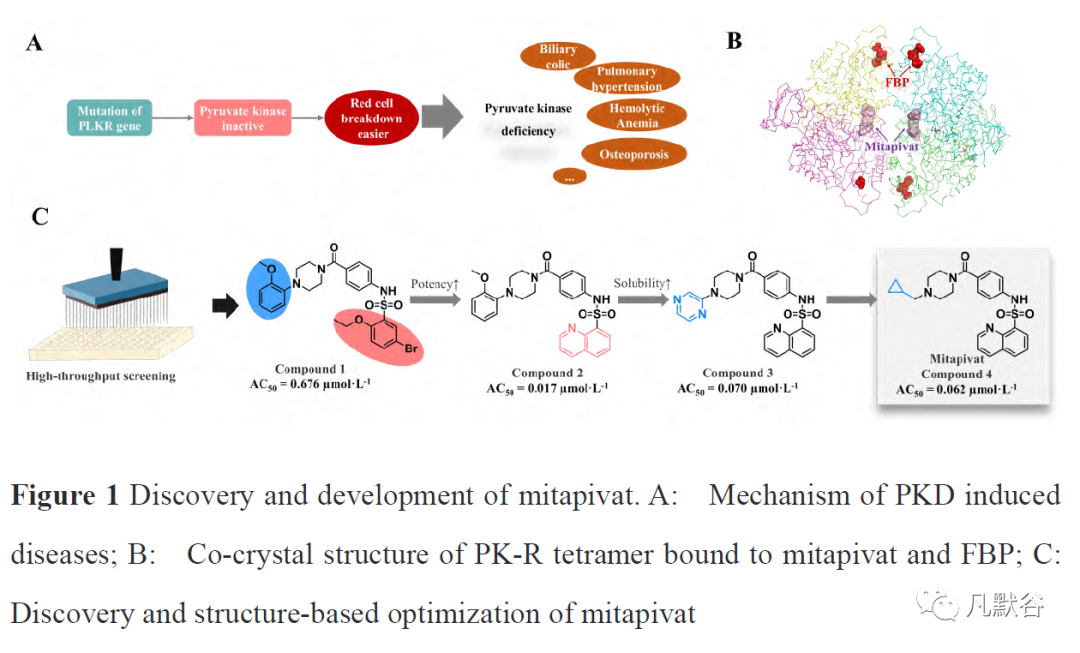
研发早期,研究人员通过高通量筛选得到了苗头化合物compound 1(AC50=0.676 μmol·L-1),机制研究表明compound 1通过变构激动的方式增强PK2与其底物磷酸烯醇丙酮酸(PEP)的亲和力。接下来使用非极性平面结构的喹啉环替换compound 1的4-溴乙氧基苯得到的化合物compound 2活性有较大幅度的提升(AC50=0.017 μmol·L-1)。然而,compound 2的溶解度较差,难以开展进一步的共晶复合物实验确认其变构结合位点,因而下一步的研究目标是继续进行结构优化并提高化合物的溶解度。随后合成了多个此系列化合物衍生物,得到的compound 3水溶性有了大幅提高,并应用于共晶复合物实验得到了此类化合物变构激动位点的直接证据(图1C)。最终,通过基于结构的药物设计与优化得到了成药性质最优的化合物compound 4(mitapivat),其激动活性为AC50为0.062 μmol·L-1,并在患者的红细胞中表现出了优异的PK激动效应,随后获批进入临床研究[13]。米他匹伐的研发首次发现了PK的变构激动位点,并基于此位点的空腔特点开展了针对性的构效关系研究与成药性优化,是一类经典的药物发现案例。
1.3 治疗应用
米他匹伐是全球第一个获批的PK小分子变构激动剂,可显著改善溶血和贫血,降低患者输血负担,其审批过程也获得了优先审查并被授予孤儿药资格。米他匹伐的有效性在两项临床研究中进行了评估,一项是随机、双盲、安慰剂对照的临床研究,研究对象为80例未接受常规输血的成年PKD患者。另一项是单臂研究,研究对象为27例接受定期输血的成年PKD患者。结果表明,米他匹伐治疗组有40%的患者实现了血红蛋白缓解(定义为血红蛋白从基线水平持续增加≥1.5g·dL-1)。对于定期输血的患者,米他匹伐显示出具有统计学意义和临床意义的输血负担降低。在安全性方面,米他匹伐的突然停药可能会导致红细胞的加速破坏,使用时应额外注意。米他匹伐为PKD患者提供了更有效、更方便的治疗选择,其独特、新颖的作用机制也为后续的药物设计提供了宝贵的研究思路与借鉴。
文章内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明【来源:凡默谷公众号】。
2
玛伐凯泰(mavacamten)
2.1 研发背景
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是心内科较为常见的常染色体显性遗传性心肌疾病,发病率约为0.2%。美国指南为狭义性肥厚型心肌病,即肌小节突变所致的遗传性心肌病。而欧洲指南为广义性肥厚型心肌病,除了高血压、主动脉瓣狭窄、主动脉瓣上及瓣下狭窄等负荷增高因素外,其余均诊断为肥厚型心肌病。部分年轻的HCM患者多表现为无症状,但在多种不确定的情况下可能会诱发猝死,HCM也成为了年轻人和运动员猝死的常见原因之一[14]。
从发病机制上看,HCM的诱发原因为心肌肌球蛋白的基因突变,进而引起肌球蛋白与肌动蛋白收缩时间延长,加强了肌节收缩。组织病理学上表现为心肌细胞增大、排序紊乱和纤维化程度增高,这些因素在HCM的早期会导致心肌细胞收缩功能增强,在后期则会诱发心肌舒张功能的损伤。目前,推荐的药物治疗主要包括β受体阻滞剂及非二氢吡啶类钙通道阻滞剂,如果以上的一线药物治疗无效,则可采用抗心律失常药物丙吡胺[15]。然而,30多年来一直没有出现针对HCM更加有效的治疗方案。由此可见,寻找首创性的药物分子来调控心肌收缩蛋白的功能,降低其收缩力有望在此领域实现源头突破。
2.2 研发过程
2016年,Science杂志发表了重磅研究论文,为玛伐凯泰(研发代号MYK-461)治疗HCM拉开了序幕,并首次提出了抑制肌节收缩蛋白的作用机制[16]。肌球蛋白需要ATP分解供能以维持正常心肌收缩,ATP分解供能的异常则会导致心肌收缩异常,最终诱发HCM(图2A)。玛伐凯泰可以特异性抑制肌球蛋白MYH7突变而导致的ATP酶过度激活,可逆地抑制心肌肌球蛋白与肌动蛋白的偶联反应,减少横桥周期。同时,玛伐凯泰还能降低心肌肌球蛋白的钙离子敏感性从而降低心肌收缩力(图2B),并稳定β肌球蛋白的松弛状态(relaxed-state)。在早期的基础实验中,研究人员首先使用了基于表型的高通量筛选方法,得到了一些能够降低心肌收缩力的化合物。进一步的研究表明MYK-461可以通过降低心肌肌球蛋白重链的ATP酶活性来降低心肌收缩力,这是一种全新的作用机制。MYK-461在动物实验中也可以实现对HCM突变小鼠的心肌肥厚、心肌细胞紊乱和纤维化的治疗效果,并降低HCM小鼠的肥厚及促纤维化相关基因表达(图2C)。
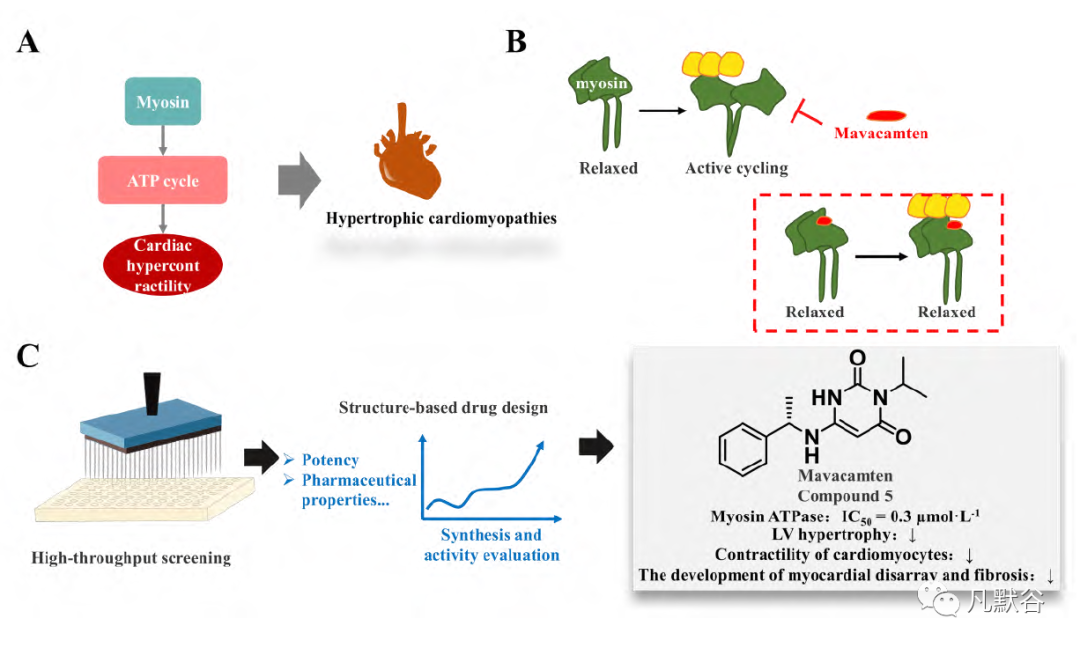
Figure 2 Discovery and development of mavacamten. A: Mechanism of myosin-ATP cycle related HCM; B: Chemo-mechanical cycle of myosin; C: Discovery and identification of mavacamten
这些实验结果都表明抑制肌节收缩蛋白与HCM的治疗有潜在的因果性[17]。在已报道的数据中,只能看到玛伐凯泰研究的最终结果,但其背后的筛选、验证、优化过程想必也历经磨难。玛伐凯泰的研发过程是一种经典的从表型筛选到机制验证的药物发现思路,其最终的成功上市是生物学驱动的研究结果。研究人员利用玛伐凯泰,发现并验证了抑制肌节收缩蛋白与HCM治疗的因果关联,为后续更多的HCM治疗药物提供了重要的研究思路。
2.3 治疗应用
玛伐凯泰的开发主要集中于3个可能的适应症上:阻塞性HCM、非阻塞性HCM及某些特定射血分数保留的心力衰竭(heart failure with preserved ejection fraction, HFpEF)患者。此次FDA批准的是临床试验NCT03470545的结果,该试验招募了251名梗阻性HCM成人患者[18]。结果表明有37%的患者在测量运动能力和症状的复合终点上有所改善。但玛伐凯泰在安全性方面表现并不优异,带有与收缩功能障碍导致的心力衰竭风险相关的黑框警告,在治疗过程中受到诸多限制[19]。因此,玛伐凯泰为HCM患者提供了额外的治疗选择,但应用范围有限,仅被批准用于左心室收缩功能正常的症状性梗阻性肥厚型心肌病患者。即便如此,玛伐凯泰通过降低心肌肌球蛋白重链的ATP酶活性来降低心肌收缩力的全新作用机制为此类疾病的药物设计提供了更多思路与研究借鉴。
3
氘可来昔替尼(deucravacitinib)
3.1 研发背景
银屑病是一种常见的慢性炎症性皮肤病,临床表现以红斑、鳞屑为主,全身均可发病,以头皮、四肢伸侧较为常见,发病率约为0.5%。高达90%的银屑病患者为斑块状银屑病,其特征是界限清楚的圆形或椭圆形斑块,表面通常覆有银白色鳞屑。近1/4银屑病患者的疾病严重程度为中度至重度,通常面临着头皮、肘部、背部等皮肤的严重瘙痒和疼痛,甚至可能导致部分关节受累,发展成关节炎,对患者的身心健康造成极大影响,成为困扰人民生命健康的难点疾病之一。
大量研究证明,银屑病是免疫介导的炎症性皮肤病,其发病与炎症细胞浸润和炎症因子有关。Janus激酶家族(JAK1、JAK2、JAK3和TYK2)是与细胞因子受体的胞内部分结合的非受体酪氨酸激酶,在多种引起炎症的细胞因子的信号传导方面至关重要。因此,JAK激酶的小分子抑制剂有望成为各种严重炎症和自身免疫性疾病的有效治疗方法。然而,由于ATP位点在此家族中的高度同源性,很难设计小分子实现对各个亚型的高选择性抑制[20]。临床上应用的JAK抑制剂多因缺乏选择性而表现出较差的治疗效果和明显的不良反应。其中,JAK1/2抑制剂巴瑞替尼(baricitinib)和JAK1抑制剂乌帕替尼(upadacitinib)都有黑框警告,可能存在严重感染、恶性肿瘤和血栓形成的风险。已有的生物机制研究表明,相比于JAK1/2/3,选择性抑制TYK2可作为自身免疫性疾病的靶标[21]。因此,如何设计高选择性的TYK2小分子抑制剂成为了亟待解决的关键问题。
3.2 研发过程
TYK2是JAK家族的重要成员之一,也是一种通过介导IL-23、IL-12和I型干扰素(IFN)信号转导的细胞内信号激酶,其功能异常将促使角化细胞逐渐斑块化,最终导致银屑病(图3A)[22, 23]。TYK2/JAK位于银屑病发病机制的上游,抑制TYK2激酶活化,即可抑制由它介导的IFN和IL-12、IL-23启动的细胞信号通路以及免疫反应,包括髓样状细胞(DC)成熟并分泌IL-23与IL-12,以及Th17与Th1的分化和IL-17以及肿瘤坏死因子-α(TNF-α)、IFNγ的分泌,最终抑制银屑病皮损的出现。在过去的很多年里,JAK抑制剂的研发已经进行得如火如荼,多款重磅新药(托法替尼tofacitinib, 芦可替尼ruxolitinib, 巴瑞替尼baricitinib等)在多种恶性炎症和自身免疫性疾病的治疗中发挥着关键作用。在氘可来昔替尼获批之前,大部分的小分子抑制剂靶向催化域的ATP结合位点(JH1 domain),进而阻滞下游的磷酸化信号,缺乏对JAK家族亚型的选择性(图3B)。由于JAK家族的活性结构域同源性高,直接设计ATP活性位点抑制剂并实现对亚型蛋白的选择性抑制极具挑战。进一步的研究表明,选择性抑制TYK2有望克服现有JAK抑制剂的安全性缺陷,成为多种自身免疫性疾病的治疗新选择[24]。

Figure 3 Discovery and development of deucravacitinib. A: Signal mechanism of TYK2 mediated plaque psoriasis; B: JAK family and its regulation domains; C: Highthroughput screening and structure-based optimization to obtain deucravacitinib
大量的前期研究表明,通过靶向JH1的激酶活性结构域实现对JAK家族的选择性十分困难。TYK2和JAK家族具有与JH1结构域相邻的无催化活性的假激酶结构域(JH2),而这成为了实现选择性的突破口。来自百时美施贵宝(BMS)的研发人员转变思路,使用高通量筛选获得了靶向于JH2的假激酶结构域的小分子,进而通过变构调控机制抑制TYK2的酶活及其下游信号通路(图3C)。在研究之初,通过高通量筛选获得了可以靶向于JH2域的泛抑制剂苗头化合物compound 6,其体外抑制活性高达0.46 nmol·L-1,但对JAK家族4个亚型的JH2结构域没有选择性,并在激酶谱筛选中表现出对其他85种激酶也有一定的抑制活性。为了提高选择性,研发人员开展了大量的基于结构药物设计与优化工作。幸运的是,通过酰胺甲基化后的化合物compound 7在活性保持(JH2: IC50=1.3 nmol·L-1)的基础上,选择性大幅提高,仅对4类激酶仍有抑制。对共晶结构的研究表明,选择性提高的原因是酰胺甲基与JH2结构域中Ala671发生疏水相互作用,而Ala671仅存在于9类激酶之中,因此表现出了选择性的提高。接下来,为了进一步提高化合物的抑制活性,研发人员使用甲磺酰基替换酰胺基团,得到的化合物compound 8可以与Arg738形成水分子介导的氢键,是潜在的极性结合位点。随后继续用极性杂环替换这一位点,得到的compound 9可以直接与Arg738形成稳定的氢键相互作用,使活性达到0.4nmol·L-1。但compound 9对hERG通道蛋白的IC50为31 μmol·L-1,可能会引起潜在的心脏毒性风险。设法减少分子中非必需的芳香环,进而减弱其与hERG通道蛋白的π-π堆积是常用的降低hERG通道蛋白活性的方法。基于此,研发人员在compound 9的结构基础上,用环丙基替换吡啶杂环,得到了对hERG通道蛋白活性大幅下降(IC50>80 μmol·L-1)的化合物compound 10。考虑到甲酰胺基团在体内的代谢稳定性差,易发生去甲基化,而此处的甲基又是保持激酶选择性的关键,因此研发人员使用氘代甲酰胺替换甲酰胺,利用同位素效应使得C-D键更加稳固,同时使用哒嗪替换吡啶母核,进一步提高了分子在体内的暴露量(Cmax=7.5 μmol·L-1),最终获得的compound 11(氘可来昔替尼,deucravacitinib)表现出最优的抑制活性、选择性、稳定性以及更长的半衰期和较少的去甲基代谢物。氘可来昔替尼的成功研发得益于针对全新作用机制的药物筛选过程,是生物学驱动的首创性药物研发的经典案例。其研究过程涉及靶点新位点选择、高通量筛选、构效关系研究与成药性优化,为后续的TYK2抑制剂及相关研究奠定了坚实基础。
3.3 治疗应用
氘可来昔替尼是一种首创的、口服有效的、选择性的TYK2变构抑制剂,也是目前全球唯一获批的TYK2小分子抑制剂药物,同样也是近10年来首个口服治疗中重度斑块型银屑病的创新药物。氘可来昔替尼与TYK2的JH2调节域结合,稳定酶的调节域和催化域之间的抑制性相互作用,从而抑制了TYK2及其下游信号转导和转录激活因子(STAT)的激活。临床试验结果表明,每日口服一次氘可来昔替尼可有效改善皮损清除。在临床试验的第60周,77.7%的患者的银屑病面积和严重程度指数改善至少75%,58.7%的患者在医生的全面评估中达到皮肤症状完全清除或几乎清除。同时,氘可来昔替尼表现出较好的安全性,不良反应为鼻咽炎、上呼吸道感染和头痛。
4
结语与展望
除了上述浅析的首创性小分子药物之外,本年度还有多款重磅的首创性药物及创新疗法。2022年1月26日,生物技术公司Immunocore获批了首款TCR-T疗法,用于治疗不可切除或转移性葡萄膜黑色素瘤。TCR-T与CAR-T疗法都是通过特异性修饰患者自身的T淋巴细胞,体外培养后重新将其回输到患者体内以杀死肿瘤细胞的方法,但其分子识别机制有所不同(CAR-T识别的靶抗原是细胞膜表面蛋白,而TCR-T可以靶向于MHC分子呈递的细胞内抗原片段)。2022年2月28日,南京传奇生物科技有限公司获批了首款国产CAR-T疗法carvykti(西达基奥仑赛),用于治疗成人复发/难治性多发性骨髓瘤,这也是国内第一款CAR-T细胞疗法获得FDA的批准上市。2022年5月25日,Dermavant Sciences公司获批上市了首款银屑病外用新药Vtama乳膏,这也是25年来FDA批准的首款非类固醇的外用新分子实体。2022年11月18日,Provention Bio公司获批了首款Ⅰ型糖尿病药物Tzield(替利珠单抗teplizumab),弥补了目前针对Ⅰ型糖尿病的研究空白,也是首款能延缓Ⅰ型糖尿病发作的药物。2022年12月1日,Rebiotix公司获批了首款粪便微生物组药物Rebyota(RBX2660),通过直肠给药,可以恢复患者肠道微生物群落,用于避免艰难梭菌感染的成人患者在接受抗生素治疗后的感染复发。从以上新药获批中可以看出,除了经典的小分子药物与单抗类药物外,越来越多的创新疗法、生物技术、组合疗法得以获批应用,新药创制的思路也在逐步开放,造福更多患者。
2022年,我国药品监督管理局(NMPA)共批准上市了49款新药,相比去年的76款新药有所下降,其中国产新药有19款,进口新药30款,包括27款小分子化学药、13款生物药、5款疫苗和4款中药。在国产新药中,多款自主研发的创新药实现了“首次”的突破,例如:康方生物科技有限公司的PD-1/CTLA-4双抗卡度尼利单抗(candonilimab)注射液是首款获批用于晚期宫颈癌的免疫治疗药物,也是全球首款获批的PD-1/CTLA-4双抗;华领医药的首创性降糖药多格列艾汀(dorzagliatin)是全球范围内首个获批上市的葡萄糖激酶启动剂(GKA)药物,也是过去近10年来糖尿病领域首个全新机制的原创新药,用于改善成人Ⅱ型糖尿病患者的血糖控制;恒瑞医药与璎黎药业合作研发的高选择性PI3Kδ抑制剂林普利塞(linperlisib)成为我国首个此靶点的高选择性抑制剂,用于治疗既往接受过至少两种系统性治疗的复发或难治(R/R)滤泡性淋巴瘤(FL)成人患者,其研发过程历时10余年。在国家政策、人才培养和资本投入等各方面的助力下,我国创新药也在一步一个脚印,向着更高、更远的方向迈进。其中,首创性药物研究仍是我国新药创制的主要方向,需要在基础科学研究和制药核心技术上获得更多原创性的突破。

作者贡献

王磊负责文章资料收集与撰写;尤启冬负责文章的选题与修改,为该文章的主要负责人。

参考文献

详见《药学学报》2023年
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言