国内申报上市的第二个CAR-T疗法获“优先审评+突破性药物”双重审评资格
2020-09-10 医谷网 医谷网
日前,据国家药监局药审中心最新公示,张江科学城企业药明巨诺的瑞基仑赛注射液(暂定名,研发代码为JWCAR029,通用名为“CD19靶向嵌合抗原受体T细胞”)上市申请拟被纳入优先
日前,据国家药监局药审中心最新公示,张江科学城企业药明巨诺的瑞基仑赛注射液(暂定名,研发代码为JWCAR029,通用名为“CD19靶向嵌合抗原受体T细胞”)上市申请拟被纳入优先审评,理由是“符合附条件批准的药品”,该药上市申请拟定适应症为治疗经过二线或以上全身性治疗后成人患者的复发或难治性大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤非特指型、滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤、3b级滤泡淋巴瘤、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤伴MYC和BCL-2和/或BCL-6重排(双打击/三打击淋巴瘤),不适用于治疗原发性中枢神经系统淋巴瘤。
另值得关注的是,JWCAR029还拟被纳入突破性治疗品种名单,由此,JWCAR029成为了国内首个同时获得拟优先审评和拟突破性药物品种的1类创新药。
根据此前国家药监局发布的《突破性治疗药物审评工作程序(试行)》文件,突破性治疗药物适用于药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,并要求在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请。
据了解,JWCAR029是在美国Juno公司JCAR017的基础上,由药明巨诺自主开发的CAR-T产品,有报道称,JWCAR029在在中国的工艺优化过程有一些商业化考虑,JCAR017原本在美国的工艺是将CD4和CD8细胞分离出来使用两条产品线生产,最后按照1:1比例混合回输到病人体内。而在中国,JWCAR029改良为提取CD4和CD8细胞后混合不做分离,在一条生产线上培养、生产后,再一起回输到病人体内。
2017年12月,药明巨诺通过明聚生物递交JWCAR029的IND申请(新药临床试验申请),于2018年6月获得临床批准。
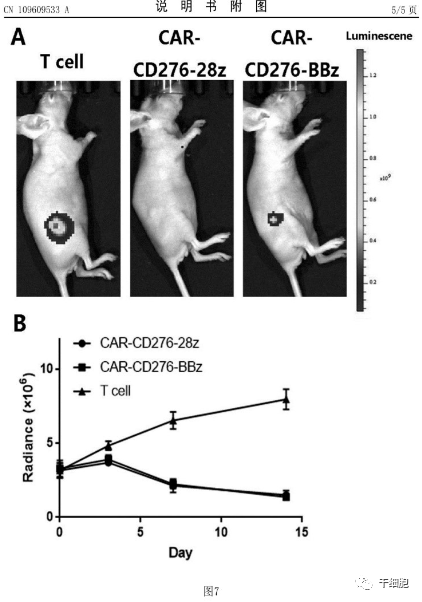
2019年12月,在第61届美国血液病学会(ASH)年会上,药明巨诺公布了JWCAR029治疗成人复发/难治B细胞非霍奇金淋巴瘤(R/R B-NHL)的I期临床试验数据,在入组的32个病人、4个爬坡剂量的I期研究中,JWCAR029显示了良好的安全性和有效性。对于预后较差的R/R侵袭性B-NHL患者,输注JWCAR029可获得优异且持久的缓解,6个月时所有患者(n=29)的ORR为58.6%,CR率为55.2%;对所有回输剂量的DLBCL患者:ORR为45%,CR率为45%。安全性方面,JWCAR029毒性可控,未发生CRS或NT相关性死亡,3/4级CRS或NT发生率低,约为6% (n=32)。
今年7月,药明巨诺像国家药监局递交了JWCAR029的上市申请,这是继复星凯特(同为张江科学城细胞治疗企业)申报的益基利仑赛注射液(国外商品名为Yescarta)之后,国内第二个递交上市申请的CAR-T疗法,不同于益基利仑赛已在国外上市,瑞基仑赛为全球首次申报上市。
伴随着产品上市进程的不断加快,药明巨诺也正式开启赴港上市之旅,其已正式向港交所提交了IPO申请书,其将拟募资2-3亿美元(约合人民币13.8-20.7亿元),用于产品研发、新潜在收购及引进授权机会、公司运营及一般公司用途,其中围绕JWCAR029的研发、未来中国市场的销售及其他候选产品的研发活动将是该公司重点布局方向。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#优先审评#
107
#申报#
82
#CAR-#
97
#突破性药物#
78