NEJM:FDA与EMA称肠促胰岛素类降糖药与胰腺炎及胰腺癌无关
2014-03-03 fyc5078 丁香园
美国大约有2580万糖尿病患者,欧盟有3300万糖尿病患者。美国FDA与欧洲药品管理局(EMA)正致力于确保上市糖尿病药物的安全性,在使用某些糖尿病药物的患者中所出现的胰腺炎和胰腺癌报道一直受到两家药品监管机构的关注。 两家机构联合审查了通过增强肠促胰岛素激素通路来刺激餐后胰岛素释放的降糖产品的非临床毒理学研究、临床试验数据及流行病学数据。 按照糖尿病的病理生理复杂性,几类降糖
美国大约有2580万糖尿病患者,欧盟有3300万糖尿病患者。美国FDA与欧洲药品管理局(EMA)正致力于确保上市糖尿病药物的安全性,在使用某些糖尿病药物的患者中所出现的胰腺炎和胰腺癌报道一直受到两家药品监管机构的关注。
两家机构联合审查了通过增强肠促胰岛素激素通路来刺激餐后胰岛素释放的降糖产品的非临床毒理学研究、临床试验数据及流行病学数据。
按照糖尿病的病理生理复杂性,几类降糖药(包含不同作用机制)已被开发用来治疗这种疾病。肠促胰岛素是小肠激素,可刺激胰腺在餐后产生胰岛素和胰高血糖素。
过去10年,肠促胰岛素受体激动剂或抑制肠促胰岛素蛋白质降解的药物已在FDA及EMA获得批准,它们的获批在某种程度上是基于确立的血糖控制改善有效性临床数据。收益-风险评估也考虑了临床优势,如药物的相关低血糖风险降低及可能的体重减轻。
过去几年,FDA和EMA独自对肠促胰岛素类药物用药患者中出现的胰腺炎及胰腺癌的安全性报道进行了全面的评价。现在已完成的研究包括对2013年一项研究报道的数据检查,该项报道揭示了一种可能的胰腺炎安全信号。
FDA与EMA致力于评价与报道不良事件有关的证据,以及任何能使安全性分析混淆的因素。虽然不成比例的自发性不良事件报道通常被看作是一种安全信号,但通过这些信号建立一种因果关系存在固有局限性。
FDA通过肠促胰岛素类药物用于上市申请的广泛非临床评价资料,对在1.8万健康动物中进行的250多项毒理学研究重新进行了评估。这些毒理学研究的显微镜检查未显示有明显的胰腺毒性作用或胰腺炎。
EMA对目前在欧盟获批上市的肠促胰岛素类药物的研究进行了类似的审查。此外,药物引起的胰腺肿瘤未在以肠促胰岛素类药物治疗2年的大鼠和小鼠身上发现,用药剂量甚至大大超过了人类临床试验用药水平。
这些毒理学数据的潜在局限性在于它只使用了健康动物。为解决这些问题,FDA要求上市的肠促胰岛素类药物的申请者以啮齿动物糖尿病模型进行周期为3个月的胰腺毒性研究。
这些研究包括广泛的内分泌和外分泌胰腺组织病理学评价,包括导管形态及组织化学染色揭示病理性增殖和凋亡的分析。有三项这样的研究已经完成并提交给FDA进行审查,未发现有与治疗相关的胰腺不良事件报道。
此外,其中一项研究的大约120多张胰腺组织病理学幻灯片受到了FDA病理学家的独立及盲法检查。FDA专家对这些幻灯片的结论与申请者的报道大体一致。
作为上市后胰腺不良事件报道评价的一部分,FDA还亲自对艾塞那肽进行了胰腺毒理学研究。每个啮齿动物糖尿病模型伴随一个非疾病对照模型,包括化学诱发胰腺炎的小鼠模型、Zucker糖尿病肥胖大鼠及高脂饮食的C57BL/6小鼠。
胰腺炎小鼠和糖尿病大鼠模型研究数据未证实艾塞那肽存在相关胰腺损伤。高脂饮食小鼠中,使用艾塞那肽治疗12周后,发现有轻度到中度恶化的背景性结果。小鼠模型并未被确定是一种药物诱发的胰腺响应模型,但它值得进一步调查。
FDA审查的临床安全性数据包括200多项临床试验数据,涉及大约4.1万名受试者,其中2.8万名妇女使用了一种肠促胰岛素类药物。1.5万名受试者使用这类药物长达24周或更长时间,8500名受试者用药52周或更长时间。
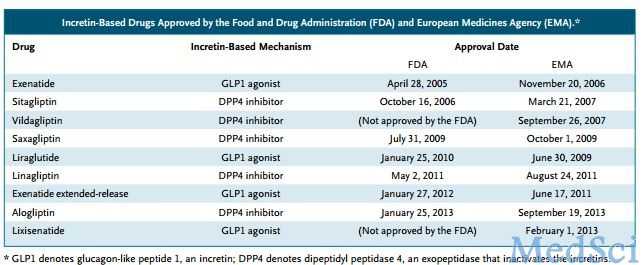
EMA进行了类似的审查,包括获批肠促胰岛素类药物在欧盟进行的所有研究。在上市前的临床试验中,胰腺炎的发生率稍有差别,尽管不良事件总数较小。西格列汀数据库中,25项临床试验的14611名2型糖尿病患者数据的一项汇集分析未能提供一种令人信服的胰腺炎或胰腺癌风险增加的证据。
在以肠促胰岛素类药物治疗的2型糖尿病患者中进行的两项心血管结局试验已经完成,它们是沙格列汀血管结局记录评价(SAVOR)试验和阿格列汀对比标准护理的心血管结局审查(EXAMINE)试验。SAVOR试验是一项有16492名患者参与的随机、双盲、安慰剂对照试验。EXAMINE试验是一项有5380名患者参与的随机、双盲、安慰剂对照试验。
SAVOR和EXAMINE试验中急性胰腺炎的报告率较低,用药组和安慰剂组的事件发生率相似。SAVOR试验中,用药组和安慰剂组胰腺癌的报告率的分别为5例和12例,EXAMINE试验中两组均未有胰腺癌病例发生。
FDA和EMA也独立审查了大量观察性研究,以探索肠促胰岛素类药物与急性胰腺炎之间的联系。队列和巢式病例对照研究应用各种大型行政索赔数据库得出了不一致的结果。这些研究不同程度的存在方法学上的缺陷。
这样,FDA和EMA已经探索了多种与肠促胰岛素类药物胰腺安全信号有关的的数据流。两家机构一致认为科学文献及媒体最近表达的有关肠促胰岛素类药物与胰腺炎或胰腺癌之间因果关系的断言与目前的数据是矛盾的。这次,FDA和EMA尚未就这种因果关系达成最终结论。
尽管已被审查的全部数据再次提供了保证,但胰腺炎会继续被认为与这类药物有关,除非有更多可供使用的数据。两家机构将继续调查这方面的安全性信息。
FDA和EMA认为目前的知识在产品信息或标签中已得到充分体现。正在进行的策略包括,对来自心血管结局试验及正在进行的临床试验的胰腺炎及胰腺癌数据进行系统性地捕获,临床试验应促进荟萃分析及未来有关这种安全信号知识的进一步积累。
原始出处:
Amy G. Egan, M.D., M.P.H., Eberhard Blind, M.D., Ph.D., Kristina Dunder, M.D., Pieter A. de Graeff, M.D., B. Timothy Hummer, Ph.D., Todd Bourcier, Ph.D., and Curtis Rosebraugh, M.D., M.P.H.Pancreatic Safety of Incretin-Based Drugs — FDA and EMA Assessment.N Engl J Med 2014; 370:794-797February 27, 2014DOI: 10.1056/NEJMp1314078
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#胰岛#
57
只能说二者关系应该是极小,风险极小,不必过于担心而已。
137
#降糖药#
75
#EMA#
76
#肠促胰岛素#
79
.......
158
胰岛素,降糖药,胰腺炎,胰腺癌。。。。。。嗷
125
这个得好好研究哟!
121