阿斯利康旗下的Saphnelo获得欧盟批准用于系统性红斑狼疮
2022-02-17 Allan MedSci原创
阿斯利康本周三宣布,欧盟委员会批准 Saphnelo (anifrolumab) 作为治疗中重度活性自身抗体阳性系统性红斑狼疮 (SLE) 成人患者的附加疗法。
阿斯利康本周三宣布,欧盟委员会批准 Saphnelo (anifrolumab) 作为治疗中重度活性自身抗体阳性系统性红斑狼疮 (SLE) 成人患者的附加疗法。阿斯利康生物制药研发执行副总裁 Mene Pangalos 表示:“Saphnelo 是十多年来在欧洲获得批准的第一个SLE新药”。
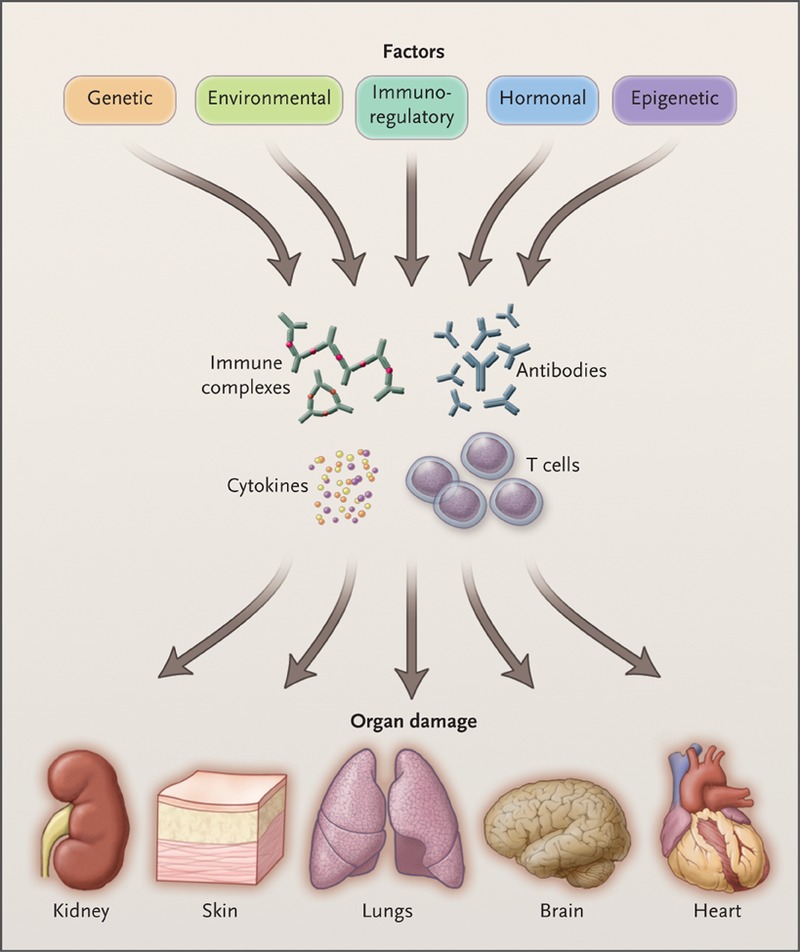
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种系统性自身免疫病,以全身多系统多脏器受累、反复的复发与缓解、体内存在大量自身抗体为主要临床特点,如不及时治疗,会造成受累脏器的不可逆损害,最终导致患者死亡。SLE的病因复杂,与遗传、性激素、环境(如病毒与细菌感染)等多种因素有关。
Saphnelo (anifrolumab) 是一种 I 型干扰素受体抗体,最近在美国、日本和加拿大被批准用于治疗 SLE。欧洲的批准得到了 III 期 TULIP-1 和 -2 研究以及中期 MUSE 试验的支持,这些试验研究了静脉注射Saphnelo (anifrolumab) 治疗中重度 SLE 患者的有效性和安全性。在 TULIP-2 研究中,该药物在多个疗效终点方面均表现出优于安慰剂的优势,但 TULIP-1 未能达到其主要终点。
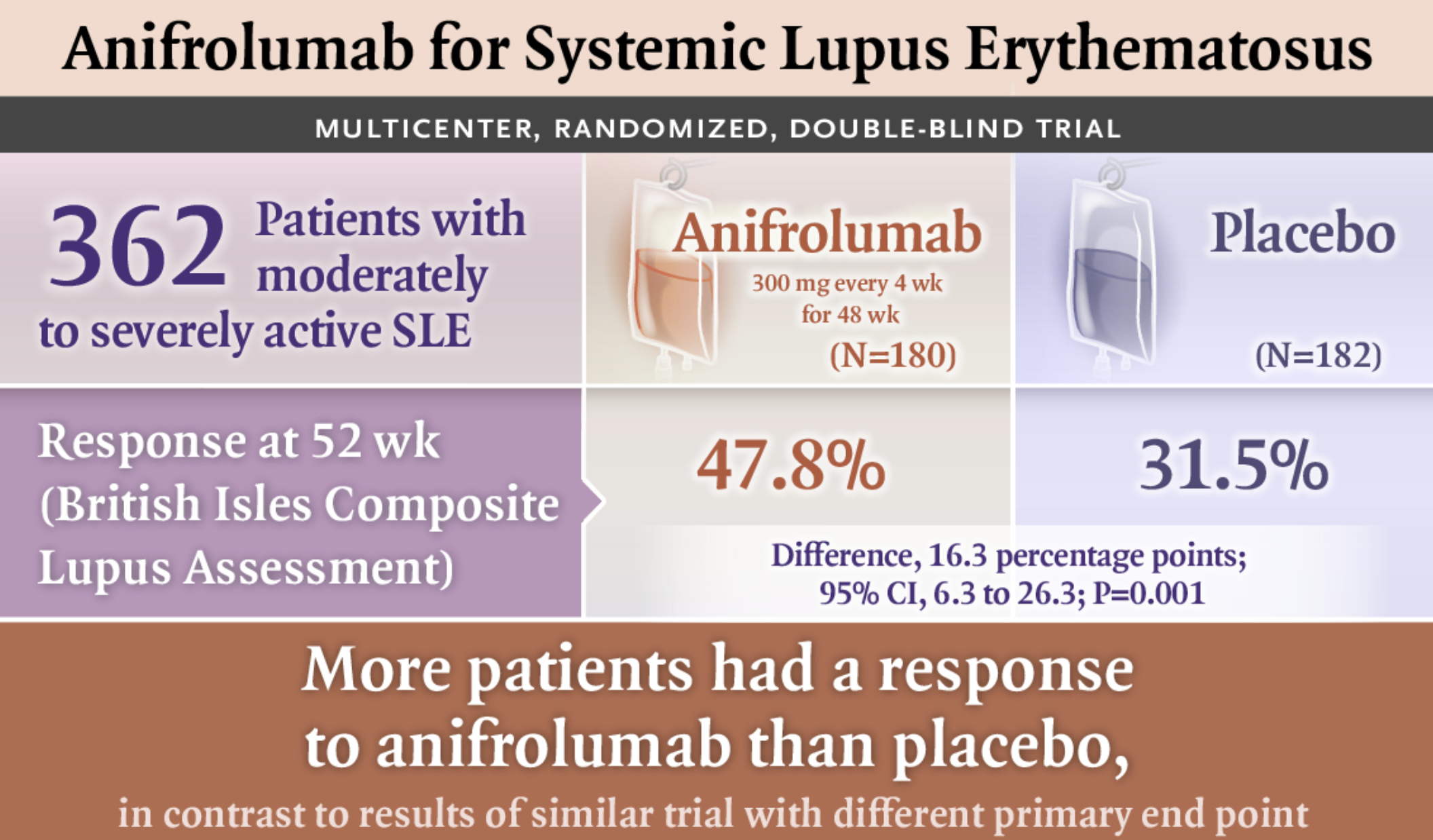
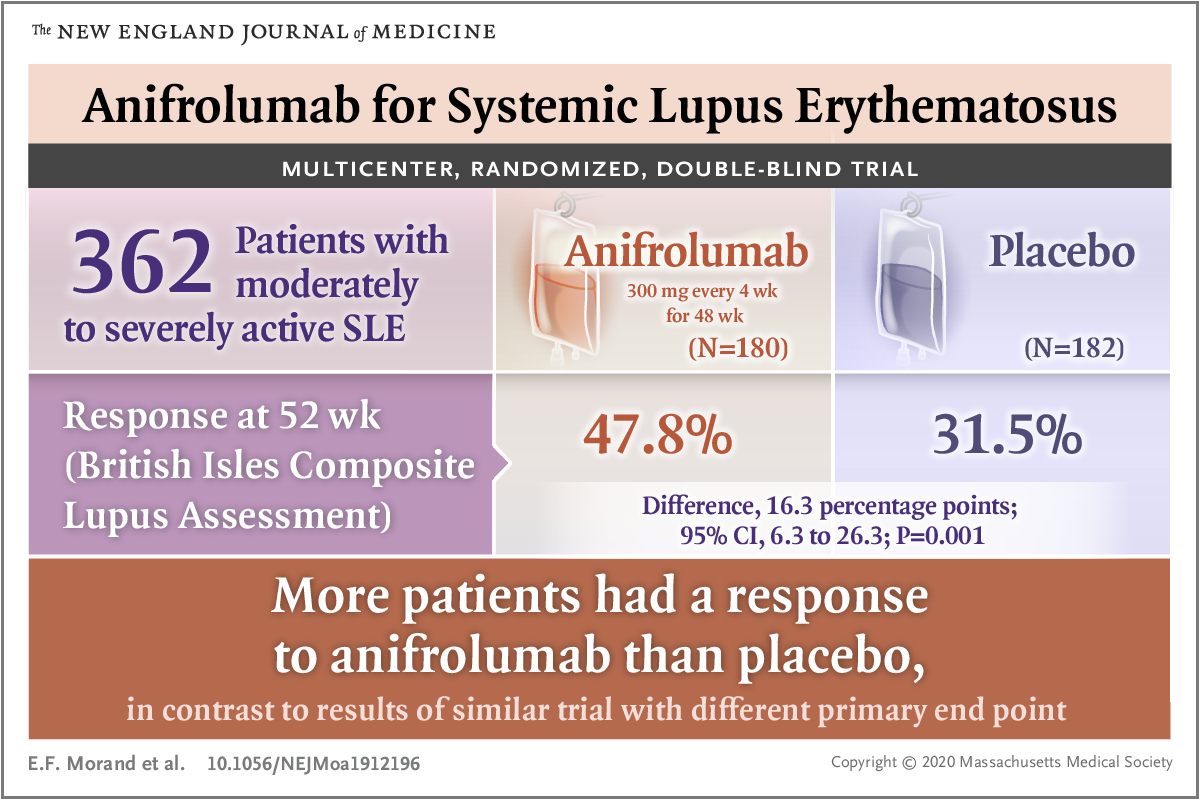
在 TULIP-2 研究中,共有 362 例患者接受了随机干预:180 例接受 anifrolumab,182 例接受安慰剂。实现缓解的患者百分比在 anifrolumab 组为 47.8%,在安慰剂组为 31.5%(P=0.001)。在具有高干扰素基因特征的患者中,实现缓解的患者百分比在 anifrolumab 组为 48.0%,在安慰剂组为 30.7%;在具有低干扰素基因特征的患者中,该百分比分别为 46.7% 和 35.5%。
阿斯利康目前正在进行 III 期试验以研究 Saphnelo 皮下给药治疗 SLE 的有效性和安全性,同时计划对狼疮肾炎、皮肤红斑狼疮和肌炎进行其他后期试验。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#系统性#
58
#SAP#
71
#狼疮#
60
#红斑#
58
#欧盟批准#
66