谢生荣:CRO业务的下一个风口,真实世界证据一体化解决方案
2020-05-16 谢生荣 动脉网
1998年8月,国家药品监督管理局(SDA)正式成立,SDA成立后为加强药品监督管理力度和依法行政,重新制定颁布了当时既能与国际接轨又符合我国国情的《新药审批办法》和《药品临床试验管理规范》(GCP)
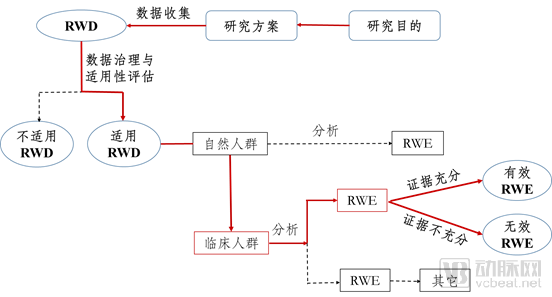
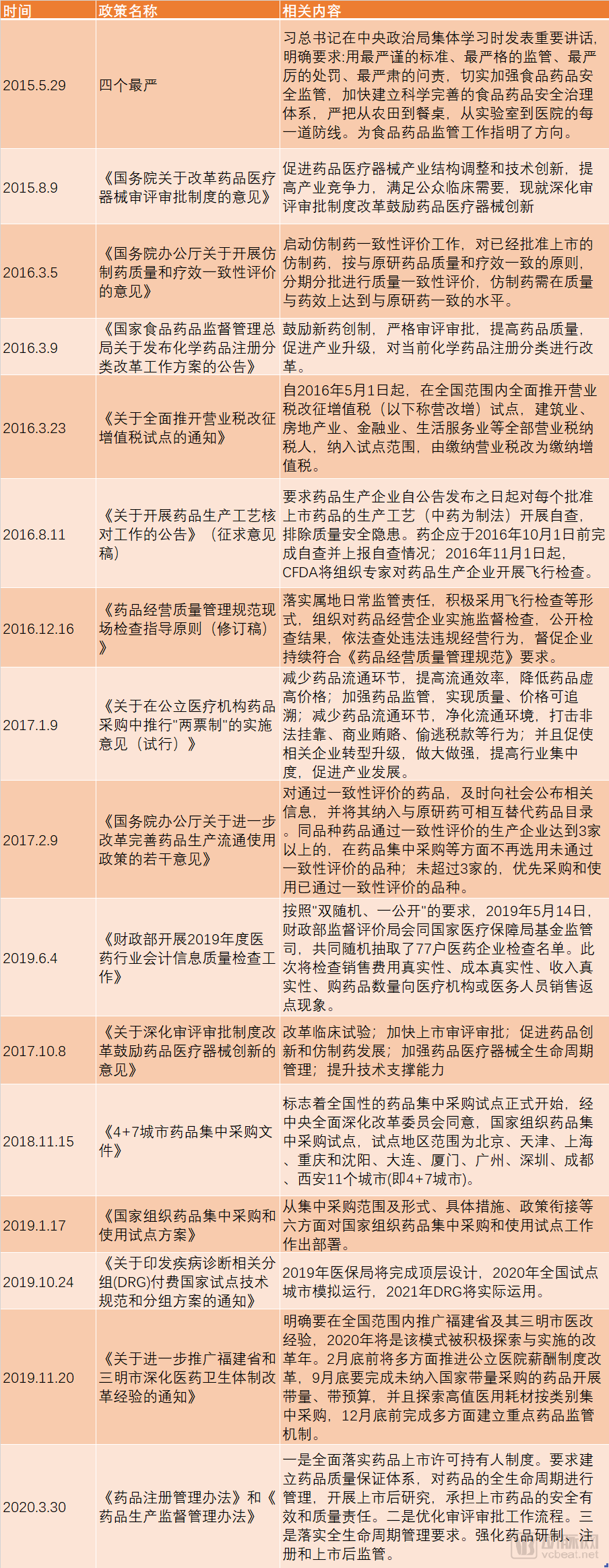
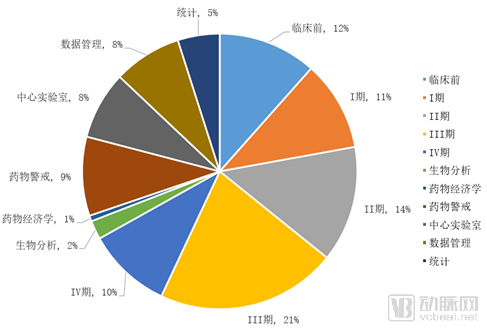
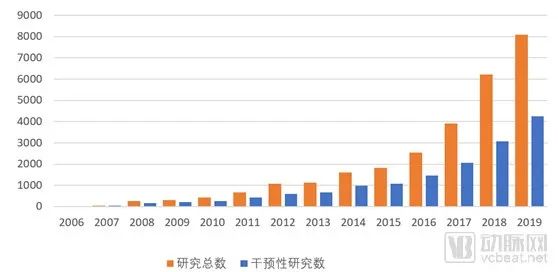
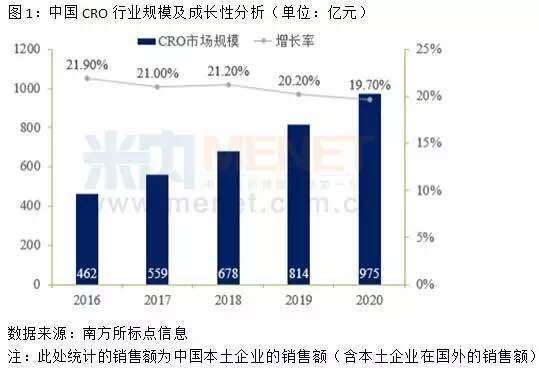
1998年8月,国家药品监督管理局(SDA)正式成立,SDA成立后为加强药品监督管理力度和依法行政,重新制定颁布了当时既能与国际接轨又符合我国国情的《新药审批办法》和《药品临床试验管理规范》(GCP)等一系列管理法规。 GCP的出台促使中国诞生了最早一批临床型CRO(药物研发外包服务)如北京汇思特(后为凯维斯)、依格斯、广州博济、北京岐黄等;2000年后涌现出了更多的临床型CRO如北京万全、泰格医药、迪美斯、润东、翰博瑞强、沈阳亿灵、北京春天、博纳西亚、海金格、上海用正、方恩医药、诺思格、博诺威、赛德盛、科林利康、百试达等,得益于临床试验政策、国内医药市场的发展及外资药企进入中国这一波红利,泰格医药于2012年在深交所挂牌上市。 2015年,原国家食品药品监督管理总局开展了药品临床数据的自查核查的“7.22”事件,一方面解决了审评审批的积压问题,另一方面改变了中国临床试验的一些环境,倒下了一批CRO。 随后2016年3月5日发布的《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,又兴起了一批以BE业务为主的CRO。随着2015年8月18日《关于改革药品医疗器械审评审批制度的意见》和2017年10月8日《关于深化审评审批制度改革鼓励药品医疗器械创新的实施意见》的公布及一系列配套政策的实施,极大的加速了生物医药领域的人才回国及国内企业新药研发热情。 一批新药临床批件产生,极大的促进了临床型CRO的发展及新临床型CRO企业的出现。 在这一波政策红利之下,我们欣喜地看到企业的发展。2019年泰格医药收入28.0亿元,净利润8.42亿元,拟申请在港交所主板挂牌上市,将成为继药明康德、康龙化成后国内第三家“A+H”药物研发外包服务龙头企业,且是唯一一家以临床服务为主的CRO。 遗憾的是,2015年以来,在政策红利下临床型CRO拿了一波投资加快了发展和扩张的步伐,但在近几年人力成本陡增及激烈的市场竞争之下,危机也陡然而生,尤其是新冠疫情对于传统临床型CRO更是雪上加霜。截止2020年4月,还没有第二家中国临床型CRO在上交所、深交所、港交所等主流板块上市。 中国临床型CRO的上市梦还远吗? 据前瞻产业研究院发布的《中国医药研发外包(CRO)行业市场前瞻与投资战略规划分析报告》统计数据显示,2021年中国CRO行业市场销售额将突破千亿元。 五年(2019-2023)年均复合增长率约为19.86%,并预测在2023年中国CRO行业市场销售额将达到1680亿元。千亿的市场,已有数家以CMO、安评等为主业的CRO上市,不可能仅仅只有一家以临床为主业的CRO公司上市。 由于传统临床型CRO的人力资源服务属性,高昂的人力成本、临床试验运营的不可控性、充分的竞争、业务小散等属性已经让传统临床型CRO企业到了需要突破自我、融合新技术、找寻新的服务领域、创造新的高利润来源的时候了。 真实世界证据这一领域即将成为CRO业务的新的增长点,一个潜在的将爆发的百亿市场,肯定将会诞生下一个在主板上市的临床型CRO,且在资本的助力下让其具有无限的想象空间和拓展边界。 真实世界证据是什么?为什么会成为下一个CRO业务的风口呢?笔者将从政策红利、传统业务的新机遇,新的市场机会、拓展空间上分析这一爆发性的市场。 真实世界证据,是指从传统临床试验以外的其他来源获取的关于用药方式、药物潜在获益、安全性的数据而产生的相关证据。真实世界证据产生和服务于产品的全生命周期,早于产品诞生,服务产品终生。尤其是各国监管部门还在出台一系列政策,支持真实世界证据用于产品研发、审评、监管等,加速产品上市。 真实世界证据一体化解决方案不仅仅包括传统IV期临床研究,还将在政策的鼓励下用于产品的审评上市,取代部分传统随机对照试验的作用;同时还将在产品临床批准前研究、上市后持续安全性和有效性研究,并将在产品上市后的学术研究中发挥巨大的作用(如图1所示)。 图1产品全生命周期中的真实世界证据 政策红利的窗口期 美国于2016年12月通过《21世纪治愈法案》,鼓励FDA开展研究并使用真实世界证据支持药物和其它医疗产品的监管决策,加快医药产品开发。在该法案的推动下,2017-2019年FDA先后发布了《使用真实世界证据支持医疗器械监管决策》、《临床研究中使用电子健康档案数据指南》、《真实世界证据计划的框架》和《使用真实世界数据和真实世界证据向FDA递交药物和生物制品资料》。 中国NMPA也出台了相应的征求意见,并在2020年1月7日发布了2020年第1号文《真实世界证据支持药物研发与审评的指导原则(试行)》,明确了真实世界研究的相关定义、真实世界数据的来源和适用性、真实世界研究的基本设计、真实世界证据的评价等内容,以指导利用真实世界证据评价药物的有效性和安全性等。 真实世界证据可用于支持药物监管决策,包括为新药注册上市提供有效性和安全性证据,为已上市药物的说明书变更提供证据,为药物上市后要求或再评价提供证据等。如图2所示: 图2来自于《真实世界证据支持药物研发与审评的指导原则(试行)》 在中国医药研发领域政策不断出台之下,药品营销领域也发生极大的变化。2016年药企的“GMP/GSP”飞检风波,关闭了一大波小型生产企业。仿制药一致性评价,进一步优化医药产业的竞争格局,资源进一步集中。药品审批审批的改革,促进创新药在中国的临床、上市。这些都将进一步推动国内药企资源整合,仿创结合,最终实现中国原研,走向世界。 “三明模式”、 两票制、营改增、“4+7”带量采购、财政部联手国家医保局对药企“穿透式”查账、DRG试点,将彻底改变旧有的“带金销售模式”,转为以患者为中心的学术营销,关注产品本身,寻找产品亮点,满足临床需求,更好的服务患者和医生。这一医药领域的营销变化,将带来大量的学术研究,尤其是创新药上市后的学术研究。相关政策如表1所示: 表1 医药研发、营销领域政策汇总 传统业务的新机遇 传统临床型CRO的主要业务是I-IV期研究,根据2016年Frost&Sullivan及招商证卷的报告,I-IV期临床研究的市场规模分别为:37.4、48.2、74.9、35.1亿美元,市场份额分别为:11%、14%、21%、10%(如图3、图4所示)。 按照这个比例预估中国的传统IV期市场规模约为26亿元。Ⅳ期研究具有大样本、多中心、多区域、长周期的特点,在“7.22”之前,Ⅳ期研究尤其是外资企业的Ⅳ期研究还是传统临床型CRO的重点竞争领域,毛利率预计在25%-35%左右。 “7.22”之后,由于人力成本的陡增、国内创新药数量的井喷、外资企业压缩成本、极低毛利率,已经使这类Ⅳ期研究由传统临床型CRO的业务领域变为大数据公司或新型CRO的重点关注业务领域。 但是,目前这类传统Ⅳ期项目,只有具有真实世界一体化解决方案的公司才能很好的运作且获得较好的利润。这类公司需要既具有很强的临床项目运营能力又具有适应性信息化系统,所以传统临床型CRO公司需要加强信息化和系统化能力,解决项目运营的成本。而大数据公司或新型CRO则需要增强自身的临床项目运营能力,确保项目的质量和进度,同时控制项目成本。 图3 2016年CRO各业务阶段及相关细分服务市场规模 图4 2016年CRO各业务阶段及相关细分服务市场份额 新的市场机会 如前所述,由于药品研发及营销领域政策的出台,将创造三个真实世界研究的新领域: 1.用于产品注册的真实世界研究 真实世界证据在某些情形下可以替代传统的RCT研究,用于上市前临床研发以及上市后再评价,具体情形如下: I.为新药注册上市提供有效性和安全性的证据:根据不同疾病的特征、治疗手段的可及性、目标人群、治疗效果和其它与临床研究相关的因素等,可以通过真实世界研究获得药物的效果和安全性信息,为新药注册上市提供支持性证据。如罕见病。 II.为已上市药物的说明书变更提供证据:当RCT不可行或非最优的研究设计时,采用PCT或观察性研究等生成的真实世界证据支持新增适应症可能更具可行性和合理性。如儿童用药等领域 III.名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发:对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。 2.创新药上市后真实世界研究 创新药上市后通常要开展大量的上市后研究,为其产品上市提供进一步的临床证据和学术素材,其研究费用通常为年销售额的10%左右,根据药品的上市时间,逐步降低。 例如,辉瑞的立普妥上市后作了至少上百项上市后临床研究,大量的真实世界证据表明其优于其他药物的特点,形成了丰富的市场推广素材、极高的学术价值、提供了临床实践指导,增强了产品的竞争力,创造了极高的销售额并延长了产品高额销售周期。 从中国临床试验注册中心及Clinicaltrial登记的非Ⅰ-Ⅲ期研究数量可以看出(图5、图6),中国真实世界研究数量持续增长。 这是由于以下两个因素促成的:一方面,中国药企创新药先后上市,外资药企的新药在中国加速上市;另一方面,中国医药营销从带金销售转为学术营销,从市场驱动变为医学驱动,今后药企将开展大量真实世界研究。 图5 中国临床试验注册中心2006-2019注册项目数(非注册Ⅰ-Ⅲ期研究) 表2 Clinicaltrial注册的涉及在中国实施的Ⅳ期及非Ⅰ-Ⅳ期研究 3.真实世界证据下的学术研究 中国药企的销售费一直居高不下(如表3所示)。企业的费用包括销售费用、管理费用、研发费用和财务费用,而广告和市场宣传相关支出就被包含在销售费用中。此外,销售费用还包括市场开发与学术推广费、业务招待费、销售人员的薪酬等,不同的上市公司统计口径不同。 2018年8月,任泽平团队发表过一个《揭开中国药企销售费用畸高之谜》的报告。报告说,2014年的一项调查显示,我国药企的销售费用主要有六大流向:公关招标机构费用、公关医院相关负责人费用、医生回扣、医药代表提成、逃税洗钱(过票)成本、统方费用。其中,公关招标机构、公关医院相关负责人和医生回扣分别对应招标环节、医院采购环节和处方销售环节,利益进行三次重新分配,且医生回扣在销售费用中的占比超过一半。 表3 上市药企销售费用 在“4+7”集中带量采购之下,入围产品肯定将大幅降低销售费用。但是在医药市场还存在未进入集采的品种、辅助用药、中药等,在销售模式转型,严查带金销售之下,原先的销售费用将在围绕销售之下,进而转为围绕产品服务患者而进行,由此将会开展大量的学术研究,进一步体现各自产品的临床价值,而这正是真实世界数据和其证据可以发挥作用之处。 拓展空间 2016年5月3日,全球最大的CRO昆泰和医药健康产业战略咨询服务商IMS Health合并为IQVIA。两家合并后诞生的是一家跨界公司,集全球性信息及技术服务和全球传统的外包服务能力。 中国一旦有一家具有真实证据一体化解决方案能力的公司,必将同时具备这两种服务能力。这样的公司才能突破传统外包服务的天花板,从而具有无限的市场想象空间。 本文作者 谢生荣 中国药科大学药理学硕士,临床医学学士,南京市银杏叶罕见病家庭关爱中心理事长。具有12年的临床试验管理操作经验,曾经在方恩医药、PPD、INCResearch等内外资CRO工作,管理过多个Ⅰ-IV期临床研究,完成过2个新药的关键Ⅲ期研究。 2015年开始专注于真实世界研究,2017年在CRO中率先成立真实世界研究部,部门人员达80人,专门承接内外资企业的Ⅲ期到Ⅳ期的之间的真实世界研究、3000例重点监测、研究者发起的研究、学术研究、流行病学研究、卫生经济学和药物经济学研究。



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#真实世界证据#
86
#CRO#
65
#一体化#
58
#解决方案#
70
#真实世界#
56
很好的学习机会
146