盘点:肿瘤干细胞领域研究进展
2015-03-31 小鸟 生物谷
肿瘤干细胞(tumor stem cells,TSCs)理论自其被提出以来,就一直是恶性肿瘤研究领域内的大热门。研究人员认为,肿瘤干细胞一方面可以自我复制保持“干性”,另一方面也可以分化成肿瘤细胞而促进肿瘤的生长。这一理论为人们重新认识肿瘤的起源和本质,肿瘤的临床诊断、治疗,以及新药研发提供了新的方向和视角。 最近,有关肿瘤干细胞的课题也频频在各大期刊杂志上发表论文,显现出其出色的
肿瘤干细胞(tumor stem cells,TSCs)理论自其被提出以来,就一直是恶性肿瘤研究领域内的大热门。研究人员认为,肿瘤干细胞一方面可以自我复制保持“干性”,另一方面也可以分化成肿瘤细胞而促进肿瘤的生长。这一理论为人们重新认识肿瘤的起源和本质,肿瘤的临床诊断、治疗,以及新药研发提供了新的方向和视角。
最近,有关肿瘤干细胞的课题也频频在各大期刊杂志上发表论文,显现出其出色的研究价值。MedSci在这里为大家罗列一下最近肿瘤干细胞研究的最新进展。
Nature communication科学家发现“狙击”肿瘤干细胞碳纳米物质
中科院高能物理研究所国家纳米科学中心纳米生物效应与安全性重点实验室和中国科学技术大学生命学院合作,研究发现金属富勒醇gd@c82(oh)22碳纳米材料可高效抑制三阴性乳腺癌干细胞的自我更新能力gd@c82(oh)22通过调控肿瘤微环境阻断细胞从上皮样(emt)到间质样(met)的转换,实现高效清除肿瘤干细胞,终止肿瘤发生和转移。
Cell death &diffe:CR1调控结肠癌肿瘤干细胞功能
最近,细胞干性被描述为一种动态变化,在正常细胞和肿瘤细胞中都可能存在。研究人员发现胚胎期蛋白Cripto-1(CR1)能够在结肠隐窝底部的正常干细胞中表达,同时也表达在结肠癌组织的肿瘤干细胞中。通过对结肠癌病人的肿瘤组织进行分选,找到CR1阳性的细胞亚群,研究人员发现这群细胞具有更强的克隆形成能力同时表达干细胞相关性基因。
CR1在肿瘤细胞中的表达随时间发生变化,受到细胞内蛋白,细胞表面蛋白和分泌蛋白的复杂调控,并且这些调控作用都与CR1阳性亚群的克隆形成能力具有相关性。在体外实验中抑制CR1表达能够诱导肿瘤干细胞生长暂停,这种抑制伴随着Src/Akt信号途径的作用下调,而通过体内实验也证明,沉默CR1能够抑制CSC驱动的肿瘤移植物生长并能够减少肿瘤干细胞的数目。利用诱导型表达系统在已经建立的肿瘤移植物中沉默CR1能够抑制肿瘤干细胞生长,并且这种抑制效应在原发性肿瘤和转移性肿瘤中均存在,这都证明了CR1对肿瘤干细胞生长具有重要调控作用。
Oncogene:趋化因子受体CCR7促进乳腺癌肿瘤干细胞生长
趋化因子受体CCR7广泛出现在乳腺癌病理生物学中。虽然最近一些研究表明CCR7高水平表达与晚期肿瘤分级和不良预后具有相关性,但关于其在乳腺癌中的特异性功能及参与的分子机制方面的体内研究仍非常有限。
为解决这些问题,研究人员构建了CCR7缺失的乳腺癌小鼠模型,通过观察发现CCR7缺失会导致乳腺癌发生明显迟滞同时伴随肿瘤负荷显着下降。通过对机制研究发现,在人类和小鼠肿瘤细胞中,CCR7能够通过调控具有干性特征的肿瘤细胞发挥功能。体内实验表明通过基因删除或药物阻断的方法抑制CCR7活性能够显着降低小鼠原发性乳腺癌干性细胞的数目,这为CCR7的促肿瘤生长功能提供了一个合理的机制解释。
Stem cell reports:p53亚型促进肿瘤干细胞潜能
肿瘤干细胞是一类具有自我更新能力并能产生异质性肿瘤细胞的细胞,其生长、转移和复发的特点与干细胞的基本特性十分相似。越来越多研究发现肿瘤干细胞对于癌症化疗耐药性和肿瘤转移的发生具有重要促进作用。
在本研究中,研究人员发现一种TP53的剪接体能够增强MCF-7乳腺癌细胞的肿瘤细胞干性,并且在删除这种剪接体后能够降低肿瘤细胞干性。这种TP53的剪接体能够刺激多能干性关键因子SOX2,OCT3/4和NANOG的表达。同时,在其他具有高转移性的乳腺癌细胞中,侵袭性与肿瘤干细胞潜能增强和TP53剪接体表达增加相关,并且在这些细胞中,SOX2,OCT3/4和NANOG的表达也受到TP53剪接体的正向调控。利用抗肿瘤药物etoposide处理MCF-7细胞能够促进肿瘤干细胞形成以及TP53剪接体依赖性的SOX2,OCT3/4和NANOG表达增强,增加了癌症复发的潜在风险。
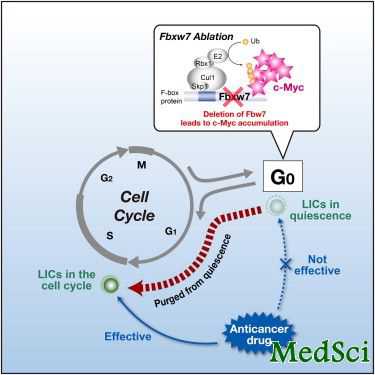
Cell Rep:隐藏在肿瘤深处的干细胞或可帮助癌细胞对疗法产生耐受
一篇刊登于国际杂志Cell Reports上的研究论文中,来自华盛顿大学的研究人员通过研究发现,在缓慢生长的肿瘤中或许也存在对疗法耐受的肿瘤干细胞。
David H. Gutmann教授说道,这种低级别脑瘤干细胞往往会使得脑瘤对抗癌药物变得不再敏感,通过将肿瘤干细胞同健康干细胞相比较研究,我们或许可以发现肿瘤干细胞对疗法耐受的原因,同时也为我们开发新型疗法,或利用多种不同药物来杀灭肿瘤干细胞,进而治疗癌症提供了一定的希望。
更多肿瘤干细胞领域的最新进展、临床应用、专家答疑等,敬请期待《2015肿瘤干细胞转化医学论坛》
会议官网:http://www.bioon.com/z/2015TSCs/Index.shtml
召开时间:2015.05.07-05.08
会议地点:中国 上海
演讲嘉宾(更多信息持续更新中):
高建新 研究员 上海交通大学医学院
高维强 教授 上海交通大学生物医学工程学院
胡国宏 教授 中国科学院健康科学研究所
刘根桃 研究员 同济大学转化医学高等研究院
刘 强 教授 大连医科大学
钱 程 教授 第三军医大学西南医院生物治疗中心
王俊文 副教授 香港大学医学院基因研究中心
张宏权 教授 北京大学肿瘤医院
周光飚 教授 中国科学院动物研究所
主要议题:

报名参会:
http://www.bioon.com/z/2015TSCs/zhuce.asp
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#研究进展#
94
有意义
169