NEJM:Fazirsiran 治疗α1-抗胰蛋白酶缺乏症相关的肝病
2022-06-27 MedSci原创 MedSci原创
α1-抗胰蛋白酶缺乏症是血中抗蛋白酶成分-α1-抗胰蛋白酶(简称α1-AT)缺乏引起的一种先天性代谢病,通过常染色体遗传。临床常导致新生儿肝炎,婴幼儿和成人的肝硬化
α1-抗胰蛋白酶缺乏症是血中抗蛋白酶成分-α1-抗胰蛋白酶(简称α1-AT)缺乏引起的一种先天性代谢病,通过常染色体遗传。临床常导致新生儿肝炎,婴幼儿和成人的肝硬化、肝癌和肺气肿等。
正常人体内常存在外源性和内源性蛋白酶,如细菌毒素和白细胞崩解出的蛋白酶对肝脏及其他脏器有破坏作用,α1-AT可拮抗这些酶类,以维持组织细胞的完整性,α1-AT缺乏时,这些酶均可侵袭肝细胞,尤其是新生儿肠腔消化吸收功能不完善,大分子物质进入血液更多,α1-AT缺乏的婴儿肝脏更易受损害。此外,α1-AT还具有调节免疫应答、影响抗原-抗体免疫复合物清除、补体激活以及炎症反应的作用,并可抑制血小板的凝聚和纤溶的发生。α1-AT缺乏时上述机体平衡的机制失调,导致组织损伤。
在出生后第一周可有胆汁淤积性黄疸、大便陶土色、尿色深。体检可发现肝肿大。生化指标有梗阻性黄疸的指征,2~4个月时黄疸往往消失,在2岁以后可现肝硬化。 在成年人,大多数α1-AT缺乏症患者以突出的门脉高压症为首发表现,患者常死于上消化道出血或肝昏迷,常发生肺气肿。男性肝硬化和肝癌的发病率高于女性。 由α1-AT缺乏导致肝硬化患者,肝脏肿瘤发病率很高,以起源于肝细胞者居多,部分起源于胆管。
SERPINA1 基因编码 α1-抗胰蛋白酶 (AAT),它主要在肝细胞中合成并分泌到循环中,通过其抗蛋白酶活性保护肺组织。AAT 缺乏是由 SERPINA1 突变引起的,导致功能丧失肺部疾病和功能获得性肝病。总共 95% 的严重 AAT 缺乏病例是由于单个氨基酸 Glu342Lys(蛋白酶抑制剂 [PI] ZZ)的纯合取代,它产生了一种称为 Z-AAT 的错误折叠和分泌不良的 AAT 蛋白,导致肝脏中的 Z-AAT 和血清中的 AAT 缺乏。血清缺乏AAT使患者易患肺气肿。在肝脏中,突变蛋白聚合并持续存在于肝细胞的内质网中,作为包涵体,在高碘酸席夫染色和淀粉酶消化 (PAS-D) 中呈阳性,这是与 AAT 缺乏相关的肝病的组织学标志。 Z-AAT 的积累会引发内质网应激、肝细胞损伤、炎症,并最终导致纤维化,进而发展为肝硬化或门静脉高压症,并导致肝失代偿或肝细胞癌。3,4 肝硬化的终生风险可能为 20% 至 40%在与 AAT 缺乏相关的肝病患者中。如果没有肝移植,终末期肝病患者的预后很差。
在成人中,与 AAT 缺乏相关的肝病通常出现在 40 岁或 50 岁。根据使用组织学评估和肝硬度测量的研究,三分之一的 PI ZZ 基因型成年人可能有临床上显着的肝纤维化。Z-AAT 积累与肝纤维化相关,这一发现表明减少 Z-AAT -AAT 的产生可能会改善肝脏表型。此外,肝酶(丙氨酸氨基转移酶 [ALT] 和 γ-谷氨酰转移酶)浓度升高、门静脉炎症和肝细胞变性与纤维化严重程度有关。 9 目前尚无针对肝脏的特异性治疗与 AAT 缺乏相关的疾病。
RNA 干扰 (RNAi) 是一种天然存在的调节基因表达的细胞机制。 Fazirsiran(以前称为 ARO-AAT)是一种研究性 RNAi 治疗剂,包含与 N-乙酰半乳糖胺偶联的合成双链小干扰 RNA 双链体,它与肝细胞去唾液酸糖蛋白受体结合,以促进内体摄取和细胞内递送。 Fazirsiran 导致 AAT 和 Z-AAT 信使 RNA 降解,从而减少 AAT 和 Z-AAT 蛋白合成肝细胞。
表达人类 Z-AAT 的转基因小鼠概括了与 AAT 缺乏相关的人类肝病。在该小鼠模型中,fazirsiran 治疗有效降低血清 Z-AAT 浓度、肝内 Z-AAT 积累、炎症、内质网和线粒体损伤,并预防激活纤维化相关基因。一项涉及健康志愿者的 1 期试验显示了足够的安全性 10,并为该 2 期试验 (AROAAT-2002) 提供了剂量信息,该试验评估了 fazirsiran 在肝病患者中的安全性、药效学和疗效与纯合子 (PI ZZ) AAT 缺乏有关。
方法学
我们进行了一项多中心、2 期、开放标签试验,根据筛选时的局部病理读数,招募了具有 PI ZZ 基因型和 F1 至 F3 肝纤维化(Metavir 分期或等效)的成年人(18 至 75 岁) .排除根据局部病理读数确定患有 F4 纤维化(肝硬化)、经常饮酒或吸烟(每天吸烟超过 12 个月)的患者。其他关键排除标准是 ALT 和天冬氨酸氨基转移酶 (AST) 浓度超过 250 U/L,估计肾小球滤过率低于 60 ml/min,支气管扩张后 1 秒用力呼气量 (FEV1) 低于 65%在未接受 AAT 增强治疗的患者中,在接受 AAT 增强治疗的患者中支气管扩张后 FEV1 低于 45%。患有非酒精性脂肪性肝炎或非酒精性脂肪肝的患者如果病情稳定且不会对参与构成实质性威胁,则被允许参与试验。
患者被依次纳入三个队列,队列 1(4 名患者)和队列 2(8 名患者)接受 200 mg 的 fazirsiran,队列 1b(4 名患者)接受 100 mg。 在试验过程中加入队列 1b 以评估剂量反应。 Fazirsiran 在第 1 天、第 4 周和之后每 12 周皮下给药。 根据标准化方法在基线和基线后收集配对的肝活检样本(队列 1 和 1b 为第 24 周,队列 2 为第 48 周)。 每次就诊时,每位患者采集两个核心肝活检样本,用于评估肝脏 Z-AAT 浓度(速冻)和组织病理学特征(福尔马林固定)。 队列 1 和 1b 的患者可在第 24 周完成试验访视后继续进入延长期,队列 2 的患者可在第 48 周完成试验访视后进入延长期。
主要终点是肝脏 Z-AAT 浓度(总、可溶性部分和不溶性部分)随时间从基线的变化,这是使用液相色谱-串联质谱法测量的,该质谱对含有独特特征肽的独特特征肽具有敏感性和特异性Z等位基因氨基酸突变。
通过血清 Z-AAT 浓度(液相色谱-串联质谱)评估药效学。所有组织学评估(苏木精和伊红、三色和 PAS-D)均使用半定量量表进行集中读取,并由不知道队列分配和活检时间点的三位组织病理学家进行裁决。 PAS-D 组织学量表用于补充液相色谱-串联质谱法,并测量整体门静脉受累程度、1 区门静脉周围肝细胞受累和 PAS-D 带状位置,分数越高表明小球越高负担(表 S1)。
使用 Metavir 分期评估肝纤维化(F0,无纤维化;F1,无隔膜的门静脉纤维化;F2,有少量隔膜的门静脉纤维化;F3,无肝硬化的大量隔膜;和 F4,肝硬化)。我们还检测了血清 Pro-C3,这是一种 III 型胶原蛋白前肽的新表位和纤维化阶段的生物标志物(有关检测的详细信息,请参见补充附录中的方法部分)。与 AAT 缺乏相关的肝病的关键组织学指标包括门静脉炎症、界面性肝炎、肝细胞死亡和小叶炎症。
安全性评估的依据是首次服用 fazirsiran 后出现或恶化的不良事件的发生率和严重程度,以及实验室测量结果和肺功能的变化(FEV1 和根据血红蛋白调整的肺一氧化碳弥散能力)浓度 [DLCOhbg])。
样本量不是根据统计假设检验确定的。 疗效、药效学和安全性终点的分析基于所有接受至少一剂 fazirsiran 的入组患者的研究结果。 缺失的数据没有被估算。
结果
共筛选了 18 名患者,入组了 16 名患者。 首例患者于2019年12月19日入组,最后一名患者于2020年10月28日入组。所有患者均完成了初步治疗期。 16 名患者中有 15 名选择在延长期内继续治疗。 在数据截止日期(2021 年 12 月 6 日)之前,所有患者均已接受所有计划剂量。 提供最后一名患者达到第 48 周或第 52 周时的数据。
14 名患者在第 24 周或第 48 周时可评估肝脏 Z-AAT 浓度的变化,15 名患者可评估纤维化。 2 名患者(队列 2)在第 48 周时肝样本不足,无法进行液相色谱-串联质谱分析,1 名患者(队列 1b)在筛查时样本不足,无法评估纤维化。 所有患者均可评估 PAS-D 球负荷和其他组织学评估。
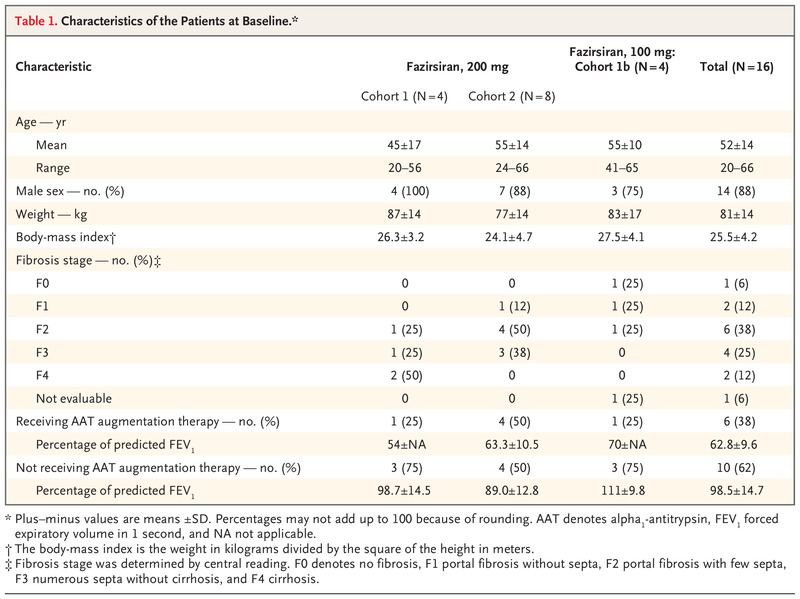
入组试验前,16 名患者中有 15 名出现与 AAT 缺乏相关肝病相关的肝酶浓度反复升高。 尽管 F1 至 F3 纤维化(基于局部病理读数)是纳入标准,但队列 1 中的 2 名患者在筛选时患有肝硬化(F4),队列 1b 中的 1 名患者没有纤维化(F0)(表 1)。 六名患者在接受 AAT 增强治疗时进入试验。
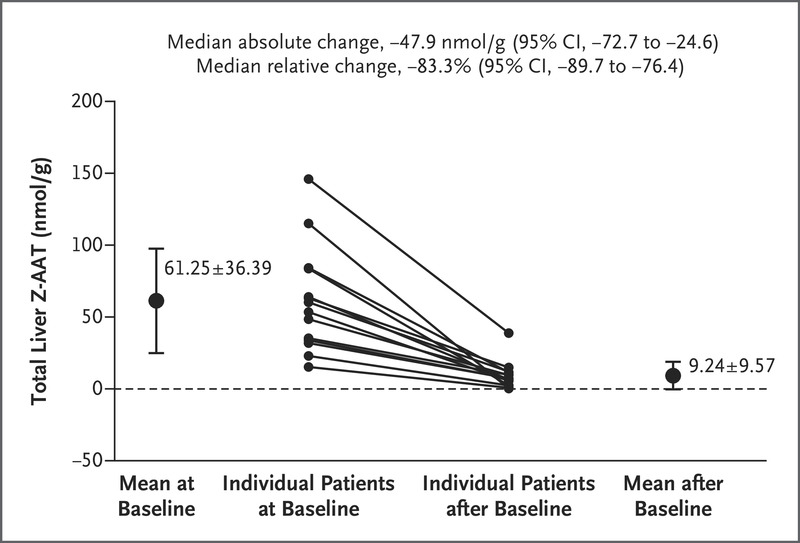
主要终点显示,所有患者的累积总肝脏 Z-AAT 均降低(第 24 周或第 48 周的中位百分比变化,-83.3%;95% 置信区间 [CI],-89.7 至 -76.4)(图 1)。 可溶性和不溶性部分中肝脏 Z-AAT 浓度的降低相似(表 S2)。
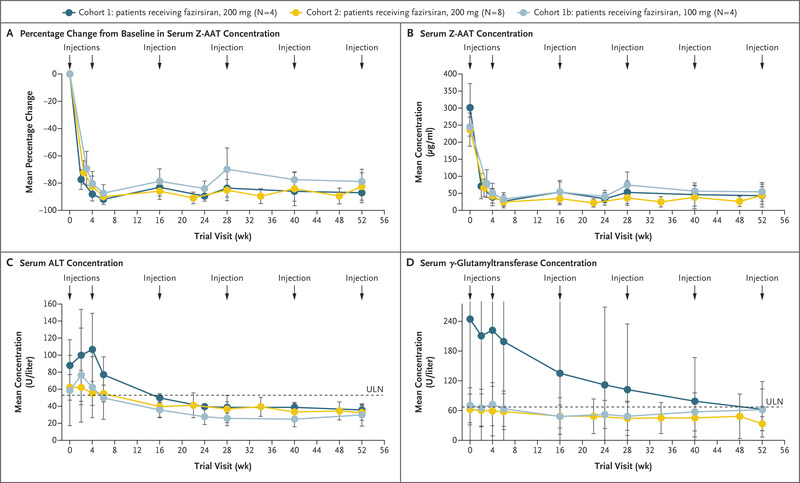
次要终点显示,治疗后所有患者均出现药效学反应,所有队列的血清 Z-AAT 浓度均值(±SD)较基线显着降低。 在第 6 周观察到 200-mg 队列和 100-mg 队列的最低点分别为 -90±5% 和 -87±6%。200-mg 队列的血清 Z-AAT 浓度持续降低略高于对照组。 52 周期间的 100 毫克队列(图 2A 和 2B)。
大多数患者在基线时具有较高的组织学 PAS-D 小球负荷(平均得分为 7.4;得分范围为 0 至 9,得分越高表明小球负荷越大)(图 S3)。治疗后,所有患者的球囊负荷均降低,平均评分在第 24 周或第 48 周降至 2.3(降低 69%)。图 S4 显示了基线时肝内 Z-AAT 小球的存在和第 48 周时 fazirsiran 介导的小球清除。
肝脏 Z-AAT 浓度的降低与炎症的组织学改善(减少)有关。在可以评估改善情况的 13 名基线评分为 1 或更高(评分范围为 0 至 3 [或肝细胞死亡评分范围为 0 至 2],评分越高表明疾病活动性越高)的患者中,大约三分之二的患者有在第 24 周或第 48 周时,门静脉炎症(13 人中有 8 人)、界面性肝炎(13 人中有 9 人)和肝细胞死亡(12 人中有 8 人)改善了 1 个或更多点,而 23% 的患者(13 人中有 3 人)小叶炎症指标改善了一个或多个点(表S3)。同时,31% 的患者(16 人中的 5 人)的小叶炎症指标恶化 1 分或更多。
肝损伤的生物标志物也减少了。在基线时,所有队列的平均 ALT 浓度均高于正常范围的上限。治疗后,从第 16 周到第 52 周,所有队列的 ALT 浓度均下降(图 2C)。基线时 ALT 浓度高于正常范围上限的所有 12 名患者在第 52 周时均降低至正常浓度。平均 AST 浓度同样降低(数据未显示)。治疗后平均 γ-谷氨酰转移酶浓度也降低(图 2D)。基线 γ-谷氨酰转移酶浓度高于正常范围上限的 8 名患者中有 4 名 (50%) 在第 52 周时浓度正常。
接受 200 mg 剂量的 12 名患者(队列 1 和 2)中有 7 名出现纤维化消退(≥1 期),包括 2 名肝硬化患者,3 名接受 100 mg 剂量的可评估活检患者均未出现纤维化消退(≥1 期) (队列 1b)(图 S5)。队列 2 中的两名患者从基线到第 48 周出现纤维化进展(均从 F2 到 F3),尽管两者的 PAS-D 球负荷均显着降低(基线评分分别为 9 分和 4 分,第 48 周均为 0 分)和治疗后ALT和γ-谷氨酰转移酶浓度降低。
第 1 组和第 2 组的血清 Pro-C3 平均浓度下降,但在第 28 周的最后一次观察中,第 1b 组的血清 Pro-C3 浓度与基线相比保持相对不变。第 28 周第 1 组的血清 Pro-C3 浓度下降了 36%,并且在一周内保持低水平52(当浓度降低的百分比为 39% 时)。在队列 2 中观察到持续但不太明显的下降(图 S6)。
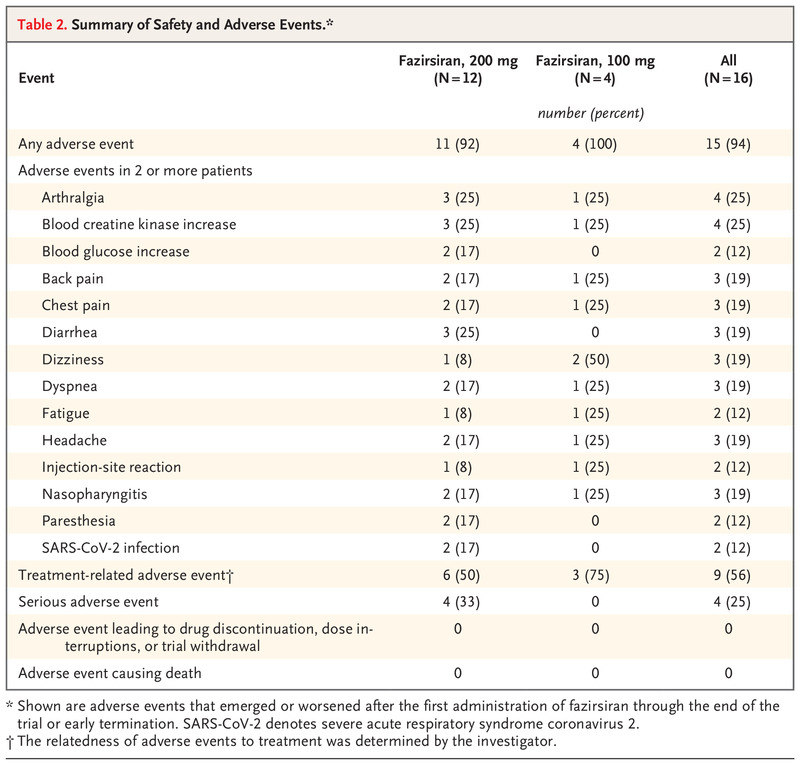
在安全性方面,在 1.5 年的时间里,没有死亡、fazirsiran 治疗中断或剂量中断(表 2)。首次给药 fazirsiran 后出现或恶化的最常见不良事件是关节痛和血肌酐激酶浓度增加(每名 4 名患者 [25%])。涉及血肌酐激酶浓度升高的不良事件轻微且短暂。不良事件的频率或严重程度没有明显的剂量依赖性增加。第 1 组和第 2 组报告了 4 种严重不良事件,均为中等严重程度:病毒性心肌炎、憩室炎、呼吸困难和前庭神经元炎。心肌炎病例与 Epstein-Barr 病毒感染有关。呼吸困难的病例发生在一名患有非阻塞性肺气肿和延迟肺部护理的患者中,试验期间肺功能没有实质性变化。前庭神经元炎病例发生在 2019 年冠状病毒病 (Covid-19) 疫苗接种后。每个严重事件都得到解决,四名患者中的每一个都在延长期内继续接受 fazirsiran 治疗。
讨论
与 AAT 缺乏相关的肝病中的肝损伤是由于 Z-AAT 蛋白在肝细胞中的积累造成的。1,5,13,14 临床前证据表明,肝细胞中 Z-AAT 的积累可以通过多种细胞内途径(例如蛋白酶体降解)来抵消。 和自噬),以试图减少积累的伤害性后果。 5,10,13,15-17 患有其他慢性肝病(例如非酒精性脂肪肝)的患者会因损伤的积累而发生类似的肝细胞变化 (例如,过多的脂肪),这会逐渐导致炎症、组织再生和纤维形成。 18 通过 RNAi 机制,fazirsiran 治疗减少了新的 Z-AAT 合成,使这些途径能够清除有毒的 Z-AAT 积累,从而消除 侮辱并允许天然的肝脏恢复过程发挥作用。
该试验的大多数终点是客观的实验室或影像学变量。组织学测量的变化由不知道队列分配的三位独立肝病理学家评估和裁定。在 24 或 48 周期间,所有患者的肝脏总 Z-AAT 浓度和 PAS-D 小球负荷均显着降低。肝脏 Z-AAT 浓度的变化似乎与门静脉炎症和肝酶浓度的变化中度相关。然而,在该试验中不可能建立肝脏 Z-AAT 浓度与这些其他生物标志物之间的相关性,因为患者人数较少,并且接受 fazirsiran 与较低浓度的肝脏 Z-AAT 之间存在一致的关联。我们观察到一组患者的纤维化阶段发生了变化,其程度与肝脏 Z-AAT 浓度降低的幅度无关。然而,在接受 200 mg 剂量的 12 名患者中,7 名在 24 或 48 周后纤维化出现一个或多个阶段的消退。两名患者在第 48 周时出现了一个阶段的纤维化进展,但我们在这些相同的患者中观察到球负荷和肝酶浓度显着降低。这 2 名患者的纤维化明显增加可能反映了由于采样错误或阅读者间变异性导致的变异性。
RNAi 疗法代表了越来越多的已批准或研究药物,它们有可能使靶向细胞类型中的特定基因沉默。针对高脂血症或源自肝脏的疾病(例如原发性高草酸尿症)等代谢紊乱的肝脏靶向 RNAi 疗法取得了突破。 该试验表明,fazirsiran 减少了肝内 Z-AAT 的产生和积累,这是肝脏疾病的致病因素与 AAT 缺乏相关,并且与炎症的生化和组织学生物标志物的同时改善有关。尽管所有患者的肝脏 Z-AAT 浓度显着降低,但突变蛋白浓度的降低并没有统一转化为治疗前 24 或 48 周期间纤维化的消退。最终,治疗与 AAT 缺乏相关的肝病患者的最终目标和临床益处将是纤维化的预防或消退。因此,需要更大样本和更长治疗时间的安慰剂对照临床试验来证实法齐西兰对纤维化的影响。
原始出处:
Strnad P, Mandorfer M, Choudhury G, Griffiths W, Trautwein C, Loomba R, Schluep T, Chang T, Yi M, Given BD, Hamilton JC, San Martin J, Teckman JH.Fazirsiran for Liver Disease Associated with Alpha1-Antitrypsin Deficiency.N Engl J Med . 2022 Jun 25. doi: 10.1056/NEJMoa2205416.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#AZ#
62
#蛋白酶#
49
NEJM上果然牛,感谢梅斯更新及时
64
#α1-抗胰蛋白酶缺乏症#又有望上市
70