Nat Cell Biol:张如刚教授揭示卵巢癌治疗重要新策略
2017-07-25 佚名 药明康德
今日,美国宾夕法尼亚大学 / Wistar研究所的张如刚教授团队的一项研究在线发表在了《自然》子刊《Nature Cell Biology》上,它对于卵巢癌新药的开发,有着极为重要的应用价值。
今日,美国宾夕法尼亚大学 / Wistar研究所的张如刚教授团队的一项研究在线发表在了《自然》子刊《Nature Cell Biology》上,它对于卵巢癌新药的开发,有着极为重要的应用价值。
▲本项研究的负责人张如刚教授(图片来源:Wistar研究所)
卵巢癌是女性中常见的一类癌症,每年影响了数十万人的生活。由于卵巢癌缺乏症状,在患者得到诊断时,疾病往往已经发展到了晚期,因此卵巢癌患者的预后一直不容乐观。在卵巢癌中,一种叫做卵巢透明细胞癌的疾病类型尤其恶劣——化疗几乎对它无效。因此倘若患者的卵巢癌属于这一类型,能够使用的治疗方案就非常有限。不幸的是,在亚洲,这种类型的卵巢癌非常普遍。每5名卵巢癌患者中,就有一名患有卵巢透明细胞癌。因此,倘若能有创新治疗手段出炉,无疑会给这些女性患者带来巨大福音。
“常规的化疗对这些卵巢癌患者的效果非常不好,这意味着我们必须探索这些患者的遗传组成,寻找到全新的治疗策略,”张如刚教授说:“基于ARID1A突变的疗法,有望为卵巢癌的治疗带来变革。”
张如刚教授说的ARID1A是其任职的Wistar研究所及其他科研机构在近年来的一大发现。研究人员通过分析卵巢透明细胞癌患者的样本,发现在超过一半的病例中,ARID1A蛋白都出现了突变。ARID1A是一种染色质重塑蛋白(chromatin remodeling protein)。在正常情况下,它能够通过改变染色质的结构,来调控特定基因的表达。这对于细胞的正常生理功能来说非常重要。而一旦它发生突变,卵巢透明细胞癌也就越容易复发。
那么,在这些卵巢癌患者中,突变的ARID1A蛋白又起到了怎样的作用呢?之前,一些研究发现一种叫做HDAC6(组蛋白脱乙酰酶)的蛋白表达量在卵巢癌中有所上升,数据库的分析也进一步证实,ARID1A蛋白出现突变的卵巢癌细胞,对于HDAC6的抑制变得相当敏感。这些数据暗示,ARID1A与HDAC6两者间也许有着千丝万缕的关联。
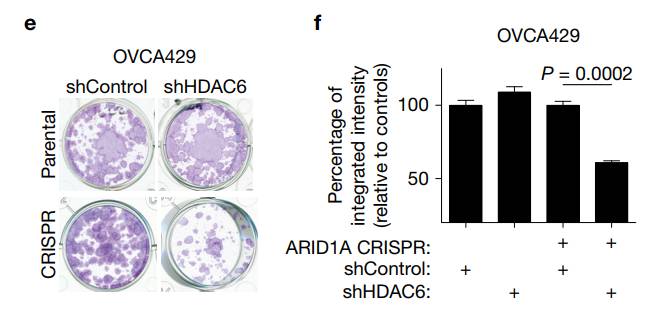
▲在用CRISPR技术敲除了ARID1A蛋白后,这些细胞对HDAC6的抑制变得格外敏感(图片来源:《Nature Cell Biology》)
进一步的研究证实了这个假设。在ARID1A蛋白被敲除的细胞中,HDAC6的mRNA水平与蛋白表达量均有显着上升。在小鼠体内,这一结果同样成立。此外,在卵巢癌的样本中,研究人员也发现,ARID1A与HDAC6的水平呈现负相关。这些结果表明,ARID1A抑制了HDAC6的表达。前者一旦发生突变,就无法继续抑制后者,导致后者的水平上升。
HDAC6水平的上升,是导致卵巢透明细胞癌病发的原因吗?很有可能!研究人员发现,HDAC6的一个直接底物,是知名的抑癌蛋白p53。在HDAC6抑制剂的作用下,p53第120位氨基酸的乙酰化水平有显着上升,而其他几处乙酰化位点则没有明显变化。这表示在正常情况下,HDAC6会让p53该位点“去乙酰化”,影响到它的功能。
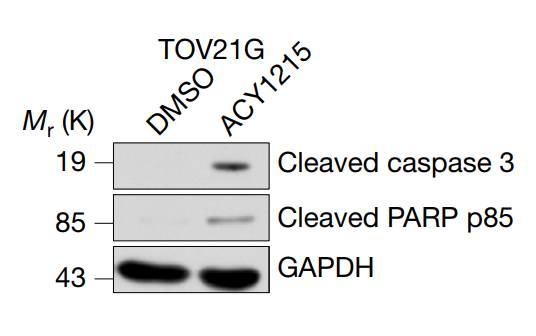
▲通过抑制HDAC6(右栏),细胞凋亡的标志物蛋白水平均有所上升(图片来源:《Nature Cell Biology》)
后续研究又发现,这个位点对于p53的抑癌作用非常关键。在它不被HDAC6“去乙酰化”的情况下,p53能诱导肿瘤细胞发生凋亡。
这样一来,一条影响卵巢癌的关键通路就被理清了:在正常情况下,ARID1A会抑制HDAC6的表达,从而使p53的关键位点保持乙酰化,促使肿瘤细胞发生凋亡。而在ARID1A出现突变的情况下,HDAC6的表达量开始不受控制地猛增,将p53上的关键位点“去乙酰化”,让p53的抑癌功能大打折扣,诱发卵巢癌的诞生。
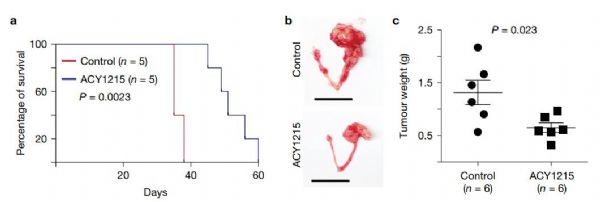
既然这里的关键环节是HDAC6,那么如果我们能够抑制这种蛋白,是否就能起到治疗卵巢癌的作用呢?这正是张如刚教授团队所尝试的。他们找到了一种叫做ACY1215的HDAC6抑制剂,并注射入了卵巢癌小鼠体内。实验表明,与对照组相比,ACY1215的治疗延长了小鼠的生存期,并且控制住了肿瘤的增长。这一结果表明,对于ARID1A蛋白发生突变的卵巢癌,进一步抑制HDAC6,有望起到“合成致死”的效果,让这些卵巢癌细胞发生自我凋亡。
▲HDAC6蛋白抑制剂ACY1215能有效改善难治卵巢癌的治疗情况(图片来源:《Nature Cell Biology》)
“我们的结果表明用选择性抑制剂靶向HDAC6的手段是一种可能的治疗策略,能治疗ARID1A蛋白发生突变的卵巢透明细胞癌和其他癌症,”该研究的共同第一作者Shuai Wu博士说道:“我们在研究中使用的HDAC6抑制剂在临床试验中已经显示出了很好的耐受性,因此我们的发现在未来有望取得应用。”
张如刚教授博士毕业于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,并在宾夕法尼亚大学与Fox Chase癌症中心接受了博士后的训练。2012年,他加入了Wistar研究所。去年,他的工作被CDMRP评为年度卵巢癌研究的亮点之一。我们很高兴看到来自中国的学术新星能够在国际舞台上闪耀,也祝愿看到越来越多华人学者的身影。
原始出处:
Kathleen R. Cho,David W. Christianson& Rugang Zhang.et al.ARID1A-mutated ovarian cancers depend on HDAC6 activity.Nature Cell Biology
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Nat#
78
#CEL#
71
#Biol#
82
#Bio#
78
#Cell#
79
#新策略#
75
学习过了,谢谢分享!
99
学习了,谢谢分享
108
学习,谢谢分享
123