肿瘤生物学:(13)肿瘤的侵袭和转移
2022-09-07 小药说药 网络
在肿瘤多阶段演进的早期阶段,肿瘤细胞在原发灶无限增殖,往往要经过若干年才形成明显的原发性肿瘤病灶。这些生长与全身各处的肿瘤当其长到一定大小时,都会影响所在器官的功能,产生不同程度的临床症状。
1前言
在肿瘤多阶段演进的早期阶段,肿瘤细胞在原发灶无限增殖,往往要经过若干年才形成明显的原发性肿瘤病灶。这些生长与全身各处的肿瘤当其长到一定大小时,都会影响所在器官的功能,产生不同程度的临床症状。
尽管原发性肿瘤非常凶险,但其最终只会引起10%左右的肿瘤患者死亡,而大约90%的肿瘤患者最终死于原发灶以外部位的转移性肿瘤的生长。这种转移的形成是肿瘤细胞离开原发灶,沿着身体内的“高速公路”——血管和淋巴管——在全身寻找新的部位并重新生长形成细胞克隆的结果。
肿瘤细胞的散播是肿瘤发展过程中最具危险性的过程。当肿瘤细胞在远处器官形成克隆时,往往会对机体产生严重的破坏。
肿瘤发展中的侵袭性主要依赖于肿瘤细胞本身及相关基质中复杂的生物化学和生物学改变。然而,我们对于肿瘤侵袭和转移的机制目前的认识依然十分有限,这些在肿瘤进展晚期出现的侵袭转移是肿瘤发病机制研究中主要悬而未决的问题。
2侵袭-转移级联反应
上皮来源的恶性肿瘤和其它组织,如结缔组织和神经组织的肿瘤,都具有相似的侵袭和转移方式。甚至某些造血系统的肿瘤,特别是淋巴瘤,也同样具有一个局灶化的早期肿瘤及播散到远端组织器官的晚期肿瘤阶段。这一系列复制的步骤,称为“侵袭-转移性级联反应”。
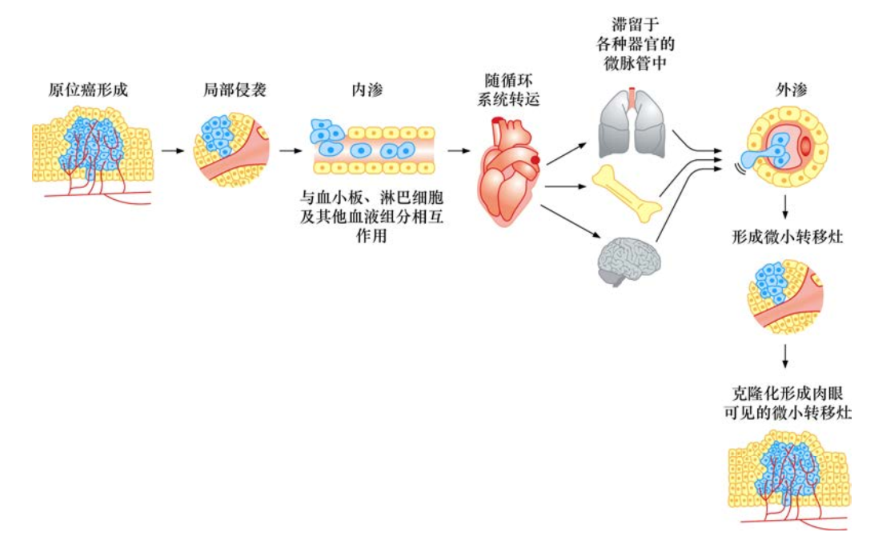
侵袭-转移级联反应的全部过程概况为7个独立的步骤。起始阶段,局部侵袭使原位癌细胞破坏并突破基底膜,侵入毛细淋巴管或毛细血管,随后,这些肿瘤细胞随着体循环,到达解剖学上的远端部位,瘤细胞滞留并穿出毛细淋巴管或毛细血管管壁,从而形成隐匿性的微小转移灶。
最终,一些微小转移灶在附着部位获得“克隆化”的能力,形成肉眼可见的转移瘤。最后一步——克隆化,是所有步骤中效率最低的一步。成功完成全部级联步骤的可能性很小,这就是为什么单个肿瘤细胞离开原发瘤后,很难成功地形成远端肉眼可见转移灶的原因。
近期分子和细胞生物学研究,用另一个两阶段的侵袭-转移级联反应理论描述这一过程:第一个阶段是肿瘤细胞从原发性肿瘤到远处组织器官的物理学播散;第二个阶段的“克隆化”则依赖于播散的肿瘤细胞对远处组织微环境的适应。
3克隆形成
一旦转移性癌细胞到达实质组织,它们就可以增殖形成小簇的播散癌细胞团,称为微小转移灶。其中的一些微小转移灶可以最终成长为临床上可以检测到的肿瘤团块,这一从微小转移灶生长为肉眼可见转移瘤的过程,通常称为克隆形成。
单个癌细胞成功完成侵袭-转移级联的所有步骤的概率非常低。转移形成的低成功率,有时称为转移无能。这是侵袭-转移级联过程中一系列无效步骤顺序叠加的最终结果。试验表明,转移性癌细胞在侵袭-转移级联反应的早期步骤中完成效率很高,但最后一步,涉及克隆形成的过程中成功率很低,这是整个级联中的限速步骤。因此,在转移性癌细胞及其后代最终形成临床上可以检测的肿块之前,相对一段时间里已经有大量的微小转移灶遍布全身各组织器官。
4侵袭癌细胞的表型变化
为了获得运动和侵袭能力,癌细胞必须丢掉许多上皮细胞的表型,改变变型、脱离上皮层、发生一系列显著的改变这个过程称为上皮间叶转化(EMT)。
 在侵袭到邻近组织的肿瘤边缘可以看到EMT现象,这一病理过程与早期胚胎发育及创伤修复过程中的EMT非常相似。这种高度的相似性揭示了一个可能的机制模型:癌细胞侵袭过程中存在的、复制的细胞重组过程,依赖于通常在胚胎发育和成年组织损伤过程中表达程序的重激活。一旦癌细胞进入EMT程序,它们可以利用这一程序来深层次地改变其形态、运动性和向邻近细胞层侵袭的能力。这种模式意味着,癌细胞不需要逐一获得与侵袭相关的多种细胞表型。相反,这些细胞只是活化了一个由基因组决定的形态发生程序而已。
在侵袭到邻近组织的肿瘤边缘可以看到EMT现象,这一病理过程与早期胚胎发育及创伤修复过程中的EMT非常相似。这种高度的相似性揭示了一个可能的机制模型:癌细胞侵袭过程中存在的、复制的细胞重组过程,依赖于通常在胚胎发育和成年组织损伤过程中表达程序的重激活。一旦癌细胞进入EMT程序,它们可以利用这一程序来深层次地改变其形态、运动性和向邻近细胞层侵袭的能力。这种模式意味着,癌细胞不需要逐一获得与侵袭相关的多种细胞表型。相反,这些细胞只是活化了一个由基因组决定的形态发生程序而已。
正常和病理状态下的EMT,除了涉及细胞形态改变并获得运动能力外,细胞基因表达谱也发生了改变。上皮细胞标志物——E-钙黏蛋白和细胞角蛋白的表达受到抑制,而诱导表达一种间叶细胞骨架中间纤维的组成成分,波形蛋白(vimentin)。发生EMT的上皮细胞通常产生纤连蛋白,这是一种在正常情况下只由间叶细胞、如成纤维细胞分泌的细胞外基质蛋白。同时,典型的成纤维细胞标志物——N-钙黏蛋白,通常取代E-钙黏蛋白开始表达。
5基质细胞的作用
令人信服的试验数据表明,小鼠乳腺癌细胞的侵袭转移能力明显受基质细胞信号的影响,在这一实验中,主要是巨噬细胞。
小鼠乳腺癌细胞的体内和体外实验结果表明,EGF是癌细胞侵袭的主要诱导因子。像多数上皮细胞一样,癌细胞也表达EGF受体,EGF活化其受体导致细胞获得运动侵袭能力并分泌CSF-1,而后者可以趋化并活化巨噬细胞。巨噬细胞对CSF-1刺激的反应是增殖并分泌EGF,EGF又反过来激活肿瘤细胞。
巨噬细胞在侵袭-转移级联反应的两个阶段——最初的侵袭性产生和血管内渗中均发挥关键作用。募集的巨噬细胞分泌组织蛋白酶B与癌细胞表明E-钙黏蛋白的表达缺失相关,E-钙黏蛋白缺失本身也可以作为启动EMT的信号。
这些数据表明,癌细胞获得包括EMT在内的恶性表型,并不仅仅是由这些细胞的基因组决定的。实际上,细胞表型的转换通常是癌细胞基因组中特定突变的等位基因和周围组织微环境中的信号、特别是肿瘤上皮和反应性基质交界处的间质协同作用共同决定的。在多种肿瘤中,这种交互信号的传递由反应性基质分泌的特定因子如TGF-β、Wnt、PGE2和TNF-α介导。
6细胞外蛋白酶的关键作用
EMT代表了癌细胞获得侵袭和运动能力的复制生物学过程,这包括了一些重要的效应分子,其中最重要的效应分子是基质金属蛋白酶(MMP)。在肿瘤中被募集的间质细胞主要是巨噬细胞、肥大细胞和成纤维细胞,这些细胞能够分泌大量的蛋白酶。通过溶解组织中包绕在细胞周围的厚厚的基质分子,MMP为细胞的移动创造了空间。
被MMP降解的ECM组分包括纤维蛋白原、黏蛋白、层粘连蛋白、胶原及蛋白聚糖等。在降解ECM组分的进程中,MMP还可以动员和激活特定的生长因子,这些生长因子本来以非激活的形式包绕在ECM或细胞周围。
与这些分泌型MMP功能互补的一个关键分子是MT1-MMP,它直接锚定于癌细胞质膜表面,切割、降解细胞外基质成分、细胞表明黏附分子及生长因子受体和趋化因子。它还可以裂解失活型的酶原,使之转变成有酶活性的MMP分子。
MT1-MMP活性在基底膜崩解过程中发挥主导作用,在恶性进展早期,癌细胞表明的MT1-MMP可切割赋予基底膜刚性作用的Ⅳ型胶原蛋白,基底膜的疏松化使癌细胞开始侵袭下方基质。一旦到达基质,侵袭的癌细胞被相互交联的Ⅰ型胶原纤维网所阻碍,此时MT1-MMP再一次发挥关键作用。MT1-MMP降解Ⅰ型胶原蛋白并切割活化基质来源的不具活性的酶原(MMP-2前体)。活化的MMP-2在细胞周围空间中进一步将Ⅰ型胶原蛋白切割成低分子量片段。
7转移抑制基因
侵袭-转移级联反应涉及很多基因,这些基因的蛋白质产物可作为控制细胞生理的、很多复杂的调节环路的组成部分。与所以精细调控的环路一样,它们既包含正性调节因子又包含负性调节因子,以确保精细调控信号的正确输出。这些负性调控因子,类似于肿瘤抑制因子,被称为转移抑制基因,这些基因特异性地抑制转移而不影响原发瘤生长。例如p53的近亲p63,p53通过与p63形成异源四聚体,抑制p63功能,进而增加转移倾向性。
P63的抑制功能来自其促进Dicer表达的能力,该基因产物是microRNA加工最后一步中的酶,其表达水平下调与肿瘤侵袭性增强有关。其它转移抑制基因,包括E-钙黏蛋白、RhoGDI-2和TIMPs等编码的蛋白质都是侵袭和转移已知生物学机制中的重要参与者。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#生物学#
113