欧洲肺癌大会(ELCC)是由欧洲肿瘤内科学会(ESMO)与国际肺癌研究协会(IASLC)联合举办的肺癌领域权威大会,致力于促进科学发展、传播教育和提高全世界肺癌专家的临床实践。2023 ELCC于中欧时间2023年3月29日-4月1日以线上+线下的形式召开,会议汇集肺癌领域最前沿研究进展和最新的临床研究数据。本文将为大家盘点免疫治疗的重磅研究:

II期TACTI-002研究最终数据:K药联合Eftilagimod Alpha二线治疗PD-1/PD-L1抑制剂耐药的转移性NSCLC患者
研究纳入既往一线治疗对PD-1/PD-L1抑制剂耐药的转移性NSCLC患者,所有患者接受帕博利珠单抗(K药)联合可溶性LAG-3蛋白Eftilagimod Alpha治疗,主要终点为iRECIST评估的客观缓解率(ORR)。次要终点为疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)和耐受性。

结果显示:36名患者在2019年4月至2021年8月期间入组。中位年龄为67岁(46-84岁),61%为男性。患者有鳞状(19%)和非鳞状(78%)组织学分型。所有的PD-L1亚组都包括在内:39%的患者TPS<1%,82%的患者TPS<50%。患者单独接受PD-1/PD-L1抑制剂(28%)或与铂类化疗相结合(72%)作为一线治疗。患者接受了中位剂量为5(2-35)个帕博利珠单抗和7(2-22)个 Eftilagimod Alpha治疗。ORR和DCR(iRECIST)分别为8.3%和33%。中位PFS为2.1个月,6个月时PFS率为25%。
最常见(>15%)的不良事件是食欲下降(33%)、呼吸困难(31%)、咳嗽(28%)、气喘(22%)、疲劳(19%)、关节痛(17%)和体重下降(17%)。总之,K药联合Eftilagimod Alpha 具有可靠的安全性,并且在PD-1/PD-L1抑制剂耐药的NSCLC患者中显示出令人鼓舞的抗肿瘤活性迹象,值得进一步研究。
III期CONTACT-01(NCT04471428)的研究:T药联合cabozantinib二线治疗PD-1/PD-L1抑制剂耐药的转移性NSCLC患者
共有366例患者入选CONTACT-01,并随机分配接受1200 mg atezolizumab每3周1次,联合40 mg cabozantinib口服1次,或75 mg/m2多西他赛静脉注射1次每3周1次。不允许交叉,主要终点为总生存期(OS),关键次要终点为无进展生存期(PFS)、ORR、缓解持续时间(DOR)和安全性。
结果显示:
治疗组中位OS为10.7个月(95% CI, 8.8-12.3),对照组为10.5个月(95% CI, 8.6-13.0)。差异不具有统计学意义 (OS HR, 0.88;95%CI, 0.68-1.16);P = .3668)。治疗组中位PFS为4.6个月(95% CI, 4.1-5.5),对照组为4.0个月(95% CI, 3.1-4.4)。降低了26%的进展风险 (PFS HR, 0.74;95% ci, 0.59-0.92)。治疗组的ORR为11%,对照组为13.3%。治疗组中位DOR为5.6个月,对照组为4.3个月,均无统计学差异。
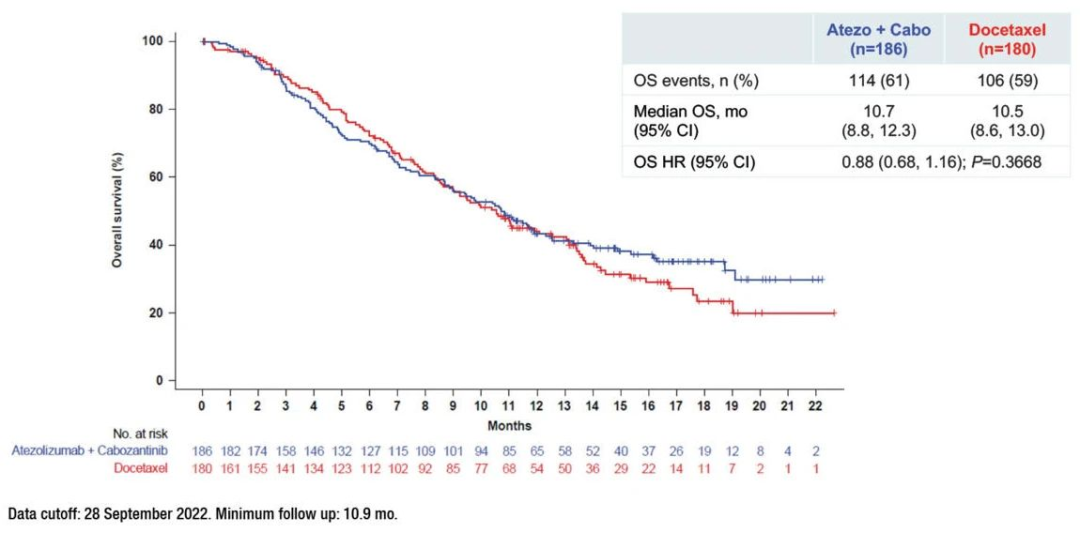
atezolizumab + cabozantinib组治疗相关的3/4级不良事件(AEs)为39%,多西他赛组为13.3%,atezolizumab + cabozantinib组为20%,多西他赛组为17%。
III期EMPOWER-Lung 1(NCT03088540)研究:一线cemiplimumab联合化疗治疗 PDL1阳性脑转NSCLC患者
在EMPOWER-Lung 1中:患者1:1随机分组到Cemiplimab 350 mg IV Q3W或研究人员选择的化疗方案。患者包括IIIB、IIIC或IV期鳞状或非鳞状NSCLC,PDL1表达不小于50%。患者年龄中位数为61.0岁(范围45-77岁),69.6%的人口年龄小于65岁。男性占89.9%,白人占79.7%。亚洲患者占人口的17.4%。实验组34例患者和对照组35例基线诊断时均为脑转移患者。
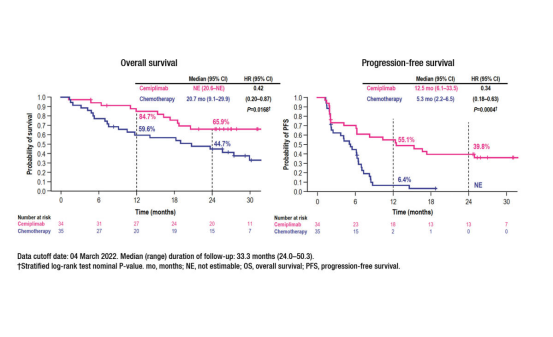
结果显示:中位随访33.3个月(范围24.0-50.3),中位OS不可评估(NE;cemiplimab组的95% CI, 20.6-NE)与单独化疗20.7个月(95% CI, 9.1-29.9) (HR, 0.42;95% ci, 0.20-0.87;P = .0168)。24个月的OS率为65.9%,cemiplimab组为44.7%。
中位PFS为12.5个月(95% CI, 6.1-33.5) vs 5.3个月(95% CI, 2.2-6.5),cemiplimab无进展更长 (HR, 0.34;95% ci, 0.18-0.63;P = .0004)。
cemiplimab组有5例(14.7%)患者发生脑疾病进展,而化疗组有7例(20.0%)。在两组中,任何级别的治疗紧急不良反应(TEAEs)发生率均为97.1%。在实验组中,35.3%的患者经历了3级或更高级别的不良反应, 8.8%的患者因不良反应而停药。该队列中无不良反应死亡病例。
在化疗组,60.0%的患者经历了3级或更高级别的不良反应, 1例(2.9%)患者因不良反应而需要停药。该队列中有3例(8.6%)因不良反应死亡。
III期POSEIDON试验(NCT03164616):4个周期的化疗+ D+T一线治疗转移性NSCLC患者
POSEIDON是一项全球性、随机、开放标签、多中心研究。1013名EGFR/ALK突变野生型、初治IV期NSCLC患者1:1:1随机分配接受以下任一方案:
(1) D+T+化疗:度伐利尤单抗1500 mg+有限疗程曲美木单抗75mg+化疗,每3周,共4个周期;然后每4周度伐利尤单抗1500 mg维持治疗直至疾病进展;化疗后额外增加1剂曲美木单抗(第16周);
(2)D+化疗:度伐利尤单抗1500 mg+化疗,每3周,最多4个周期;随后度伐利尤单抗每4周进行维持治疗,直至疾病进展;
(3)化疗:铂类为基础的化疗,每3周,最多6个周期。
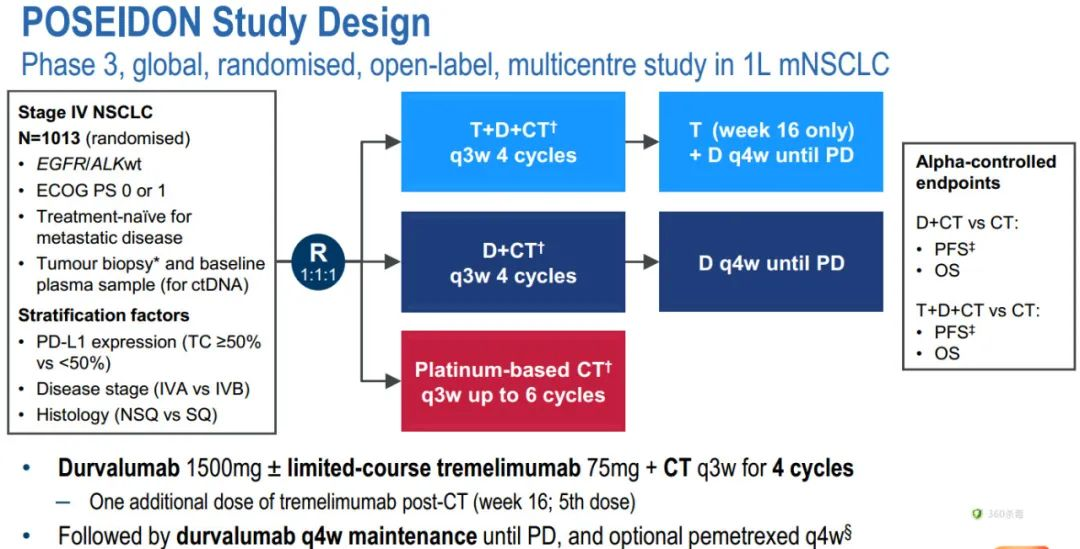
主要研究终点为盲法独立审查委员会(BICR)根据RECIST v 1.1标准评估D+化疗组 vs 化疗组的无进展生存期(PFS)和OS。
分别有78%、82%和74%的患者接受T+D+化疗、D+化疗或化疗组完成了4周期化疗。560例患者在2周期化疗后疾病稳定(SD),其中,22.9%的患者在4周期化疗后PR。在STK11、KEAP1或KRAS突变亚组中观察到相似的趋势,T+D+CT带来的改善最明显,尽管其95%CI区间很宽且部分重叠。ITT人群中的252例患者在2周期化疗后达到CR/PR,89.7%在4周期化疗后仍然缓解。所有治疗组的靶病灶中位体积在2周期和4周期化疗之间缩小。1~2周期和3~4周期的3/4级AE和严重AE发生率相似。
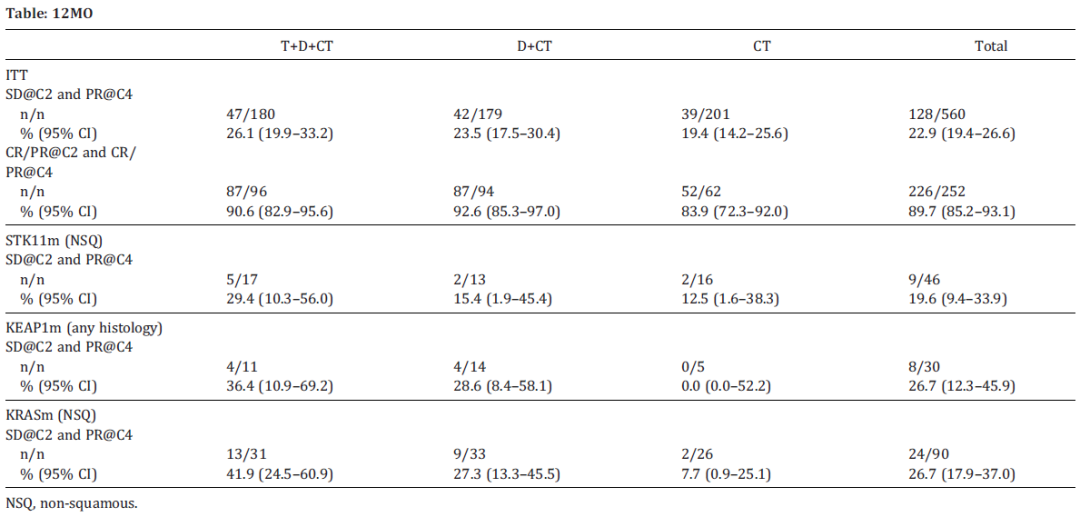
这些探索性数据支持,当给予T(有限疗程)和D(直到进展)时应使用4周期化疗,以优化转移性NSCLC患者包括一些更难治疗的亚组的疗效和肿瘤缩小。多的2周期CT并不会显著增加毒性或影响计划CT的管理。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言