ASCENT研究:全球Trop-2 ADC药物III期研究结果亮相
2020-09-21 医药魔方 医药魔方
9月14日,美国Gilead公司宣布以210亿美元收购了一家名叫Immunomedics的公司,看重的就是后者今年4月22日刚刚被FDA加速批准用于既往已经接受2种以上疗法的成人转移性三阴乳腺癌的Tr
9月14日,美国Gilead公司宣布以210亿美元收购了一家名叫Immunomedics的公司,看重的就是后者今年4月22日刚刚被FDA加速批准用于既往已经接受2种以上疗法的成人转移性三阴乳腺癌的Trodelvy(sacituzumab govitecan)。Trodelvy获批时是基于一项单臂、II期研究的ORR和应答持续时间(DoR)数据,108例既往接受过两种以上疗法的三阴乳腺癌患者,使用Trodelvy治疗后的ORR为33.3%,中位DoR为7.7个月。
ESMO大会首日,之前已经宣布因为疗效出色而提前终止的III期ASCENT研究的详细结果也终于亮相。Trodelvy相比医生选择的化疗方案对照组显着改善了患者的PFS(5.6 vs 1.7个月),OS(12.1 vs 6.7个月),ORR(35% vs 5%)。
三阴乳腺癌(TNBC)占所有乳腺癌病理类型的10%~20%,多发于绝经前女性。三阴乳腺癌侵袭性强,易转移,预后极差,确诊后的生存期通常不超过20个月,5年生存率不足15%。TNBC对激素疗法和靶向治疗都不敏感,一般按照预后较差的乳腺癌进行常规治疗,标准疗法是术后使用含有蒽环类或紫杉醇类的新辅助化疗。由于TNBC患者的ER受体、PR受体或HER2受体存在多种亚型,即便是同一治疗方案,不同患者的应答水平也有很大差异大,而且多数患者很快会产生耐药性。
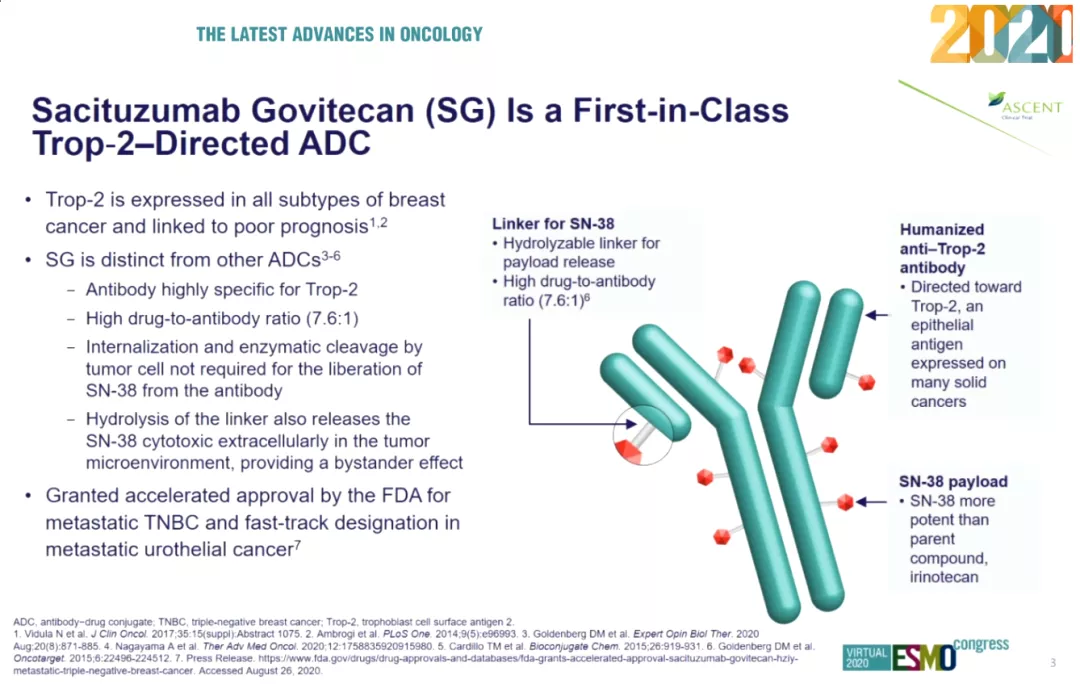
FDA在2020年4月22日批准了sacituzumab govitecan用于治疗既往已经接受2种以上疗法的成人转移性三阴乳腺癌患者。sacituzumab govitecan是全球首个获批治疗三阴乳腺癌的抗体偶联药物(ADC),通过特异性靶向人滋养层细胞表面抗原2(Trop-2)的单抗Sacituzumab将临床常用化疗药物伊立替康的活性代谢产物govitecan(SN-38)靶向运送到实体瘤病灶,发挥化学毒性杀伤作用。
(来源:ESMO 2020,下同)
Trop-2在乳腺癌、宫颈癌、结直肠癌、肾癌、肝癌、肺癌、胰腺癌、前列腺癌等多种肿瘤细胞表面大量表达,三阴乳腺癌患者的Trop-2表达率高达90%,但是Trop-2在正常组织中表达有限,因此是一个有效的治疗靶点。ASCENT研究则是Trop-2 ADC药物在全球范围内的首个III期研究,其结果备受关注。
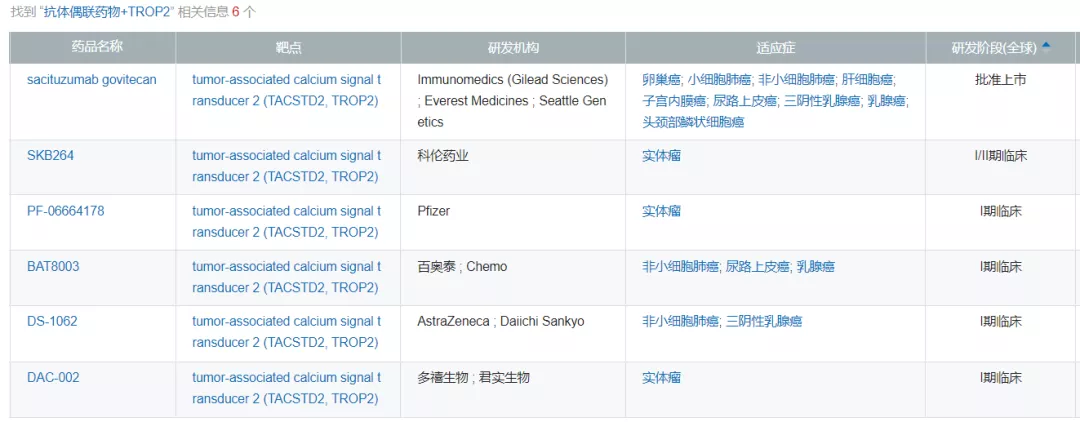
▲全球在研Trop-2 ADC药物(来源:NextPharma)
Immunomedics公司曾在7月6日宣布了ASCENT研究的顶线结果,显示Trodelvy相比化疗对照组显着改善了mPFS(5.6 vs 1.7个月,HR =0.41),到达了主要终点。研究同时到达了OS、ORR等关键次要终点。9月19日的ESMO2020大会正式为大家揭晓了ASCENT研究的详细结果。
01研究设计
ASCENT研究是一项国际多中心、开放标签、随机、平行组、III期试验,入组了529例既往接受过至少2种化疗(包括紫杉醇)的复发难治转移性三阴乳腺癌患者,分别给予Sacituzumab govitecan(SG,n=267,10mg/kg,第1,8天给药,21天为一个周期),以及医生选择的治疗化疗方案(TPC,艾日布林、卡培他滨、吉西他滨或长春瑞滨,n=262),直至疾病进展或出现不可耐受毒性。
研究的主要终点是未发生脑转移患者的PFS,次要终点包括全部患者的PFS、OS、ORR、DoR、产生应答的时间(TTR),安全性(接受1剂药物以上的全部患者)。数据截止日期为2020年3月11日。
02研究结果
ASCENT研究筛选了730例患者,最终入组529例。SG组患者中位年龄54岁,对照组中位年龄53岁。
SG组中位PFS为5.6个月(4.3~6.3),医生选择治疗方案组(TPC)为1.7个月(1.5~2.6),SG组可使疾病进展风险降低59%(HR=0.41, 95% CI:0.32~0.52,p<0.0001)。患者按照年龄、种族、既往疗法、地区、是否接受过PD-1/PD-L1、是否发生肝转移分层后,也能观察到降低PFS改善的获益。
在次要终点方面,SG组相比TPC组改善了患者OS(12.1 vs 6 .7个月),患者死亡风险降低52%(HR=0.48, 95% CI:0.38~0.59,p<0.0001)。SG组的ORR为35%(82/235),TPC组仅为5%(11/233)。
安全性方面,SG治疗组中位治疗周期7个,中位治疗时间4.4个月,未见严重心血管毒性事件,未见2级以上神经毒性事件和3级以上间质性肺病事件,未见治疗导致的死亡病例,不良事件导致治疗终止的发生率低于TPC对照组(4.7% vs 5.4%)。SG组发生率高于TPC对照组的3级以上治疗相关不良事件主要包括中性粒细胞缺乏症(51% vs 33%)、腹泻(10% vs 1%)、白细胞减少症(10% vs 5%)、贫血(8% vs 5%)和粒细胞减少性发热(6% vs 2%)。
03研究结论
ASCENT研究是首个在经治转移性三阴乳腺癌患者中开展的III期研究,并且证明较医生选择的单药标准化疗具有PFS、OS、ORR的显着改善获益。sacituzumab govitecan耐受性良好,具有可控的安全性,不良事件导致的治疗终止发生率较低,未发生严重心血管毒性、2级以上神经毒性和3级以上间质性肺病,未见治疗相关死亡。
总之,ASCENT研究证明sacituzumab govitecan可以成为经治转移性三阴乳腺癌患者的治疗新标准。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#ASC#
109
#III期研究#
73
#III#
86
#研究结果#
90
#III期#
0