最新Nature:线粒体复合体I会促进肾癌转移
2024-08-20 BioMed科技 BioMed科技 发表于上海
研究通过对癌症患者输注标记营养素,揭示肾癌代谢特征,发现线粒体功能在癌症进展中演变,对转移有限制,原发部位生长无限制。
大多数肾癌是代谢功能障碍,但这种功能障碍如何影响人类癌症的进展尚不清楚。在此,德克萨斯大学西南医学中心Ralph J. DeBerardinis等人在80多名癌症患者的肿瘤切除手术中输注了13C-标记的营养素。[U-13C]葡萄糖的标记因亚型而异,表明仅靠肾脏环境无法解释所有的肿瘤代谢重编程。与邻近肾脏相比,透明细胞肾细胞癌(ccRCCs)在体内和体外器官型培养中显示出三羧酸(TCA)循环中间体的抑制标记,表明抑制标记是组织固有的。患者输注[1,2-13C]醋酸盐和[U-13C]谷氨酰胺,再加上对分离的人肾脏和肿瘤线粒体呼吸的测量,揭示了ccRCCs中较低的电子传递链活性,这有助于减少氧化和增强还原性TCA循环标记。然而,与原发性ccRCC相比,ccRCC转移出乎意料地增强了TCA循环标记,表明患者在转移过程中的代谢程序不同。在小鼠中,刺激癌症细胞中的呼吸或NADH循环足以促进转移,而抑制电子传递链复合物I可减少转移。这些在人类和小鼠身上的发现表明,在癌症进展过程中,代谢特性会发生演变,因此线粒体功能对转移有限制,但对原始部位的生长没有限制。相关工作以“Mitochondrial complex I promotes kidney cancer metastasis”为题发表在Nature。

【文章要点】
尽管有线粒体功能障碍的遗传证据,但这些突变如何影响人体RCC体内的营养代谢尚不清楚。术中输注13C标记的营养素并分析从手术切除的样本中提取的代谢物中的13C标记,可以揭示肿瘤和邻近组织之间或不同患者肿瘤之间的代谢差异。作者之前报道了五种人类ccRCCs中葡萄糖碳对TCA循环中间体的贡献受到抑制,这意味着这些肿瘤中的葡萄糖氧化减少。在这项研究中,作者证明,这是ccRCC的内在特征,因为在ccRCC组织的培养切片中,对TCA循环的低葡萄糖贡献得以保留,并且并非所有在肾脏中生长的肿瘤都显示出对TCA周期的葡萄糖贡献受到抑制。作者还报告了多种ETC成分的功能障碍,表现为线粒体呼吸减少。这可能与ccRCC mtDNA拷贝数的抑制有关,这预示着PDH活化不足以使ccRCC的氧化代谢正常化(图1)。
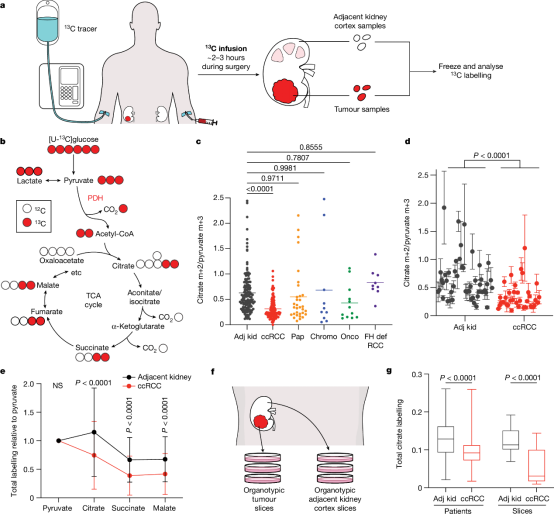
图1 葡萄糖代谢在肾癌亚型之间存在差异
来自小鼠的证据表明,TCA循环和OxPhos可能促进癌症进展的多个方面。研究发现表明,OxPhos和线粒体功能的其他方面是增强适应度程序的基础,该程序使一些肿瘤细胞能够在与癌症进展相关的各种压力下生存,包括与转移相关的压力。目前尚不清楚在原发部位具有可变线粒体功能的肿瘤细胞是否在转移过程中激活线粒体代谢,或者转移是否选择了具有高线粒体代谢的预先存在的细胞群。对仍在肾脏中的人类ccRCCs的分子分析表明,线粒体代谢能力较高的肿瘤(即mtDNA含量较高和OxPhos基因表达较高)最有可能导致早期死亡。尽管这些线粒体改变可能发生在原发性肿瘤中,但在小鼠身上的实验表明,OxPhos的益处只有在逃离原发性瘤后才能显现出来。复合物I的抑制和NDI1或LbNOX的表达均未影响肾脏中的肿瘤生长,尽管所有这些因素都改变了转移负担。由于这些实验使用的是无胸腺小鼠,数据还表明,呼吸能力对转移的影响主要与免疫原性无关(图2)。因此,通过靶向线粒体代谢来抑制癌症进展的努力将有助于了解人类肿瘤中可变线粒体功能的机制以及线粒体如何影响转移。
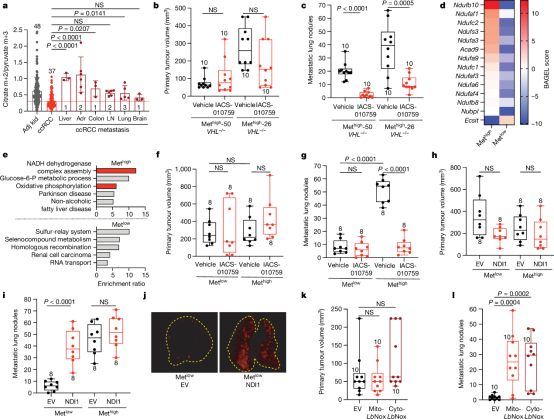
图2 复合体I是小鼠有效转移所必需的
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肾癌# #线粒体功能#
64