2016年12月Cell期刊不得不看的亮点研究
2017-01-05 生物谷 生物谷
2016年12月份已经结束了,12月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:首次发现CRISPR/Cas9基因编辑的“关闭开关”doi:10.1016/j.cell.2016.11.017CRISPR/Cas9基因组编辑正快速地引发生物医学研究变革,但是这种新技术迄今为止并不是非常精确的。这种技术能够在基因组中无意地产生过多的或者不想要的变化,产生脱
2016年12月份已经结束了,12月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:首次发现CRISPR/Cas9基因编辑的“关闭开关”
doi:10.1016/j.cell.2016.11.017
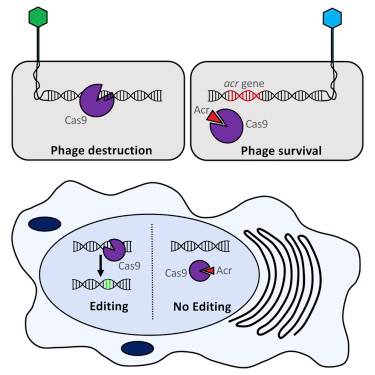
CRISPR/Cas9基因组编辑正快速地引发生物医学研究变革,但是这种新技术迄今为止并不是非常精确的。这种技术能够在基因组中无意地产生过多的或者不想要的变化,产生脱靶突变,从而限制了它在治疗应用中的安全性和疗效。
如今,在一项新的研究中,来自美国马萨诸塞大学医学院和加拿大多伦多大学的研究人员发现首批已知的CRISPR/Cas9活性“关闭开关”,从而为CRISPR/Cas9编辑提供更好的控制。
马萨诸塞大学医学院RNA治疗研究所教授Erik J. Sontheimer博士、多伦多大学分子遗传学教授Alan Davidson博士和多伦多大学生物化学助理教授Karen Maxwell博士鉴定出三种自然产生的抑制Cas9核酸酶的蛋白。这些被称作抗CRISPR的蛋白具有阻断Cas9切割DNA的能力。
2.Cell:赞!又发现两种新的抗CRISPR蛋白
doi:10.1016/j.cell.2016.12.009
在刚刚发现几种能够阻断人细胞中的CRISPR-Cas9活性的蛋白(Cell, doi:10.1016/j.cell.2016.11.017)之后,来自美国加州大学旧金山分校的Joseph Bondy-Denomy和同事们在一项新的研究中报道了更多的抗CRISPR蛋白(anti-CRISPR)。
研究人员先假设细菌基因组可能含有一种抑制剂来阻止CRISPR切割其自身基因组中的靶标,然后通过在细菌基因组中寻找CRISPR序列和它的靶标而发现这些Cas9抑制剂。确实,Rauch和同事们揭示出几种存在于李斯特菌中的抗CRISPR蛋白,而且这些抗CRISPR蛋白的序列是之前的噬菌体感染中遗留在李斯特菌基因组中的。Rauch说,“正如CRISPR技术是基于细菌的天然抗病毒防御系统开发出来的,我们也能够利用病毒制造出的抗CRISPR蛋白来绕过这些细菌防御系统。”
这项研究发现两种蛋白抑制剂AcrIIA2和AcrIIA4阻断来自酿脓链球菌的Cas9酶活性,其中Cas9是一种经常用于基因组编辑中的DNA切割酶。
3.Cell:揭示细胞破坏受损线粒体机制
doi:10.1016/j.cell.2016.11.042
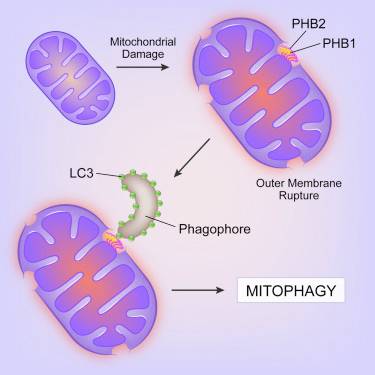
在一项新的研究中,来自美国德州大学西南医学中心的研究人员发现细胞用来发现和破坏线粒体的机制,其中当线粒体遭受损伤时,它可能导致遗传问题、癌症、神经退行性疾病、炎性疾病和衰老。
论文通信作者、德州大学西南医学中心自噬研究中心主任Beth Levine博士解释道,迄今为止,科学家们着重关注线粒体外膜上发现的蛋白“标记(tag)”---特别是附着这些标记的蛋白Parkin---来解释细胞的自噬体如何靶向患病的线粒体。自噬体是双膜囊泡,含有自噬过程中被降解的细胞材料。
但是在这项新的研究中,研究人员通过研究人细胞和小鼠细胞,发现在线粒体内膜上的一种受体实际上在指导这些自噬体达到它们的“猎物”中发挥着更加重要的作用。
他们发现蛋白PHB2(prohibitin 2, 抑制素-2)停留在线粒体内膜上,但是当患病的线粒体外膜破裂时,会暴露出来。一旦线粒体外膜破裂发生时,像一名守望者那样停留在自噬体外侧的蛋白LC3就被PHB2招募。
蛋白随后附着到PHB2上,自噬体就携带者它的命运已被确定的“货物”到溶酶体---细胞内发现的另一种细胞器---中,而溶酶体就像一种微型的胃部那样发挥作用,利用酶降解细胞废弃物。 Levine博士说,这项研究发现PHB2在靶向线粒体进行自噬降解中起着至关重要的作用。
这项研究也发现在发育的胚胎中,PHB2是常规地清除父本线粒体DNA所必需的,从而仅留下母本的线粒体DNA。
4.Cell:纤毛G蛋白偶联受体与细胞外囊泡之间的信号转导调控
doi:10.1016/j.cell.2016.11.036
纤毛(cilium)是一种细胞表面比细胞小5000倍的小仓室,集中了Hedgehog信号传导、视觉、嗅觉和体重稳态的受体。通过维持其自身的第二信使环状AMP(cAMP)和Ca2+的浓度,纤毛为信号分子提供了独特的反应条件,这些信号分子在通路激活时动态进入和离开纤毛。例如,Hedgehog通路的激活触发G蛋白偶联受体(GPCR)GPR161的纤毛出口(ciliary exit),导致的纤毛体cAMP水平的降低促进随后的信号传导步骤。信号依赖性纤毛出口可以延伸到一些光转导分子和GPCR生长抑素受体3(SSTR3)和神经肽Y受体2(NPY2R)。然而,这种纤毛出口对信号转导的功能重要性仍然比较有争议。
用于将活化的GPCR从纤毛回收回细胞的常规途径依赖于构象传感器β-arrestin 2和BBSome(一种巴尔得-别德尔综合征 蛋白复合体,其与Arf样的GTP酶会形成膜包被复合体Arl6/Bbs3)。同时,细胞胞吐作用(ectocytosis)最近被发现作为单细胞绿藻衣藻的替代纤毛出口途径出现。在胞吐作用过程中,纤毛或质膜的局部向外弯曲释放出细胞外囊泡(EV),称为ectosome或微囊泡。尽管纤毛胞吐作用可能代表衣藻属的专用方式,但由于纤毛具有暴露于细胞外环境的唯一的膜结构,哺乳动物和线虫EV的分析已经检测到部分在纤毛中发现的几种蛋白质,特别是多囊肾病(PKD)蛋白纤维细胞毒素/PKHD1和多囊蛋白-2/PKD2和突起特异性蛋白prominin。然而,EV也可以源自多泡体分泌,并且这种类型的EV(称为外泌体exosome)可以在与纤毛膜融合从而将蛋白质递送至纤毛。因此与纤毛相关的膜芽可以分为与纤毛融合的外泌体或从纤毛出芽的ectosomes。鉴于在蠕虫和哺乳动物中纤毛相关EV的起源的多个假说,纤毛胞吐作用的进化保守性仍有待确定。类似地,纤毛胞吐作用的条件性触发和分子机制以及吞吐之间的相互作用在很大程度上仍是未知的。最后,EV介导的功能范围仍然是一个悬而未决的问题。虽然EV最初被认为细胞清理的方式,但EV携带信息进行细胞间传递的设想已经取代了先前的假设,比如本研究中纤毛ectosome和纤毛相关EV的功能。
信号传导受体在激活Hedgehog等信号通路后会从纤毛吐出。来自斯坦福大学医学院的研究人员发现,当激活的G蛋白偶联受体(GPCR)未能通过BBSome介导通过纤毛回到细胞时,这些GPCR在通过ectosome释放到细胞外前,会集中到纤毛膜芽的尖端。出乎意料,肌动蛋白actin和肌动蛋白调节剂drebrin和肌球蛋白myosin 6介导从纤毛尖端的ectosome释放。从纤毛中释放激活的的信号分子,这种镜像信号依赖的收回作用(retrieval)、信号依赖的胞吐作用是有选择性和有效的过程。与这些发现相一致,去除GPR161(一个Hedgehog信号的负调节器)的BBSome的缺失会有相应的胞吐作用的补偿,可以在Bbs突变体中进行适当的Hedgehog信号转导。在野生型细胞中,纤毛受体缺乏收回决定因子(retrieval determinants)如参与信号依赖性胞吐作用的NPY2R。研究人员的数据显示,信号依赖的胞吐作用会调节生理和病理背景下的纤毛信号。
5.Cell:垃圾RNA在细胞应激反应中发挥重要作用
doi:10.1016/j.cell.2016.11.041
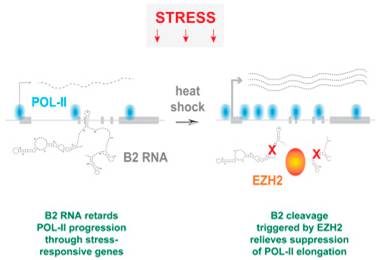
在一项新的研究中,来自美国麻省总医院的研究人员发现了之前被认为是非功能性的“垃圾”RNA分子的一种意想不到的作用:控制细胞对应激作出的反应。他们描述了之前已知抑制基因转录的两个组分---B2 RNA和作为一种之前已知仅沉默基因的酶,EZH2---之间的一种高度特异性的相互作用实际上诱导小鼠细胞应激反应基因表达。
论文通信作者、麻省总医院分子生物学系Jeannie T. Lee博士说,“EZH2是一种被称作多梳抑制复合物2(Polycomb Repressive Complex 2, PRC2)的结构的一部分,其中PRC2沉默靶基因。但是这个领域存在的一个大的悖论是EZH2在有活性的基因和没有活性的基因中都可发现到。我们首次证实EZH2能够在PRC2复合物外面发挥作用:通过另一种机制激活基因---在这项研究中是通过切割B2 RNA来实现的,这种切割随后激活应激反应基因。”
Lee团队成员之前的研究已发现9000多种细胞核转录本结合到EZH2上。它还提示着EZH2与一些重复性RNA---包括由逆转录转座子经过转录而产生的RNA---相互作用,但是在当时,B2 RNA和EZH2之间的结合是否真地存在仍是不清楚的。当前的这项研究旨在探究这种结合是否是真的和有功能性的。他们的实验证实EZH2结合到B2 RNA上,而且当遭受热应激时,还会切割这种RNA分子。切割B2 RNA---当未切割时结合到让细胞避免遭受热休克损伤的基因上,从而关闭这些基因---允许转录这些热休克基因。
6.Cell:将CRISPR和单细胞RNA测序结合在一起分析基因功能
doi:10.1016/j.cell.2016.11.039
哪些突变组合有助癌细胞存活?大脑中哪些细胞参与阿尔茨海默病发生?免疫细胞如何执行它们的复杂决策过程?如今,在一项新的研究中,来自以色列魏兹曼科学研究所等机构的研究人员在一种方法中将两种强大的研究工具--- CRISPR基因编辑和单细胞基因组分析---结合在一起,从而可能最终有助我们解答这些问题和更多的其他问题。
将CRISPR与高分辨率的单细胞RNA测序结合在一起能够让研究人员主动地调整细胞中的基因,然后理解它们在多种条件下在多种细胞中的功能。Amit和他的团队(包括论文第一作者Diego Adhemar Jaitin、Ido Yofe和Assaf Weiner,研究生David Lara-Astiaso)面临的挑战是改编CRISPR基因编辑技术以便它能够与单细胞测序结合在一起使用。Amit团队想象着一次靶向多种基因,包括靶向同一个细胞中的多个靶标,然后鉴定出给细胞带来的变化和这些基因的功能。一方面,这项任务需要开发新的分子技术以便同时鉴定出靶细胞和引入到它们当中的基因组编辑。另一方面,这项任务需要开发新的计算方法来分析具有不同基因型和表型的细胞群体。
研究人员随后遇到一种新的数据类型---伴随着一些遗失的数值。Weiner说,“通过将细胞与类似的行为关联在一起,Netflix算法等被用来将喜欢类似电影的人们进行归类,我们能够鉴定出很多基因之前未被分类的功能。”
7.Cell:揭示KRAS突变促进癌细胞抵抗治疗机制
doi:10.1016/j.cell.2016.11.035
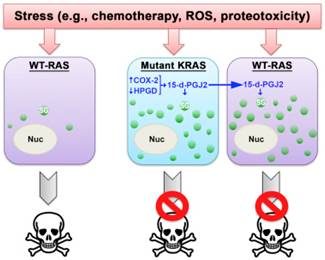
根据一项新的研究,促进一种致命性癌细胞侵袭性生长的信号同样也触发让它很难杀死的应对机制。当遭受应激时,这种癌细胞将它的遗传信息包裹在应激颗粒中,从而降低化疗效果。
在来自美国纽约大学朗格尼医学中心和托马斯杰斐逊大学的两名研究人员的领导下,这项研究以基因KRAS为中心,当这个基因发生变化或突变时,它会触发90%的胰腺癌、很多肺癌和结直肠癌中的异常生长。研究人员说,作为过度活跃的KRAS的第二个后果,携带这种突变的细胞形成更多的应激颗粒。
在实验中,研究人员证实当遭受化疗或奥沙利铂---一种破坏癌细胞DNA的化疗药物---治疗时,携带KRAS突变的细胞制造的应激颗粒数量比不携带这种突变的细胞多6倍。他们也能够捕获从人胰腺瘤切除的癌细胞中的应激颗粒的首批图片,并且对这些应激颗粒进行计数,结果发现显著增加。
这项研究进一步发现在遭受应激下,携带KRAS突变的癌细胞通过更多地产生一种被称作15-脱氧-Δ12,14-前列腺素J2(15-deoxy-delta 12,14 prostaglandin J2, 15-d-PGJ2)的激素样分子而增加应激颗粒的形成。重要地,15-d-PGJ2水平增加会触发更多的应激颗粒形成,而且不仅是在发生KRAS突变的细胞中,而且也是在未发生这种突变的周围细胞中(增加13倍),随后这些细胞对奥沙利铂产生更强的抵抗性。这是因为15-d-PGJ2是细胞分泌出的一种信号分子。
接下来,研究人员计划研究加入一种环氧酶2(COX 2)抑制剂---一种流行的消炎止痛药---到化疗中是否能够改善KRAS突变癌症病人的治疗结果。已知KRAS突变细胞产生额外的COX 2,这会增加15-d-PGJ2水平。
8.Cell:在体内通过部分细胞重编程逆转衰老症状
doi:10.1016/j.cell.2016.11.052
头发变白、眼角鱼尾纹、相比于我们20岁时损伤需要更长的时间来愈合---所面临的这些明显的衰老标志,我们中的大多数人至少梦想过逆转时间。如今,在一项新的研究中,来自美国沙克生物研究所的研究人员发现间歇性表达正常情形下与一种胚胎状态相关联的基因能够逆转老年的特征。相关研究结果发表在2016年12月15日那期Cell期刊上。
研究人员研究了一种罕见的被称作早衰症(progeria)的遗传疾病。患有早衰症的小鼠和人类表现出很多衰老的迹象,包括DNA损伤、器官功能障碍和显著缩短的寿命。再者,DNA上的负责基因调节和保护我们的基因组的化学标记(被称作表观遗传标记)在患有早衰症的小鼠和人类体内过早地发生异常调节。重要的是,表观遗传标记在细胞重编程期间发生修饰。
利用来自患有早衰症的小鼠的皮肤细胞,研究人员短暂地诱导山中伸弥因子表达。当他们利用标准实验室方法研究这些细胞时,它们让多种衰老特征获得逆转,同时不会丧失它们的皮肤细胞身份。
这种方法不仅促进盘碟中的人皮肤细胞再次看起来和表现得年轻,而且也导致患有过早衰老疾病的小鼠焕发青春。它抵抗衰老的迹象,并且将这些小鼠的寿命增加30%。这项早期的研究有助认识衰老的细胞促进物和改善人类健康与寿命的潜在治疗方法。
9.Cell:震惊!单个GATA4基因突变导致两种心脏病类型
doi:10.1016/j.cell.2016.11.033
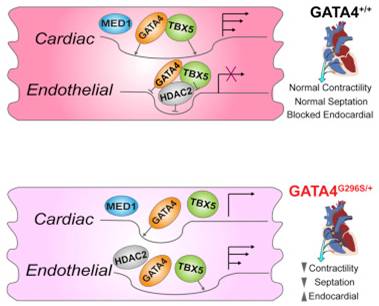
在一项新的研究中,来自美国格拉斯通研究所的研究人员发现单个基因突变与两种心脏病类型---一种心脏病会导致婴儿心脏有孔产生,另一种心脏病导致心力衰竭---存在关联。利用携带这种突变的家庭捐献的细胞,他们对先天性心脏病、人类心脏发育和健康的心脏功能产生新的认识。
先天性心脏病影响将近1%的新生婴儿。在一种特别常见的先天性心脏病类型中,在两个心室之间的隔膜中有孔形成。导致这些隔膜缺陷的一种原因是GATA4基因发生突变,其中GATA4是正常的心脏发育和健康的心脏功能所必需的。GATA4基因编码一种“主调节”蛋白,该蛋白激活或沉默参与心脏发育的其他基因。
这项新的研究涉及一个携带GATA4突变的先天性心脏病病人家庭。2003年,在这个家庭的一半婴儿出生时存在隔膜缺陷之后,该家庭就找到了Srivastava。利用基因测序,研究人员了解到这个先天性心脏病病人家庭的每个成员在GATA4基因上存在相同的突变---该基因中存在的单碱基变化。
7年后,这个家庭的几个成员(如今是青少年)患上一种独特的导致心肌异常泵血的心脏病。研究人员作出结论,相同的GATA4基因突变是这种心肌功能障碍的原因,但是他们不知道为何会这样。
为了解答这个问题,Srivastava团队获取来自这个家庭的皮肤细胞,利用干细胞技术将它们重编程为跳动的心脏细胞。这种技术允许该团队研究与这些病人具有相同遗传组成的心脏细胞以便确定这种GATA4基因突变如何导致这两种心脏病类型。
研究人员注意到利用病人的皮肤细胞经重编程构建出的心脏细胞存在几种异常:这些细胞比正常的心脏细胞跳动得较弱,而且这些细胞的多种基因被异常激活或沉默。比如,参与心脏形成的基因没有合适地开启,包括控制隔膜形成的基因。相比之下,参与其他器官发育的基因被激活,而它们原本应当被沉默。
研究人员发现这种GATA4基因突变阻止另一种主调节蛋白TBX5被招募到心脏发育和心肌收缩所需的基因上。GATA4和TBX5一起激活负责心脏形成和功能的基因,和沉默参与其他器官的基因。然而,如果一种蛋白发生突变,那么另一种蛋白就不会很好地发挥作用。鉴于GATA4基因发生的单个突变,几乎GATA4和TBX5调节的整个基因网络会受到破坏,从而导致疾病产生。有意思的是,人TBX5发生突变也会导致心脏中有孔产生。
10.Cell:揭示糖尿病药物二甲双胍抗癌作用机制
doi:10.1016/j.cell.2016.11.055
相当多的证据已表明50多年来用于治疗2型糖尿病的药物二甲双胍也能够阻止或延缓某些癌症的生长;但是它的抗癌效果背后的机制是未知的。如今,在一项新的研究中,美国麻省总医院(MGH)的研究人员鉴定出一种途径似乎是二甲双胍能够阻断人癌细胞生长和延长秀丽隐杆线虫寿命的基础,这提示着这种基因途径在多种有机体中发挥着重要作用。
他们的实验发现二甲双胍的抗癌作用机制依赖于单个基因途径中的两种组分---允许分子进出细胞核的核孔复合物,以及一种被称作ACAD10的酶。基本上,二甲双胍对线粒体活性的抑制会降低细胞能量产生,从而限制分子穿过核孔。这会关闭一种重要的被称作mTORC1的细胞生长因子,从而导致ACAD10激活。这种激活可延缓秀丽隐杆线虫生长和延长它的寿命。
研究人员在人黑色素瘤细胞和胰腺癌细胞中证实加入二甲双胍会诱导ACAD10表达,这种效果依赖于核孔复合物的功能。如果缺乏这种完整的信号途径---从线粒体抑制到核孔限制再到ACAD10表达,癌细胞不再对二甲双胍类似的药物敏感。
11.Cell: 肠道微生物调节帕金森病的发病过程
doi:10.1016/j.cell.2016.11.018
最近一项研究似乎改变了我们长久以来对帕金森症发病的固有观念。
这项研究认为,帕金森症的病发并不是起始于大脑,而是与肠道微生物有关。这一观点能够解释为什么帕金森症患者会首先出现便秘的症状,十几年之后才会进而产生其它并发症。
事实上,帕金森病也许是从肠道产生,进而蔓延到大脑区域。这也能解释我们在帕金森病人身上观察到的一些奇怪的症状。比如便秘以及其它消化问题,这些问题在运动障碍出现前十年就已经发生。另外,也有证据表明帕金森症患者的肠道微生物菌群结构域正常人群存在明显的区别。
研究者们利用一种叫做"alpha-synuclein"的蛋白质构建了毒性的纤维束,该蛋白在正常的神经细胞中是可溶的,但在帕金森症患者中这些蛋白质将会沉积聚集,从而影响大脑的神经元功能。
在最近的这项研究中,来自加州理工学院的研究者们利用过表达alpha-synuclein蛋白,构建了小鼠帕金森症模型。
之后,作者将这些小鼠分别在正常或无菌的环境中进行培养。
结果显示,无菌环境中成长起来的小鼠其症状相比正常环境中的小鼠要明显轻一些,而且体内的alpha-synuclein毒性蛋白的含量也有明显下降。另外,通过给正常小鼠饲喂抗生素水,也能够达到减轻症状的效果,这说明肠道内生存的微生物也许参与了alpha-synuclein的产生以及帕金森症的发病。
最终,作者通过向小鼠的肠道内注射帕金森症患者的微生物菌群,发现这一处理能够使得小鼠快速产生帕金森症。而来自正常人群的粪便则没有该效果。
因此,科学家们认为肠道微生物或许能够通过释放一些化学信号,从而导致大脑的损伤。
12.Hippo信号通路领域重大发现!管坤良课题组Cell报道Hippo信号通路在肿瘤免疫调节中的重要作用
doi:10.1016/j.cell.2016.11.005
12月1日,Cell最新一期杂志发表了来自加州大学圣地亚哥分校管坤良教授课题组的一篇题为“The Hippo Pathway Kinases LATS1/2 Suppress Cancer Immunity”的重要文章,这项研究也是近两年来Hippo信号通路领域最重大的发现之一。在这项研究之前,研究人员似乎对Hippo信号通路参与调控肿瘤免疫原性并不清楚,在敲除LATS1/2的条件下,小鼠体内能够诱导增强抗肿瘤免疫从而抑制肿瘤的发生,而此前很长一段时间内大多数研究表明Hippo信号通路的失活能诱导部分器官的肿瘤发生,并且此前LATS1/2也被公认为是抑癌基因,而在坤良老师这篇Cell中LATS1/2又表现出具有抑制免疫原性的“癌基因”特性,那事实到底是怎样一回事呢?为此BioArt邀请了多位专家对这项研究进行深入的点评(详见文末),或许专家们的点评会为您解开论文阅读中的一些疑惑。
免疫原性差的肿瘤细胞在宿主免疫防疫的过程中会发生逃逸,当在肿瘤中敲除LATS1/2时,能够刺激核酸富集的胞外囊泡的分泌,然后诱导Toll样受体MYD88/TRIF介导的I型干扰素应答。I型干扰素应答能够刺激宿主免疫反应中的多种成分最终激活T细胞,活化后的T细胞有能够协助肿瘤特异性的细胞毒性T细胞应答和B细胞的抗体产生,最终破坏肿瘤形成。
13.Cell:母亲对孩子的保护从受精卵就已开始
doi:10.1016/j.cell.2016.11.009
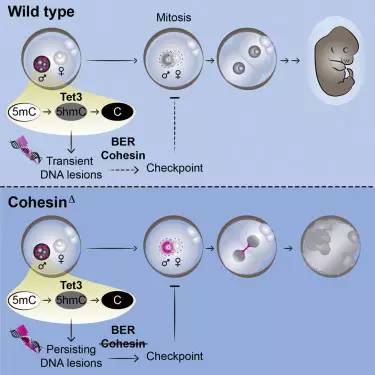
在一项新的研究中,研究人员不仅发现了受精卵细胞如何触发精子来源DNA的表观遗传重编程,还发现该过程受到密切监测来保证胚胎基因组的健全。
“当精子进入卵细胞,紧密包装的雄性染色体需要被彻底打开,在组蛋白形成的蛋白骨架上重新形成新的结构,”文章第一作者Sabrina这样说道。“我们在小鼠的受精卵中发现卵细胞能够非常积极地触发对父亲来源DNA的去甲基化开始表观遗传重编程,这样就可以保证受精卵能够重新开始创造属于自己的表观遗传记忆和生命历史。该过程的发生并非没有危险:去甲基化会引起DNA损伤,这对于新生命来说是非常致命的。这些损伤会导致染色体破裂,引起胚胎致死。”
研究人员发现了一个监控机制,不仅可以检测表观遗传重编程引起的DNA损伤还可以修复损伤。他们发现父亲来源DNA的损伤会激活受精卵的一个“检查点”阻止细胞分裂直到损伤被修复。因此该机制确保了重编程能够在一个细胞周期内完成,但单细胞胚胎阶段保证基因组的健全。
14.Cell:肿瘤干扰素信号调节免疫检查点抑制剂抵抗性
doi:10.1016/j.cell.2016.11.022
一项新的临床前研究提示着一种现存的被称作JAK抑制剂的药物可能有助对所谓的检查点抑制剂免疫治疗药物不作出反应的病人克服这种耐药性。重要地,这些结果证实利用JAK抑制剂关闭在肿瘤对免疫治疗药物产生耐药性中起着至关重要作用的干扰素途径可能改善检查点抑制剂药物的疗效,甚至绕过对这些药物组合使用的需要,其中这种组合使用经常伴随着严重的副作用。
已有研究证实组合使用易普利姆玛(ipilimumab)和派姆单抗(pembrolizumab)等检查点抑制剂,以及加入放疗,会在病人体内引发大有希望的肿瘤反应。但是因为存在其他的未被识别的“车闸”,很多病人仍然不会对这些抑制剂作出反应。
研究人员在乳腺癌和黑色素瘤模式小鼠体内利用多种实验室技术(包括基因编辑工具CRISPR)构建这种未知的抵抗性模型,并且发现在使用或不使用放疗的情形下,利用JAK抑制剂ruxolitinib和针对PD1和/或CTLA4的检查点抑制剂进行治疗会有效地让这些在正常情形下抵抗治疗的小鼠实现完全缓解和长期存活。
抑制这种干扰素途径可能也能够绕过对多种检查点抑制剂的需求:一种检查点抑制剂(抗CTLA4抗体)和JAK抑制剂ruxolitinib导致乳腺癌模式小鼠恢复100%的病情缓解和存活。
作为被美国FDA批准用来治疗骨髓纤维化和牛皮癣的药物,JAK抑制剂靶向得到很好研究的通常被认为是免疫刺激性的干扰素途径。然而,在这项新的研究中,研究人员发现在一段时间之后,干扰素信号在表观遗传上改变对肿瘤中的分子信号作出反应的方式,从免疫刺激性切换为免疫抑制性,类似于在慢性病毒感染中发生的情形。因此,阻断它会关闭小鼠体内的肿瘤耐药性。 Minn说,“令我们吃惊的是,阻断干扰素驱动的耐药性不仅拮抗阻止组合疗法在小鼠体内发挥疗效的多种抑制性途径,而且它也可能提供一种对设计复杂的组合检查点阻断疗法以便解决众所周知的耐药性问题提出挑战的一般策略。”
15.Cell:首次发现肠道微生物运动或会影响宿主的昼夜节律
doi:10.1016/j.cell.2016.11.003

甚至是肠道微生物也有着自己的生活规律,就好像时钟一样,它们会在部分肠道粘膜组织中开始每天的生活,向左或向右移动几微米,随后在回到原来的位置,日前一项刊登于国际杂志Cell上的研究报告中,来自魏茨曼科学研究学院的研究人员通过对小鼠进行研究发现,肠道微生物定期的运动或许会通过将肠道组织暴露于不同微生物或一些代谢产物中,从而影响宿主的昼夜节律。
研究者Eran Elinav说道,这项研究揭示了原核生物和真核生物,以及哺乳动物有机体和寄生在宿主体内的微生物菌群之间行为的互联机制,这些群体之间能够发生相互作用并且被彼此互相影响。此前研究中研究者发现,我们机体的生物钟能够同机体微生物菌群的生物钟协同工作,而且干扰小鼠机体的睡眠模式并且给其多次喂食就能够诱导小鼠机体肠道微生物菌群的行为改变。
昼夜节律钟是机体适应昼夜变化、代谢改变以及进餐时间的一种机体内在机制和适应性表现,其它研究揭示了机体微生物组在代谢变化、机体健康和疾病发生过程中的重要作用,如今本文研究者通过研究首次发现微生物的昼夜节律或许会影响其宿主的昼夜节律。这项研究能在两个重要方面潜在影响人类的健康,首先从从对乙酰氨基酚到化疗药物等多种药物都会在肝脏中进行代谢,因此理解机体微生物菌群的昼夜节律机制或许会影响患者用药的方式和时间;其次,理解宿主和微生物组之间的关系也能够帮助研究人员开发出干预人类多种疾病的新型策略,比如肥胖和代谢综合征等,如今因轮班工作或时差综合征导致昼夜节律被干扰的个体经常会患上肥胖和代谢综合征等多种疾病。
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CEL#
56
#Cell#
61
新突破的
97