病例分享 | 滤泡辅助T细胞淋巴瘤,血管免疫母细胞型
2024-01-31 上海阿克曼病理 上海阿克曼病理 发表于陕西省
血管免疫母细胞性T细胞淋巴瘤(AITL),是一种系统性的外周T细胞淋巴瘤,在2022年的国际共识分类(ICC)中命名为滤泡辅助T细胞淋巴瘤,血管免疫母细胞型。
01 病史介绍
性别:男
年龄:75岁
01 取材部位:
左颈部淋巴结
02 临床表现:
患者发现全身多处淋巴结肿大一月余,伴有皮肤瘙痒。
03 大体所见
灰白灰红色碎组织一堆,共2cmx2cmx0.8cm。
04 镜下形态:
组织零碎,淋巴结结构不清,细胞主要为小至中等大小,弥漫或结节状生长,细胞核圆形为主,部分呈多形性,染色质粗颗粒状,胞浆较丰富,淡染或透明。见周围脂肪浸润。可见血管增生,血管内皮细胞增生,部分呈分支状。
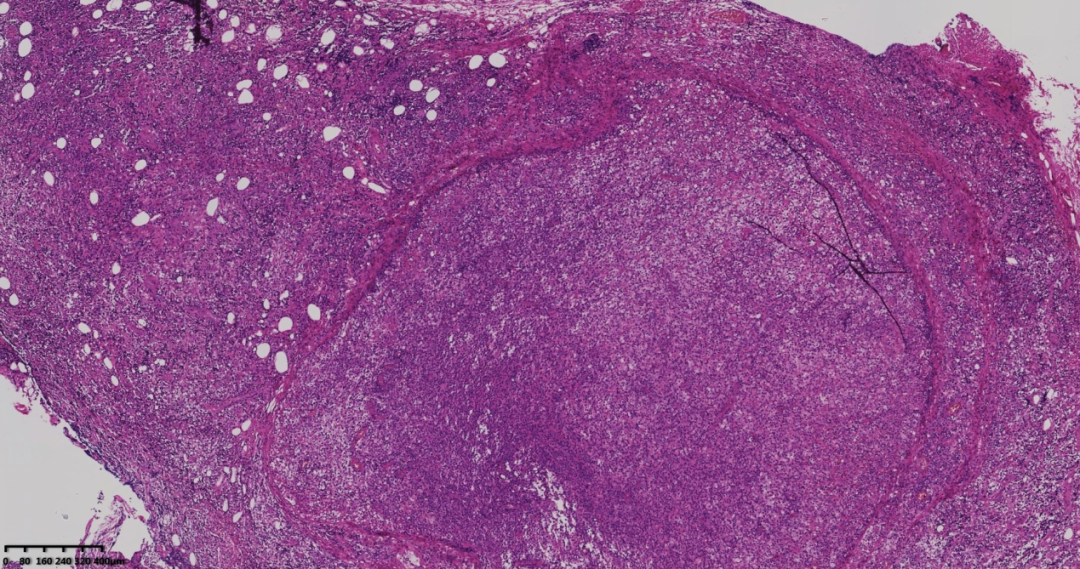
图1 低倍镜下肿瘤呈结节状、弥漫状生长,纤维间质增生,可见斑驳的染色透亮区。
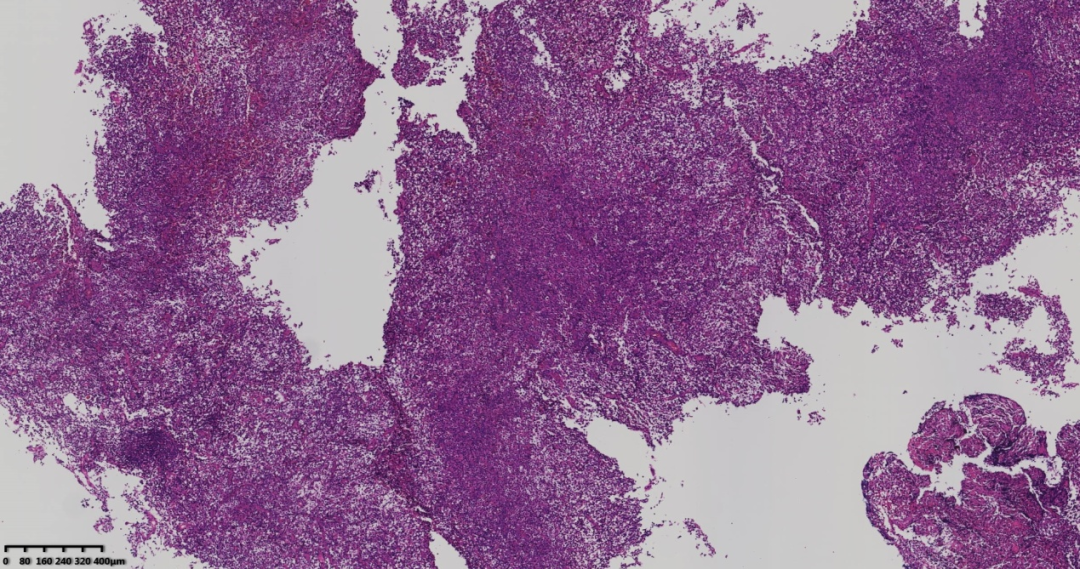
图2 低倍镜肿瘤弥漫状,滤泡结构不清,可见斑驳淡染区及深染区。
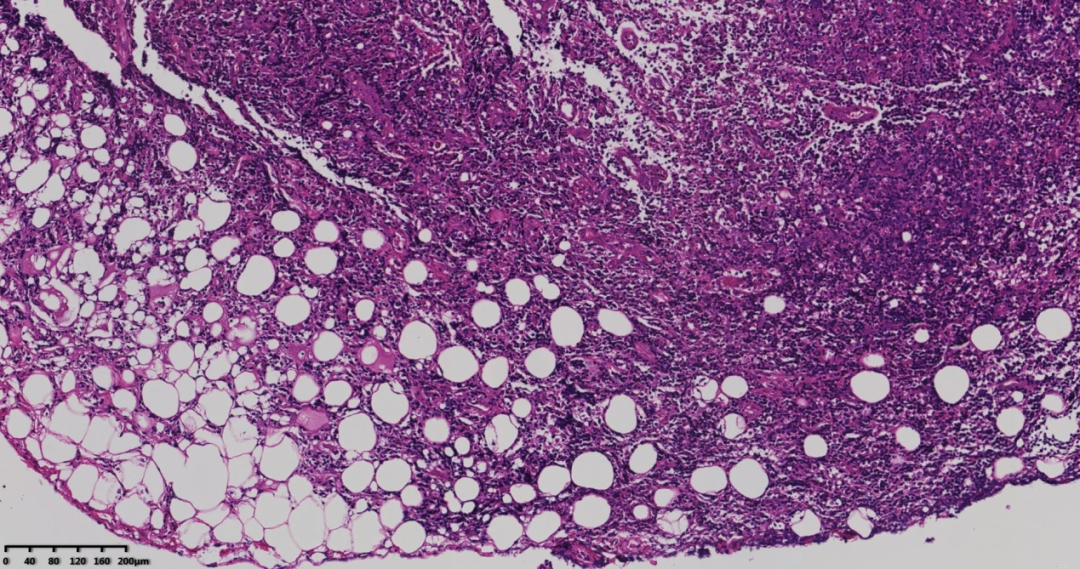
图3 低倍镜肿瘤侵及周边脂肪,肿瘤间小血管增生。
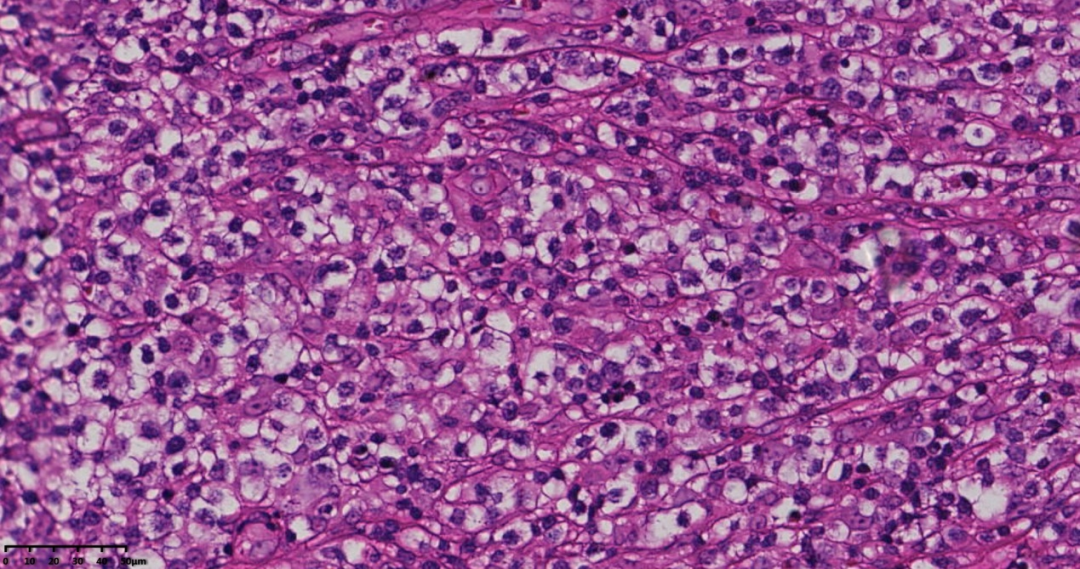
图4 高倍镜见肿瘤细胞胞浆透明,核居中,圆形、多形性,见免疫母细胞,间质血管增生。
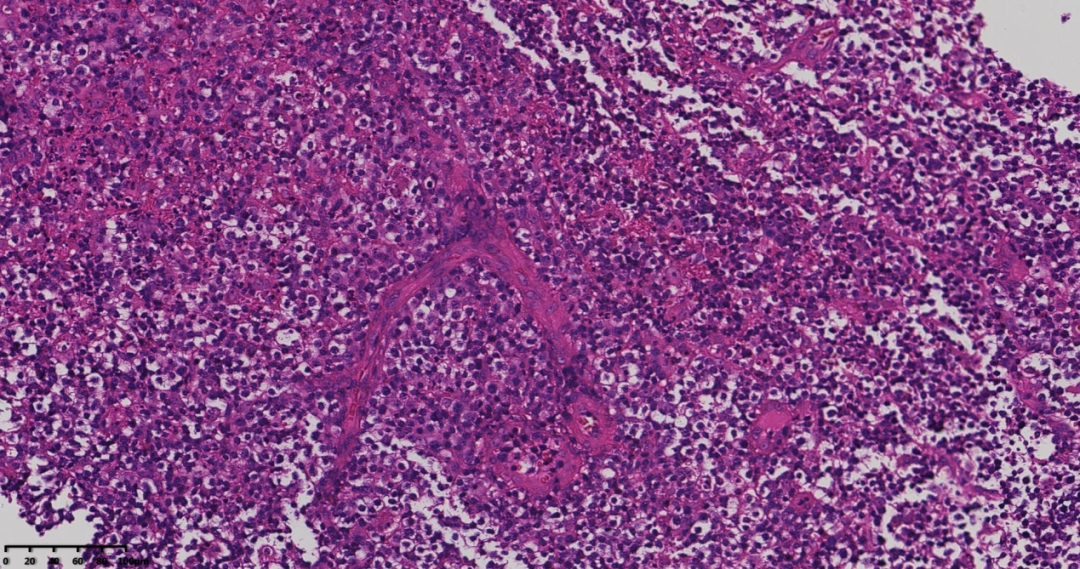
图5 高倍镜肿瘤间分支状高内皮小静脉。
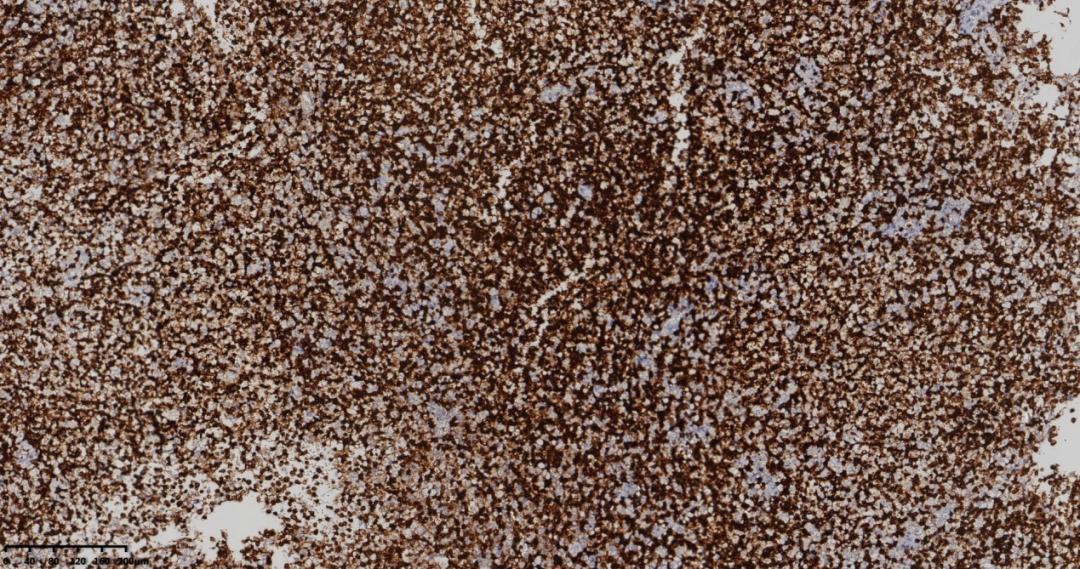
图6 免疫组化CD3阳性。

图7 免疫组化CD4阳性。
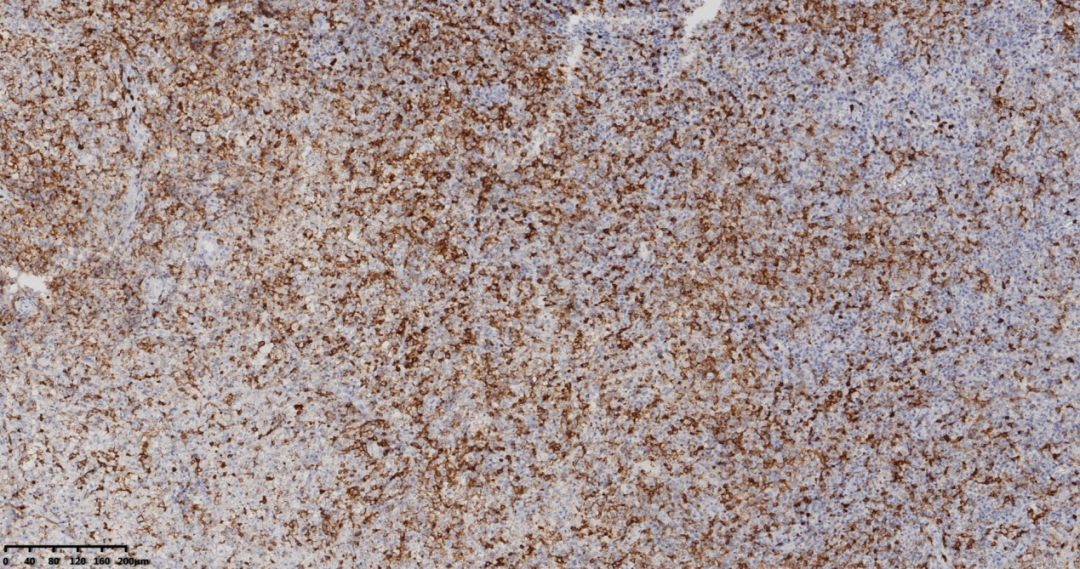
图8 免疫组化CD10阳性。

图9 免疫组化CD20阴性。
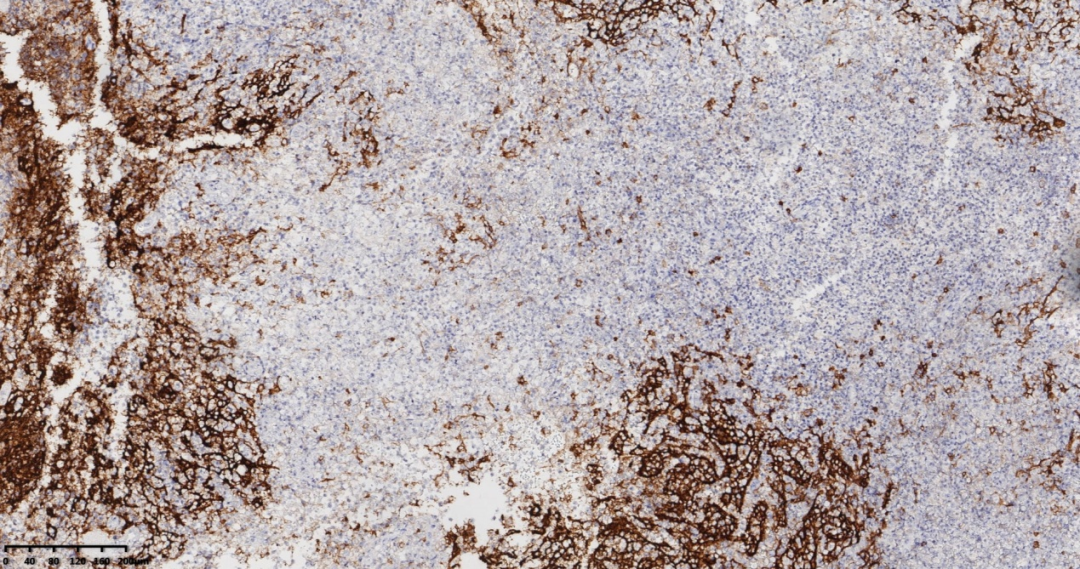
图10 免疫组化CD21,FDC网包绕高内皮小静脉增生。

图11 免疫组化Bcl-6阳性。

图12 免疫组化PD1阳性。
05 免疫组化染色结果:
LCA(+)、CD3(+)、CD5(+)、CD20(-)、PAX5(-)、CD21、Ki-67(+,约70%)、CD10(+)、CD4(+)、PD-1(+)、Bcl-6(+)、ALK(-)、CD30(+)、CD8(-)。
06 最终诊断:
滤泡辅助T细胞淋巴瘤,免疫母细胞型。
02 讨论
血管免疫母细胞性T细胞淋巴瘤(AITL),是一种系统性的外周T细胞淋巴瘤,在2022年的国际共识分类(ICC)中命名为滤泡辅助T细胞淋巴瘤,血管免疫母细胞型。AITL表现为进展期疾病,患者通常表现为晚期疾病(III/IV期)。好发于中老年人,没有明显的性别倾向,是外周T细胞淋巴瘤比较常见的特殊类型之一,约占15%-20%,占非霍奇金淋巴瘤的1%-2%。B症状和淋巴结病是最常见的表现(~70-90%)。原发部位为淋巴结,纵隔和腹膜后淋巴结的常见受累,几乎所有患者表型为全身淋巴结肿大,并常常累及脾、肝、皮肤和骨髓。表现为肝脾肿大(约50%-80%),广泛的皮肤表现(~20-50%)。其他还包括空腔积液(~40%)、关节炎和腹水。患者由于肿瘤而继发免疫缺陷。约75%病例可见EBV(+)的B细胞扩张,认为是免疫功能紊乱的结果。
01 基本特征
来源于CD4+T滤泡辅助细胞(TFH)的结节性成熟T细胞淋巴瘤,混合了反应性细胞的多形性浸润和高内皮小静脉和滤泡树突状细胞的显著增殖。
02 组织学特征
◆ 淋巴结:
-
部分或全部结构消失,有三种形态学模式:
模式I:结构部分保留,增生的滤泡伴有明显的巨噬细胞和模糊的套区。
模式II:结构大多保留,有残留滤泡。
模式III:结构完全消失,没有残留滤泡。
-
AITL细胞较少,位于高内皮小静脉(HEV)附近或滤泡周围,表现为细胞小到中等大小,细胞质透明和轻微的异型性,细胞质透明约见于30%的病例。
-
由反应性淋巴细胞、组织细胞、嗜酸性粒细胞、浆细胞、反应性B细胞、Reed-Sternberg样细胞、免疫母细胞和滤泡树突状细胞组成的多形性炎症背景。
◆ 外周血
-
价值有限
-
淋巴细胞减少
-
明显受累的病例通常显示由少数非典型细胞、淋巴浆细胞、免疫母细胞、颗粒淋巴细胞和浆细胞组成的多态性淋巴群;肿瘤细胞是大小不等的淋巴细胞,细胞核规则或轻微凹陷,染色质适度浓缩,核仁小或模糊,细胞质丰富嗜碱性。
-
高丙种球蛋白血症的病例可能表现为rouleaux形成。
◆ 骨髓
-
骨髓抽吸物不是诊断的最佳选择:非典型淋巴细胞很少或缺失。
-
在活检中通常有多灶性和不明确的结节型。
罕见小梁旁型。
少数病例表现为高内皮小静脉、基质水肿或明显血窦
-
异质性细胞背景
-
噬血细胞综合征很罕见
-
网状纤维染色通常在淋巴细胞丰富区被破坏。
◆ 皮肤
-
广泛的组织学表现
血管炎更常见
表皮下、血管周围、附属器周围带状或弥漫性浸润
不存在趋表皮性
03 免疫组化阳性指标
◆ T细胞:
εCD3, CD4; CD5 和 CD7。
◆ 滤泡树突状细胞:
CD21、CD23、CD35突出显示扩张和扭曲的滤泡树突状细胞网,其中CD21与CD23相比,鉴定滤泡树突状细胞的更可靠。
◆ 滤泡辅助T细胞:
-
CXCL13和CD10:
两者都具有良好的特异性和低灵敏度
CXCL13比CD10更具特异性
在骨髓受累病例中的作用有限,但在其他结外部位有用
与CD10相比,皮肤受累的病例显示出更多的CXCL13阳性
CXCL13具有点状强化图案的细胞质
-
PD-1(CD279)和ICOS(CD278):
灵敏度好,但不太具体,PD-1高度依赖于组织固定。
-
BCL6, CD200, CXCR5, cMAF, SAP, TIGIT, CD27
◆ EBER原位杂交:
见于60-90%的病例,通常在分散的B细胞和免疫母细胞上呈阳性。
◆ CD30:
约20%病例阳性。
04 免疫组化阴性指标
-
T细胞标志物异常丢失,如CD7、CD8。
-
B细胞标记,如CD20, PAX5, CD79a。
05 分子遗传学
◆ 90%的病例存在核型异常:
-
3、5和19号染色体三体
-
X染色体多体
◆ 比较基因组杂交:
22q、19和11p11-q14(11q13)增益和13q缺失。
◆ 可存在TCR基因重排。
◆ IGH基因重排存在于病例中(约30%)。
◆ 罕见ITK/SYK易位。
◆ 基因突变:
-
TET2:约40-80%的病例,通常为2个或更多突变。与疾病晚期、血小板减少症、高国际预后指数(IPI)和较短的无进展生存期相关。
-
DNMT3A:约20-40%的病例,与老年相关,通常与TET2突变有关。
-
IDH2-R172:约20-30%的病例,独特特征,诱导基因启动子的DNA超甲基化。
06 预后
临床过程为侵袭性,中位总生存期:18-29个月。1年、3年和5年的总生存率分别为66%、64%和32%。5年无进展生存率18-38%。
与总生存期缩短相关的因素有:高风险分级、腹水、血小板减少症、低白蛋白血症、肾功能衰竭、循环非典型细胞、高尿酸血症、X染色体多体。
07 鉴别诊断
① 反应性淋巴组织增生
AITL的 I型显示与反应性淋巴增生的形态学重叠,然而,滤泡间扩大是突出的表现。
尽管单克隆T细胞群支持T细胞淋巴瘤的诊断,但反应性过程也可能显示单克隆T细胞,并可能导致假阳性诊断。皮质旁滤泡树突状细胞扩张和内皮小静脉高增殖的缺失有利于反应性淋巴组织增生的诊断。
② 经典霍奇金淋巴瘤,混合细胞型
缺乏非典型CD10+TFH细胞、增生的高内皮小静脉和滤泡树突状细胞。经典霍奇金淋巴瘤中Reed-Sternberg细胞CD30阳性及PAX5弱共表达,CD20阴性或可变。无异常T细胞免疫表型或单克隆T细胞重排。
③ 富含T细胞/组织细胞的大B细胞淋巴瘤
正常T细胞背景中的大B细胞,缺乏滤泡树突状细胞增殖和高内皮小静脉。通常显示IGH基因重排。
④ 滤泡性外周T细胞淋巴瘤
显著的卵泡型,TFH表型,滤泡树突状细胞和高内皮小静脉缺失。
⑤ EBV+弥漫性大B细胞淋巴瘤,NOS
这两种病变都可能表现为Reed-Sternberg样细胞和EBV+大B细胞的多形性浸润。无免疫缺陷或免疫失调史,滤泡树突状细胞增殖和高内皮小静脉缺失,NFκB 和JAK / STAT通路激活。
参考文献
[1] Campo E, Jaffe E S,Cook J R , et al. The International Consensus Classification of Mature Lymphoid Neoplasms: a report from the Clinical Advisory Committee[J]. Blood, 2022 Sep 15;140(11):1229-1253.
[2] 周小鸽,陈辉树.造血与淋巴组织肿瘤WHO分类[M].北京:诊断病理学杂志社,2011:556-558.
[3] Lunning M A,Vose J M.Angioimmunoblastic T-cell lymphoma: the many-faced lymphoma[J]. Blood, 2017 Mar 2;129(9):1095-1102.
[4] Chiba S, Sakata-Yanagimoto M. Advances in understanding of angioimmunoblastic T-cell lymphoma[J]. Leukemia. 2020; 34(10): 2592–2606.
[5] Khokhar F A, Payne W D,Talwalkar S S , et al. Angioimmunoblastic T-cell lymphoma in bone marrow: a morphologic and immunophenotypic study[J]. Hum Pathol. 2010 Jan;41(1):79-87.
[6] Attygalle A D, Cabeçadas J, Gaulard P, et al. Peripheral T-cell and NK-cell lymphomas and their mimics; taking a step forward - report on the lymphoma workshop of the XVIth meeting of the European Association for Haematopathology and the Society for Hematopathology[J]. Histopathology. 2014 Jan;64(2):171-99.
[7] Stacchini A, Demurtas A, Aliberti S, et al. The usefulness of flow cytometric CD10 detection in the differential diagnosis of peripheral T-cell lymphomas[J]. Am J Clin Pathol. 2007 Nov;128(5):854-64.
[8] Thorns C, Bastian B, Pinkel D, et al. Chromosomal aberrations in angioimmunoblastic T-cell lymphoma and peripheral T-cell lymphoma unspecified: A matrix-based CGH approach[J]. Genes Chromosomes Cancer. 2007 Jan;46(1):37-44.
[9] Odejide O,Weigert O, Lane A A, et al. A targeted mutational landscape of angioimmunoblastic T-cell lymphoma[J]. Blood.2014 Feb 27;123(9):1293-6.
[10] Lachenal F, Berger F, Ghesquières H, et al. Angioimmunoblastic T-cell lymphoma: clinical and laboratory features at diagnosis in 77 patients[J]. Medicine (Baltimore). 2007 Sep;86(5):282-292.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#滤泡辅助T细胞淋巴瘤# #血管免疫母细胞型#
54