Scientific Reports:利用鱼眼模型研究人类先天性失明
2017-04-05 MedSci MedSci原创
新生儿因病变或基因突变引起的视力缺陷可能导致先天性失明。其中,莱伯先天性黑内障(LCA)是儿童失明的最常见的原因之一,约占总的视力障碍的5%。当父母双方都拥有至少一个与眼睛发育相关的基因拷贝不正常时,这种基因可以遗传给孩子。然而,疾病背后的分子机制仍不清楚。目前发育神经生物学学院的OIST研究人员已经在斑马鱼中发现了类似的综合征,为研究人类疾病提供了一个很好的模型。研究人员旨在揭示斑马鱼疾病背后的
新生儿因病变或基因突变引起的视力缺陷可能导致先天性失明。其中,莱伯先天性黑内障(LCA)是儿童失明的最常见的原因之一,约占总的视力障碍的5%。当父母双方都拥有至少一个与眼睛发育相关的基因拷贝不正常时,这种基因可以遗传给孩子。然而,疾病背后的分子机制仍不清楚。目前发育神经生物学学院的OIST研究人员已经在斑马鱼中发现了类似的综合征,为研究人类疾病提供了一个很好的模型。研究人员旨在揭示斑马鱼疾病背后的原因,为人类LCA的治疗提供新的线索。这项研究发表在Scientific Reports上。
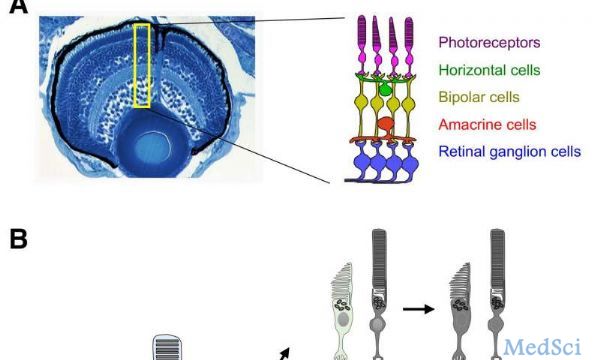
LCA影响视网膜,视网膜居于眼球壁的内层,是一层透明的薄膜,可以检测光线并区分颜色,并通过视神经信息传达给大脑。健康的视网膜通常具有感光细胞--光感受器--包括视锥细胞和视杆细胞。视锥细胞对亮光敏感,而且可以分辨颜色。视杆细胞可以感觉暗淡的光,其分辨率比较低,而且不能分辨颜色。这就是为什么我们在晚上只能看到黑白的原因。LCA患者的视锥细胞和视杆细胞表现出变形或缺失,从而防止光的检测。与人和小鼠中的LCA相关联的基因共有24个,包括Aipl1基因--芳烃受体相互作用蛋白1。当一种基因内的DNA突变影响正常的眼部发育或诱导光感受器--视锥细胞和视杆细胞--退化时,就会发生这种疾病。
OIST科学家选择斑马鱼作为动物模型,因为其视网膜富含锥细胞,其视力可以用简单的装置测量。研究人员研究了一种遗传突变的斑马鱼胚胎,其对视觉刺激没有反应。他们发现斑马鱼DNA含有两个Aipl1基因,即Aipl1a和Aipl1b,它们分别在视杆细胞和视锥细胞中起作用。Aipl1b DNA序列突变称为淘金(gosh),可以使锥细胞感受器中Aipl1的活性丧失,导致锥细胞感光体变形和持续退化。然而,视杆细胞不受影响,表明退化是锥细胞特有的。
研究人员进一步探索发现,Aipl1对于两种酶的稳定性至关重要,即cGMP-磷酸二酯酶6和鸟苷酸环化酶--二者介导光转导,将光信号转化为电信号。没有这些酶,斑马鱼不能对光刺激做出反应,因为信息在光感受器中停止,并且不能通过视神经启动视觉信息传递到脑中。
研究表明,Aipl1b基因对于斑马鱼中锥形光感受器的视觉功能和维持是重要的。没有它,锥体在发育过程中不会发现光的刺激和退化,这为人类疾病治疗提供了线索。本研究的第一作者Maria Iribarne博士评论说:"gosh突变体是理解锥细胞死亡的分子和细胞机制以及人LCA的病理过程的良好模型。希望这种新知识将有助于为患有如LCA这样毁灭性疾病的患者找到未来的治疗方法。
原文出处:
此文系梅斯医学(MedSci)原创编译整理,转载须授权!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#眼模型#
63
#先天性#
56
#SCIE#
53