ViiV Healthcare宣布美国FDA已核准用于预防HIV的首个长效针剂Apretude(卡博特韦缓释注射混悬液)
2021-12-23 国际文传 网络
每年仅需注射6针,即可有效降低HIV感染风险,优于每日口服PrEP药物(FTC/TDF片剂)
葛兰素史克(GlaxoSmithKline plc, GSK)控股、辉瑞(Pfizer Inc.)和盐野义(Shionogi Limited)参股的全球性HIV特药公司ViiV Healthcare今天宣布,美国食品药品管理局(FDA)已核准用于降低HIV-1性传播感染风险的暴露前预防(PrEP)药物Apretude长效针剂。该长效针剂获准用于起始用药前HIV-1检测呈阴性、体重为35千克及以上的HIV性传播感染高危成人和青少年。该药物在研究阶段的受试人群包括与男性有性行为的男性、与男性有性行为的女性和跨性别女性,此类人群通过性行为感染HIV的风险较高。
卡博特韦(Cabotegravir)长效PrEP为针剂,每年仅需注射6针,起始用药为600毫克(3毫升)单次注射,连续两个月注射,两次注射之间间隔1个月。第二次起始注射后,推荐的持续注射剂量为600毫克(3毫升)单次注射,随后每两个月注射一次。首次注射前约一个月可给予Vocabria(卡博特韦口服片剂),以评估该药的耐受性。
ViiV Healthcare首席执行官Deborah Waterhouse表示:“HIV易感人群,尤其是受影响格外严重的美国黑人和拉丁裔群体,可能需要除每日口服药物以外的其他选项。这也是ViiV Healthcare感到自豪的原因,Apretude在迄今为止极其多样化和全面的HIV预防试验项目中得到了研究,其中还包括与曾经参加过一项HIV预防试验的男性有过性行为的例数最多的跨性别女性和黑人男性人群。Apretude每年仅注射6针即可降低HIV感染风险。如今的核准是ViiV Healthcare致力于开发向消费者提供不同选择的长效药物的最新例证。”
美国FDA核准的依据是两项国际性IIb/III期多中心、随机、双盲、活性对照试验HPTN 083和HPTN 084的结果,上述试验评估卡博特韦长效PrEP对通过性传播感染HIV的高危人群、HIV阴性的、与男性有性行为的男性、跨性别女性、顺性别女性的有效性和安全性。上述试验合计纳入13个国家的7,700多例参研者,在显示卡博特韦长效PrEP在预防参研者感染HIV方面优于每日口服恩曲他滨/富马酸替诺福韦二吡呋酯(TDF/FTC)片剂后,独立数据安全性监测评审团提前终止了上述两项试验的双盲、随机部分。在HIV发病率方面,接受卡博特韦长效PrEP的临床试验参研者比HPTN 083试验中的FTC/TDF片剂组低69%,比HPTN 084试验中的FTC/TDF片剂组低90%。
在接受卡博特韦长效PrEP的临床试验参研者中,至少1%观察到不良反应(所有级别),其中最常见的不良反应包括注射部位反应、腹泻、头痛、发烧、疲乏、睡眠障碍、恶心、头晕、胀气、腹痛、呕吐、肌痛、皮疹、食欲减退、嗜睡、背痛和上呼吸道感染。在不良事件所致停药率方面,HPTN 083为6%,HPTN 084为1%。
HPTN 083试验中的美国参研者包括黑人/非裔美国人和拉丁裔群体中与男性有性行为的男性和跨性别女性,他们受到HIV传播的严重影响,在HIV新诊断中占比最高。HPTN 084试验中的所有参研者均为撒哈拉以南非洲的顺性别女性。该地区女性遭受HIV传播的严重影响,HIV感染几率可能是当地男性的两倍。
华盛顿健康研究所(Washington Health Institute)研究主任Richard Elion, MD表示:“我们拥有各种工具,可通过实施有效的抗逆转录病毒治疗和HIV预防来终结HIV传播。PrEP对保护人们免于HIV感染发挥了至关重要的作用。每两个月注射一次的卡博特韦长效PrEP可以预防HIV,因此除了日常用药之外,人们现在拥有了重要的新选择。该长效药为预防HIV提供了更多选择。现在医疗提供机构和患者拥有了多种选择,能够根据每位患者的具体情况选择最优方法。”
HIV仍然是全球性的公共卫生危机,据估计全球约有3,800万人感染HIV,每年有170万新病例。除了HIV抗逆转录病毒疗法外,PrEP同样是一种减少HIV新发病例的有效工具,将有助于终结HIV传播。然而,在美国有望受益于PrEP的人士中,目前正在用药者不到25%。尽管每日口服PrEP的可及性很高,但可能受制于依从性不一以及导致关键人群利用率低下的结构和文化障碍。
TruEvolution执行董事兼首席执行官Gabriel Maldonado, MBA表示:“许多HIV易感者生活方式复杂,很难每天服用HIV预防药。这可能包括病耻感、害怕被人意外知道自己在服药、以及其他日常生活中的一般困难。上述问题汇总起来可能导致PrEP用药率低和HIV的大范围传播。我们的社区迫切需要额外的HIV预防选项来满足上述人群不断变化的需求,而卡博特韦长效PrEP是一个令人振奋的新选项,能帮助他们降低HIV感染风险。”
ViiV Healthcare将于2022年初开始向美国的批发商和专业分销商供应Apretude。ViiV Healthcare已向其他监管部门启动报批。Apretude尚未在美国以外的任何地方获得核准或许可用于HIV预防。
关于HPTN 083 (NCT02720094)
HPTN 083试验是一项IIb/III期双盲非劣效性试验,旨在比较每8周给药一次的卡博特韦长效针剂与每日口服FTC/TDF片剂(200毫克/300毫克)相比在预防HIV方面的安全性和有效性。该试验包括测试长效卡博特韦优于TDF/FTC的预设功能。试验设计还包括肌注给药前的口服导入期,以评估卡博特韦的耐受性。每例参研者将接受最多三年的盲态试验用药。该试验于2016年11月开放入组。HPTN 083的受试者为4,566例HIV阴性人群,包括:与男性有性行为的男性;以及与男性有性行为的跨性别女性,有证据表明这些男性的行为使之面临通过性途径感染HIV-1的很高的风险。该试验在阿根廷、巴西、秘鲁、美国、南非、泰国和越南的研究中心开展1。
研究发现,长效卡博特韦在预防试验人群感染HIV方面优于每日口服 FTC/TDF。在接受长效卡博特韦的受试者中,至少1%观察到不良反应(所有级别),其中最常见的不良反应有注射部位反应、腹泻、头痛、发烧、疲乏、睡眠障碍、恶心、头晕、胀气和腹痛。如需了解有关HPTN 083的更多信息,请访问https://clinicaltrials.gov/ct2/show/NCT02720094.
关于HPTN 084 (NCT03164564)
HPTN 084试验是一项IIb/III期双盲优效性试验,在3,224例HIV感染的高危顺性别女性中比较每8周给药一次的卡博特韦长效针剂与每日口服FTC/TDF片剂(200毫克/300毫克)相比在预防HIV方面的安全性和有效性。试验设计包括肌注给药前的口服导入期,以评估卡博特韦的耐受性。HPTN 084于2017年11月开放入组,目前正在博茨瓦纳、肯尼亚、马拉维、南非、斯威士兰、乌干达和津巴布韦的研究中心开展2。
研究发现,长效卡博特韦在预防试验人群感染HIV方面优于每日口服FTC/TDF。在接受长效卡博特韦的受试者中,至少1%观察到不良反应(所有级别),其中最常见的不良反应有注射部位反应、腹泻、头痛、疲乏、睡眠障碍、恶心、头晕、腹痛、呕吐、肌痛和皮疹。如需了解更多信息,请访问https://clinicaltrials.gov/ct2/show/NCT03164564。
Apretude(卡博特韦200毫克/毫升缓释注射混悬液)的适应证和重要安全性信息
Apretude是一种HIV-1整合酶链转移抑制剂(INSTI),适用于体重至少35千克的高危成人和青少年进行暴露前预防(PrEP),以降低HIV-1性传播感染的风险。在开始采用Apretude进行HIV-1 PrEP之前(有或没有口服卡博特韦的口服导入),个体HIV-1检测结果须为阴性。由医疗保健专业人员在患者臀部肌肉进行Apretude 600毫克(3毫升)肌内(IM)单次注射给药,每两个月一次。
警告:在漏诊的HIV-1感染者中使用APRETUDE进行HIV-1暴露前预防(PrEP)存在耐药风险
有关黑框警告的全部内容,请参阅完整的处方信息。
在开始注射Apretude或口服卡博特韦之前,及Apretude每次后续注射时,须采用FDA核准或认可的检测方法对个体进行HIV-1感染检测,以诊断有无急性或原发性HIV-1感染。漏诊的HIV-1感染者使用Apretude进行HIV-1 PrEP后,已查出有HIV-1耐药变异株。除非确认感染状态为阴性,否则不得启用Apretude进行HIV-1 PrEP。个体若在接受Apretude进行PrEP的过程中感染HIV-1,必须转为完整的HIV-1治疗方案。
禁忌症
- HIV-1状态未知或阳性。
- 既往对卡博特韦有超敏反应。
- 与有可能导致卡博特韦血浆浓度大幅降低的药物合用。
警告及注意事项
- 使用APRETUDE进行HIV-1 PrEP可降低HIV-1感染风险,并可作为降低HIV-1感染风险的综合处治的一部分。
- 个体若在接受Apretude之前或期间或Apretude停药后感染HIV-1,有可能发生对Apretude的耐药反应。每次注射前应再次评估HIV-1感染风险并进行检测,以确认HIV-1阴性状态。
- 卡博特韦的残留浓度可能会在个体的体循环中保留长达12个月或更长时间。
- 与其他整合酶抑制剂有关的超敏反应已有报告。若出现超敏反应的体征或症状,应立即停用Apretude。
- 卡博特韦用药患者出现肝脏毒性已有报告。应考虑临床和实验室监测。若怀疑有肝脏毒性,应停用Apretude。
- Apretude用药中出现抑郁已有报告。建议对抑郁症状进行及时评估。
不良反应
在接受Apretude的受试者中,至少1%观察到不良反应(所有级别),其中最常见不良反应有注射部位反应、腹泻、头痛、发烧、疲乏、睡眠障碍、恶心、头晕、胀气、腹痛、呕吐、肌痛、皮疹、食欲减退、嗜睡、背痛和上呼吸道感染。
要报告疑似不良反应,请致电1-877-844-8872联系ViiV Healthcare,或致电1-800-FDA-1088或访问www.fda.gov/medwatch联系FDA
药物相互作用
- 如需了解Apretude的重要药物相互作用,请参阅完整的处方信息。
- 能够诱导尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1)的药物可能大幅降低卡博特韦的血浆浓度。
特殊人群用药
- 哺乳期:由于潜在的不良反应和停药后体循环中残留浓度可长达12个月或更长时间,应权衡母乳喂养期间使用Apretude对婴儿的收益风险比。
- 儿科:体重小于35千克的个体不建议使用。
请参阅完整的处方信息。
商标归ViiV Healthcare集团公司所有或已获许可。
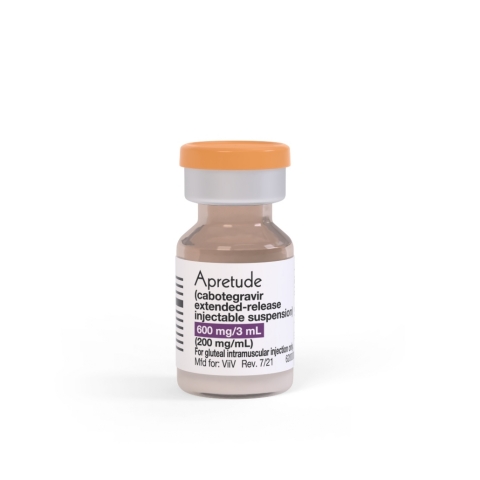
Apretude(卡博特韦缓释注射混悬液)(照片:美国商业资讯)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#长效针剂#
52
#RET#
61
#ALT#
65
#HCA#
43
#美国FDA#
53
#Health#
57
学会学习学习学习学习学习学习学习学习学习学习学习学习学习学习
55