J Exp Clin Cancer Res:邢晓芳/季加孚教授发现胃癌治疗的可能新靶点
2024-08-22 转化医学网 转化医学网 发表于威斯康星
8月20日,邢晓芳/季加孚教授领衔的研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“T
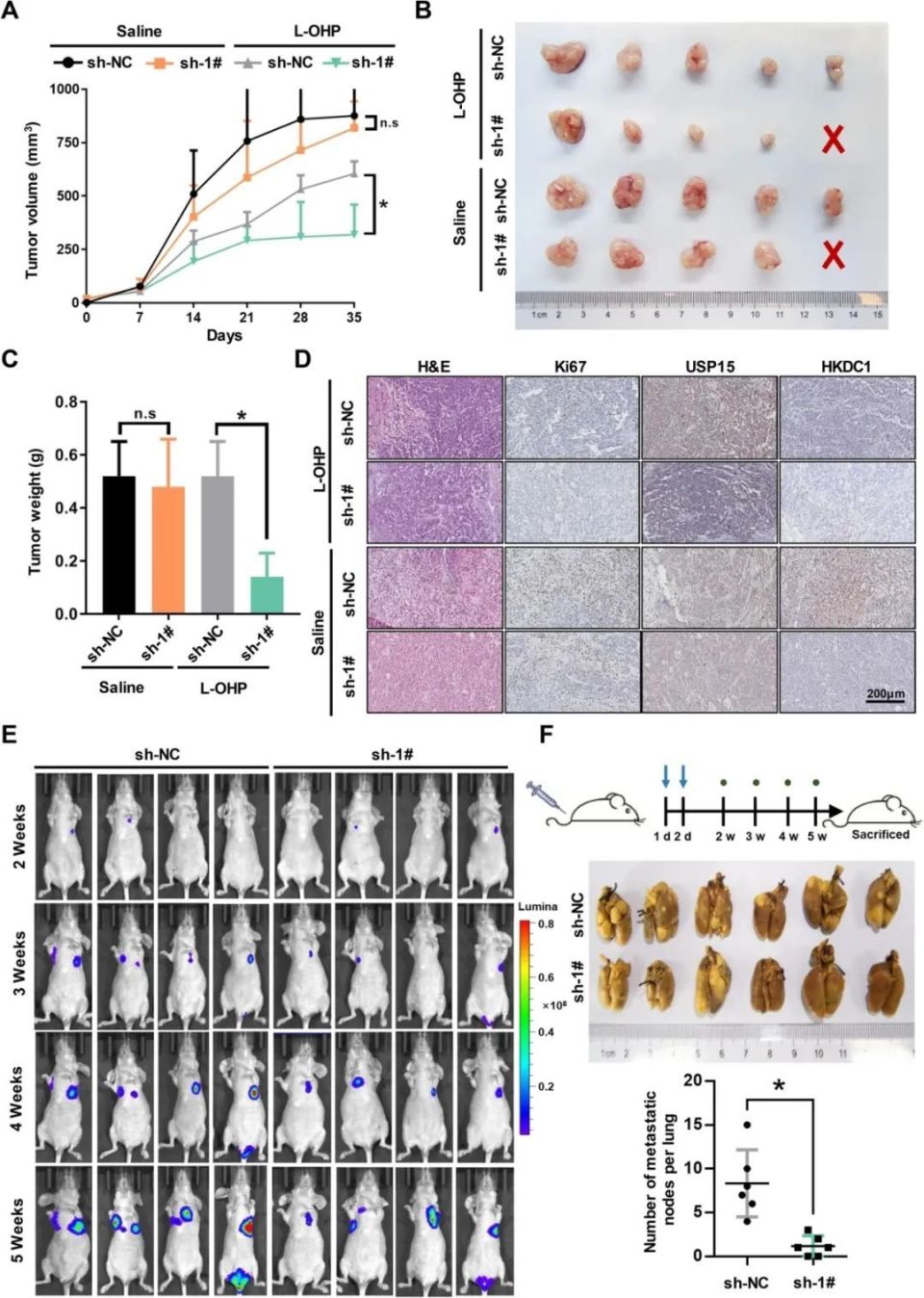
8月20日,邢晓芳/季加孚教授领衔的研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“The deubiquitinase USP15 drives malignant progression of gastric cancer through glucose metabolism remodeling”,本研究中,研究人员发现USP15敲低显著抑制了异种移植模型中细胞增殖、侵袭、上皮间质转化和远端定植能力,同时增强了奥沙利铂的抗肿瘤作用。USP15参与了糖酵解调节因子的泛素化修饰。沉默USP15抑制了糖酵解活性并损害了线粒体功能。干扰USP15表达在体内逆转了肿瘤进展和远端定植。研究人员发现USP15与HKDC1和IGF2BP3存在核心相互作用,其中HKDC1被鉴定为USP15的泛素化修饰底物,USP15通过抑制HKDC1的泛素化降解来调节葡萄糖代谢活性。总之,本研究发现,在GC肿瘤组织中USP15的表达异常升高,与恶性进展和对新辅助治疗的耐药相关。如果开发出USP15抑制剂,它们可以通过改变葡萄糖代谢来促进化疗的效果。 背景知识 胃癌是全球最常见的恶性肿瘤之一,在发展中国家发病率和死亡率位居第三。根据2022年全球癌症观察站的数据,仅在中国就有约47.8万例新发胃癌病例和37.4万例死亡病例,这使得胃癌的预防和控制成为一大挑战。由于早期缺乏典型的症状,大多数患者在确诊时已是晚期,错过了传统治疗的最佳时机。目前,临床上正转向术前治疗(NAT)以实现肿瘤缩小和抑制转移,从而为后续手术和局部化疗放疗提供便利。然而,胃癌术前治疗在临床实践中的普及并不顺利,主要原因是治疗药物种类有限、患者差异较大以及毒性副作用的不良影响。因此,迫切需要扩大治疗药物的发展途径,并为胃癌寻找新的治疗靶点。 异常的泛素化修饰系统与恶性肿瘤的发生和发展密切相关。最近,越来越多的证据表明,泛素特异性蛋白酶(USPs)是最大的去泛素酶亚家族,在胃癌(GC)中发挥着重要作用。例如,USP3、USP5、USP13、USP15、USP21、USP22和USP35在GC中上调,可作为GC患者的独立预后标志物。USP15是USP家族中最重要的成员之一,已被发现在许多肿瘤中存在扩增,包括GC。USP15与E3连接酶TRIM21相关联,并控制ASCL4的稳定性,以维持胃肠间质瘤(GIST)的伊马替尼敏感/耐药状态。在前一项研究中,研究人员证明了USP15在GC中的表达受miR-26a信号通路的调控,这可能是USP15异常高表达的主要原因。然而,USP15在GC中的下游功能和核心机制尚不清楚。 敲低USP15增强了化疗药物的抗肿瘤效果并在体内促进了远端定植 之前的研究发现,敲低USP15可以提高胃癌细胞对化疗药物的敏感性,尤其是铂类药物。研究人员通过裸鼠皮下注射胃癌细胞株SGC7901 (sh-NC, sh-1#),探讨了USP15在胃癌发生发展中的作用。1周后,裸鼠几乎在同一时间观察到移植瘤的生长。研究人员将裸鼠分为4组,分别腹腔注射奥沙利铂(L-OHP, 5 mg/Kg)和生理盐水,每周2次,持续4周。虽然抑制USP15的表达并不能有效阻止肿瘤的生长,但USP15敲低确实增强了L-OHP的抗肿瘤作用,这与体外实验的结果相似。此外,敲低组裸鼠移植瘤组织中USP15的表达水平保持低水平,与增殖标志物表达趋势一致。接下来,研究人员在裸鼠中评估USP15敲低对肿瘤转移定植的影响。将稳定转染sh-NC和sh-1#的SGC7901-luc细胞经尾静脉注射入裸鼠体内。在第14、21、28、35天进行生物发光成像,USP15敲低组小鼠仅发现轻微远处转移。这些数据表明USP15积极促进胃癌的恶性进展,有望成为胃癌的治疗靶点。 在异种移植模型中,USP15的敲低增强了奥沙利铂的抗肿瘤作用并抑制了远端定植 敲低USP15可抑制糖酵解活性并损害线粒体功能 以上表明USP15可能是调控GC细胞糖酵解活性的重要成分,因此研究人员测定了抑制USP15表达对糖酵解和线粒体氧化磷酸化过程的影响。USP15敲低不仅导致糖酵解和糖酵解能力的阻断,还降低了基础氧消耗率(OCR)和最大OCR水平,表明有氧糖酵解和有氧氧化受损。由于线粒体的完整性对于维持OXPHOS过程和肿瘤细胞的活力至关重要,研究人员分析了USP15敲低后GC细胞中线粒体功能和结构的完整性。JC-1探针检测线粒体膜电位以判断线粒体功能;结果表明,USP15敲低导致线粒体膜电位异常降低,荧光模式从点状红色荧光变为弥漫性绿色荧光。此外,敲低USP15后线粒体异常的细胞数量显著增加。重要的是,透射电子显微镜成像清晰地观察到USP15敲低引起的GC细胞线粒体结构的异常。细胞内ROS水平的升高和线粒体相关蛋白的异常表达进一步表明了USP15敲低后GC细胞中的线粒体损伤。 研究小结 综上所述,本研究表明USP15在胃癌细胞和组织中表达上调,并且USP15的高表达与胃癌患者的不良预后和化疗耐药相关。值得注意的是,本研究结果支持USP15是葡萄糖代谢的关键调节因子,这一点在之前的研究中未见报道。此外,研究人员鉴定了一组USP15相互作用蛋白,包括HKDC1和IGF2BP3。重要的是,抑制USP15的表达降低了糖酵解活性,阻断了葡萄糖代谢过程,导致线粒体损伤,这可能是通过HKDC1调节的。干扰USP15表达可逆转体内肿瘤进展和远端定植。进一步实验证实USP15的酶活性对HKDC1的去泛素化至关重要。综上所述,研究人员认为USP15抑制剂如果开发成功,可以特异有效地通过糖代谢重塑促进化疗,且毒性有限。 原始出处: The deubiquitinase USP15 drives malignant progression of gastric cancer through glucose metabolism remodeling.J Exp Clin Cancer Res. 2024 Aug 20;43(1):235. doi: 10.1186/s13046-024-03152-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#胃癌# #USP15# #泛素化#
49