芍药甘草汤的惊人效果:探索其如何利用自噬过程对抗APAP引起的肝损伤!
2024-11-05 梅斯循证中医药 MedSci原创 发表于上海
文章揭示了SGD保肝作用的潜在机制。
药物性肝损伤(DILI)是导致急性肝功能衰竭的常见因素,构成了全球范围内重大的公共卫生问题。对乙酰氨基酚(APAP),作为一种广泛使用的退热镇痛药物,在临床应用中极为普遍。然而,APAP作为一种直接的肝毒性物质,一旦超过安全剂量或长期使用,几乎不可避免地会导致肝损伤。目前,针对APAP引起的肝损伤的临床治疗手段相对有限,因此,在临床实践中迫切需要探索APAP诱导肝损伤的新的治疗策略。
芍药甘草汤(SGD)具有调和肝脾,缓急止痛的功效。该方在治疗肝脏疾病方面已有数千年的应用历史。研究表明SGD在抗炎、调节肠道微生物群以及对抗肝损伤方面具有显著效果。尽管如此,关于SGD对APAP诱导的肝损伤治疗效果及其作用机制的研究尚不充分。
近期,一篇名为“Shaoyao-Gancao Decoction, a famous Chinese medicine formula, protects against APAP-induced liver injury by promoting autophagy/mitophagy”的文章揭示了SGD保肝作用的潜在机制。

图1 论文首页
SGD可减弱APAP诱导的小鼠肝毒性和死亡率
APAP在多种哺乳动物体内均可引发肝损伤,其导致的肝毒性机制及其剂量反应在小鼠和人类之间具有高度一致性。因此,为探究SGD是否具备缓解APAP所致肝损伤的效果,研究在给予小鼠APAP ( 400mg / kg )后0.5小时,分别施以生理盐水、NAC或SGD (图2A)。在APAP注射后12小时,SGD表现出剂量依赖性地降低血清ALT和AST水平。
此外,SGD能够减轻急性近中心肝损伤(图2C-D)。但SGD在治疗剂量下显示出比NAC更优越的肝保护效果。同时,SGD还提高了由APAP ( 750mg / kg )引起的肝衰竭小鼠的存活率(图2E)。APAP的肝毒性涉及线粒体损伤和JNK的激活,最终导致肝细胞坏死。研究还观察到SGD能够减轻线粒体DNA损伤(图2F),减少肝细胞坏死(图2G-H),并抑制JNK的激活(图2I)。
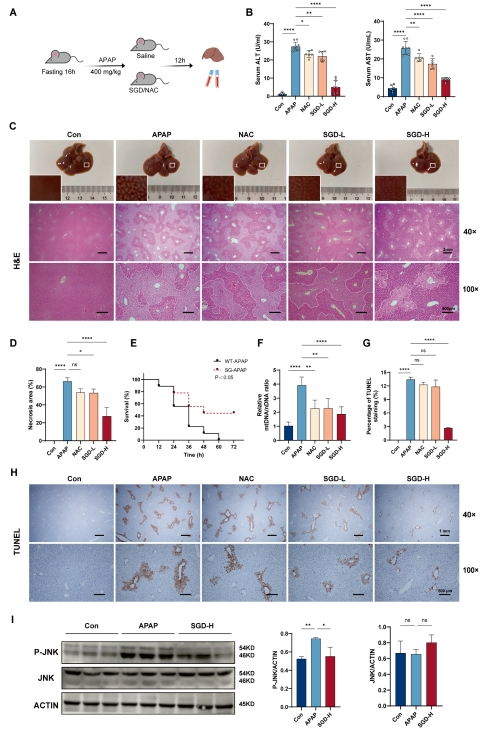
图2 SGD可减轻APAP诱导的小鼠肝毒性和死亡率
SGD可抑制肝脏无菌性炎症
APAP引发的肝损伤具有明确的时间性特征,小鼠肝毒性在12至24小时之间达到顶峰。12小时后,可以观察到肝细胞广泛坏死,进而导致DAMPs的释放,免疫细胞向肝脏的聚集,以及促炎细胞因子和趋化因子的激活。这些由APAP诱导的改变被SGD逆转,包括肝脏单核细胞衍生的巨噬细胞和中性粒细胞数量的减少(图3A),以及炎症介质(IL-6、IL-1β和TNF-α)的转录和释放的降低(图3B, D)。此外,SGD还减少了肝脏中MDA的升高(图3C)。
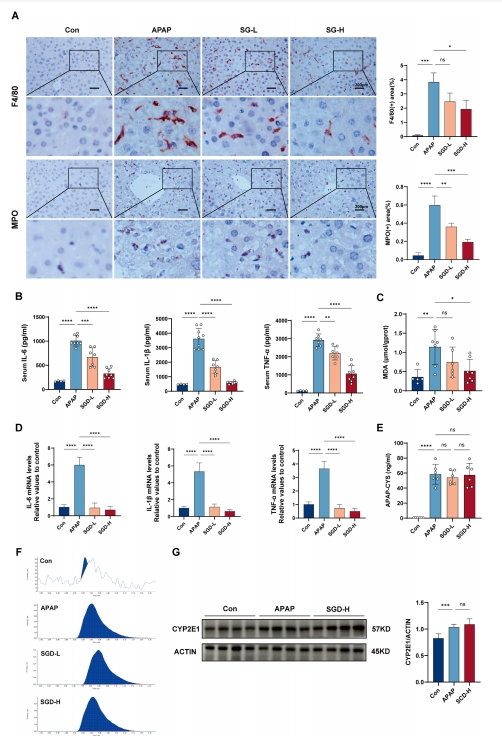
图3 SGD可抑制肝无菌性炎症
SGD在APAP代谢期后发挥肝保护作用
APAP的毒性源于过量APAP经由细胞色素P450酶(CYP酶)催化生成N-乙酰对苯醌亚胺(NAPQI)。NAPQI能够与线粒体蛋白发生共价结合,进而导致对乙酰氨基酚-半胱氨酸加合物(APAP-Cys)的形成。为探究SGD是否会改变APAP的代谢活化过程,研究测量了肝脏中APAP-Cys的水平,结果表明SGD对此无影响(图3E-F)。与此同时,CYP2E1蛋白的表达亦未受SGD影响(图3G)。
随后,研究在不同时间点评估了SGD对APAP诱导的毒性的影响。在APAP给药后0.5小时,给予小鼠治疗剂量的SGD。结果显示,在3小时时SGD未能降低血清转氨酶水平(图4A),但在6小时时血清转氨酶水平有所下降(图4B)。组织学评估也显示,在3小时时无明显改善,而在6小时时则显示出改善效果(图4C-D)。这表明SGD并不影响APAP的代谢过程。
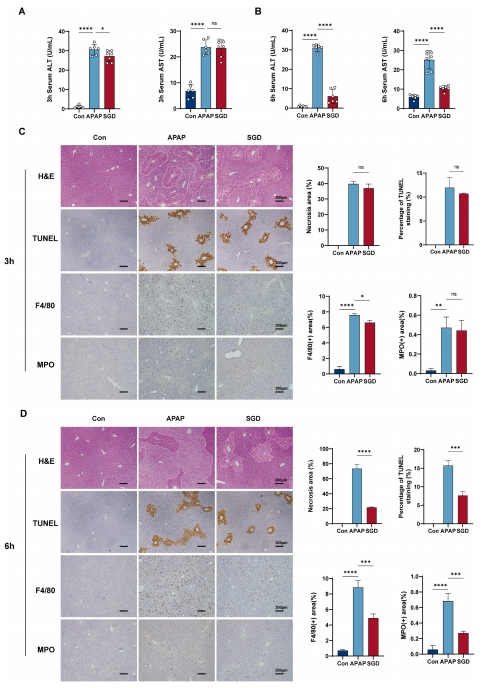
图4 SGD在APAP代谢期后发挥肝保护作用
通过转录组学和分子对接探索SGD抗肝损伤机制
通过执行基因集富集分析(Gene Set Enrichment Analysis,GSEA)于差异表达的mRNA(图5A-B),研究确定了调控自噬通路为最有前景的途径。热图揭示了SGD上调了自噬通路中大部分基因,包括PIK3C3、ATG4、ULK2等(图5C)。在APAP过量导致的急性肝损伤过程中,自噬被激活,以清除受损的细胞器和有毒物质,尤其是受损的线粒体,从而维持细胞的稳定状态。
进一步地,分子对接技术揭示了SGD成分与自噬/线粒体自噬关键蛋白结合位点的分子内相互作用。值得注意的是,PARKIN、ULK2、PIK3C3和PINK1与多数活性物质显示出强烈的结合(图5D),图5E展示了最稳定的代表性关键靶标及对应成分的结合。
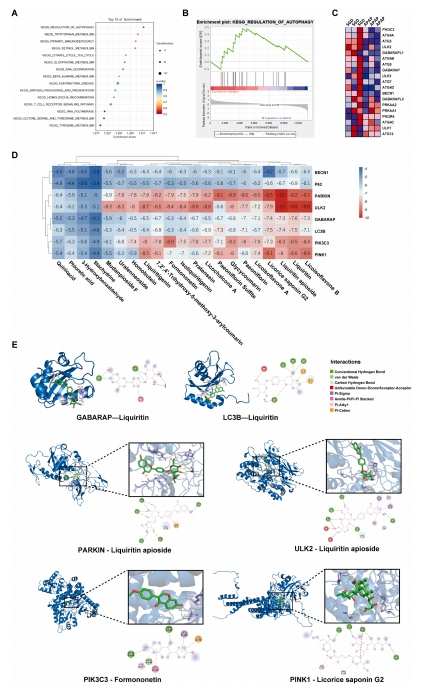
图5 通过转录组学和分子对接探索SGD抗肝损伤机制
SGD促进APAP诱导的肝损伤小鼠的自噬/线粒体自噬信号
鉴于转录组学和分子对接分析表明,SGD可能通过促进自噬/线粒体自噬对APAP诱导的肝损伤具有保护作用,研究随后在体内实验中对该假设进行了验证。结果正如预期,SGD显著提升了肝脏自噬相关基因Atg4a、Atg3、PIK3C3等的mRNA表达水平(图6A-B)。通过免疫荧光技术对TOMM20(线粒体标记物)和LAMP2(自噬标记物)进行共定位,以反映线粒体自噬情况(图6C)。
APAP过量摄入导致急性肝损伤,表现为近中心区域的损伤,自噬活动增强,受损线粒体被溶酶体降解清除,无法被TOMM20标记。SGD处理显著促进了线粒体自噬,特别是在损伤区域周围,TOMM20和LAMP2的共定位形成了保护性屏障。APAP处理增加了自噬流,此过程中自噬标志物和p62降解的内源性水平升高。
与此相一致,SGD处理进一步增强了这些变化(图6D)。胞浆中的E3泛素连接酶Parkin向受损线粒体转位,启动线粒体自噬并促进其降解。PINK1通过招募Parkin促进线粒体去极化,进而促进Parkin介导的线粒体自噬。此外,SGD上调了PINK和PARKIN蛋白表达(图6D)。
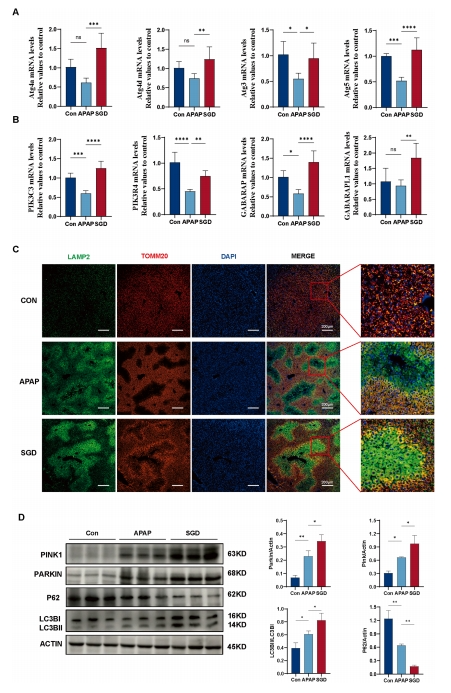
图6 SGD促进APAP诱导的肝损伤小鼠的自噬/线粒体自噬信号
结论
总之,SGD有望成为治疗由APAP引起的肝损伤的潜在药物,但其成分的治疗潜力尚需通过进一步的实验研究来验证。
参考文献:
Wu Y, Li W, Zhang J, Lin J, You L, Su J, Zheng C, Gao Y, Kong X, Sun X. Shaoyao-Gancao Decoction, a famous Chinese medicine formula, protects against APAP-induced liver injury by promoting autophagy/mitophagy. Phytomedicine. 2024 Sep 21;135:156053. doi: 10.1016/j.phymed.2024.156053
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#药物性肝损伤# #芍药甘草汤#
18