【论著】| BRCA1/2胚系突变对三阴性乳腺癌患者放疗后第二原发肿瘤的影响
2024-04-02 中国癌症杂志 中国癌症杂志 发表于上海
本研究旨在探索BRCA1/2基因胚系突变三阴性乳腺癌患者术后接受放射治疗是否为发生第二原发肿瘤的风险因素。
[摘要] 背景与目的:乳腺癌易感基因1/2(BRCA1/2)的编码产物在维持机体基因组稳定性方面发挥着重要的作用。BRCA1/2致病突变是否会导致机体对放射线的脆弱度增加,从而诱发第二原发肿瘤尚不清楚。本文旨在探讨BRCA1/2基因胚系突变的三阴性乳腺癌患者术后接受放射治疗是否是增加罹患第二原发肿瘤的危险因素。方法:基于复旦大学附属肿瘤医院2007年1月1日—2014年12月31日收集的回顾性三阴性乳腺癌队列(292例为BRCA1/2突变的女性三阴性乳腺癌患者),针对其开展分析,分别在非BRCA1/2胚系突变患者(n=261)与BRCA1/2胚系突变患者(n=31)中进行多元logistic回归分析,以评估影响第二原发肿瘤的风险因素,并对上述两人群中的分析结果进行交互作用分析,从而评估BRCA1/2胚系突变与放疗的交互作用。本研究除特殊说明外,均采用双侧检验且检验水准α=0.05。本研究所有样本的获得与使用均得到了复旦大学附属肿瘤医院伦理委员会的批准(050432-4-2108),且每个患者均提供了书面知情同意。结果:在BRCA1/2胚系突变患者中进行多元logistic回归分析提示术后接受放疗相对于未接受放疗显著增加了第二原发肿瘤的风险[比值比(odds ratio,OR)=2.479,95% CI:1.971~3.118,P<0.001)。而在非BRCA1/2胚系突变患者中,放疗对第二原发肿瘤的效应则不显著。BRCA1/2胚系突变与放疗对于第二原发肿瘤的发生无显著的交互作用(OR=9.71,95% CI:0.32~295.25,P=0.193)。结论:虽然统计学分析结果显示,与未接受放疗的患者相比,BRCA1/2胚系突变的患者术后放疗会增加罹患第二原发肿瘤的风险,但BRCA1/2胚系突变与放疗对第二原发肿瘤的发生并无相互交叉作用,因而BRCA1/2胚系突变患者术后接受放疗可能并不会增加罹患第二原发肿瘤的风险。
[关键词] 乳腺癌;BRCA1;BRCA2;放疗;第二原发肿瘤
[Abstract] Background and purpose: BRCA1/2 plays an important role in maintaining the genome stability. Whether BRCA1/2 germline mutation could increase the tumor sensitivity to radiotherapy, thereby inducing secondary primary cancer after radiotherapy is unclear. This study aimed to investigate whether postoperative radiotherapy is a risk factor for the development of second primary cancer in triple-negative breast cancer (TNBC) patients with BRCA1/2 germline mutation. Methods: This research was based on a previously reported retrospective cohort, i.e., the Fudan University Shanghai Cancer Center TNBC cohort. Between January 1, 2007 and December 31, 2014, a total of 292 female TNBC patients with BRCA1/2 mutation were enrolled. We performed logistic regression analysis in patients without BRCA1/2 germline mutation (n=261) and BRCA1/2 germline mutation patients (n=31), respectively, to assess the risk factors affecting the incidence of second primary cancer. We then performed interactive analysis on the above two analyses to evaluate the interactive effect between BRCA1/2 germline mutation and postoperative radiotherapy. P<0.05 indicates a statistically significant difference. The research was approved by Fudan University Shanghai Cancer Center TNBC Ethics Committee (050432-4-2108), and each patient provided written informed consent. Results: Logistic regression analysis in patients with BRCA1/2 germline mutations showed that postoperative radiotherapy significantly increased the risk of secondary primary disease compared to non-radiotherapy [odds ratio (OR)=2.475, 95% confidence interval (CI): 1.933-3.167, P<0.001]. In patients without BRCA1/2 germline mutation, the effect of radiotherapy on the incidence of second primary tumor was not significant. There was a significant interaction between BRCA1/2 germline mutation and postoperative radiotherapy for the incidence of secondary primary cancer (OR=9.710, 95% CI: 0.320-295.250, P=0.193). Conclusion: Although statistical analysis results show that patients with BRCA1/2 germline mutations have an increased risk of developing a second primary tumor after postoperative radiotherapy compared to patients who have not received radiotherapy, there is no significant correlation between BRCA1/2 germline mutations and radiotherapy for the development of a second primary tumor. Therefore, patients with BRCA1/2 germline mutations who receive radiotherapy after surgery may not increase the risk of developing a second primary tumor.
[Key words] Breast cancer; BRCA1; BRCA2; Radiotherapy; Second primary cancer
乳腺癌如今已超越肺癌成为全球发病率最高的恶性肿瘤[1]。根据美国癌症协会的数据,其发病率仍在以每年约0.5%的速率增长[2]。不表达雌激素受体、孕激素受体以及人表皮生长因子受体2的乳腺癌为三阴性乳腺癌,占所有乳腺癌的10%~20%,是乳腺癌中预后最差的类型[3]。现阶段对于乳腺癌临床上首选治疗为手术治疗,但对于中晚期患者而言,单独行乳腺癌根治术效果并不理想,因此为确保病灶清除率,多对乳腺癌术后患者进行放疗,以延缓癌症进展[4]。
乳腺癌易感基因1(BRCA1)与乳腺癌易感基因2(BRCA2)的致病突变是乳腺癌与卵巢癌的高危因素[5-6]。中国人群中BRCA总阳性突变率为5%[4]。BRCA1和BRCA2基因的编码产物在维持基因组稳定性方面发挥作用,即确保细胞的遗传完整性不会因染色体DNA的意外丢失、复制或重排而受损[7]。有鉴于此,我们推测BRCA1/2基因突变在使肿瘤对放疗的敏感性增加的同时也可导致机体对放射线的脆弱度增加,从而诱发第二原发肿瘤[8]。本研究旨在探索BRCA1/2基因胚系突变三阴性乳腺癌患者术后接受放射治疗是否为发生第二原发肿瘤的风险因素。
1 资料和方法
1.1 研究对象
基于复旦大学附属肿瘤医院三阴性乳腺癌队列开展回顾性研究[3],为2007年1月1日—2014年12月31日于复旦大学附属肿瘤医院就诊的患者。入组标准:① 诊断为单侧乳腺浸润性导管癌的女性三阴性乳腺癌患者;② 基于免疫组织化学与原位杂交的方法对雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)以及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)进行评估。由复旦大学附属肿瘤医院病理科的2位专家进行评估,三阴性乳腺癌定义为ER、PR及HER2阴性。其中ER与PR阴性定义为免疫组织化学检测结果小于1%的肿瘤细胞染色阳性;HER2阴性定义为免疫组织化学检测结果为0或1+、或免疫组织化学检测结果为2+且原位杂交结果为阴性;③ 确诊时未发生远处转移;④ 可获得足够的冷冻组织用于后续研究。乳腺原位癌以及炎性乳腺癌患者被排除在外。本研究所有样本的获得与使用均得到复旦大学附属肿瘤医院伦理委员会的批准(050432-4-2108),且所有患者均签署知情同意书。患者的临床信息包括:手术时年龄(age_at_surgery,连续变量)、月经状态(menopause,分类变量)、肿瘤级别(grade,连续变量)、肿瘤大小(size_cm,连续变量)、阳性淋巴结数目(LN_positive,连续变量)、是否接受化疗(chemotherapy,分类变量)、手术方式(surgery,分类变量)、复旦方案分子分型(mRNA_subtype,分类变量)以及是否接受放疗(radiotherapy,分类变量)。
1.2 基因检测
从组织和匹配的白细胞样本中制备合格的基因组DNA,用于全外显子组测序。基于Qubit荧光分光光度计定量的DNA样本(300 ng/样本)首先在生物摄取器+超声系统(Diage-node, Liege, Belgium)上破碎。破碎后的DNA使用Agilent SureSelectXT Library Prep 试剂盒(美国Agilent公司)进行末端修复、A尾和适配器的连接。随后,使用Agilent SureSelect Human All Exon V6(美国Agilent公司)探针捕获准备好的DNA(750 ng),并用索引引物对捕获的文库进行扩增。通过带有DNA芯片的Agilent 2100 生物分析仪(美国Agilent公司)进行质量控制。用Qubit 3.0荧光分光光度计(美国斯巴德市英杰公司)定量分析后,在Illumina HiSeq测序平台(美国Illumina公司)上对文库进行测序。对于组织来源的文库,单通道上装载12个样本;对于血液来源的文库,单通道上装载20个样本。
1.3 第二原发肿瘤
本研究所关注的第二原发肿瘤包括:同侧及对侧乳房第二原发肿瘤(对接受保乳手术患者而言,排除真性复发,但仍纳入其他象限发生的乳房内第二原发肿瘤),以及其他第二原发肿瘤(即除乳腺癌之外的任何部位的原发癌种)。末次随访时间为2023年2月17日。
1.4 统计学处理
⑴ 在非BRCA1/2胚系突变患者中, 通过多元logistic回归分析评估以下因素是否影响第二原发肿瘤的发生:年龄、是否绝经、肿瘤级别、肿瘤大小、阳性淋巴结数目、是否化疗、手术方式、分子分型( 复旦四分型) 、以及是否接受术后放疗。模型构建代码主体如下:“glm(Recurrence ~ Age_at_surgery+Menopause+Grade+Size_cm+LN_positive+Chemotherapy+Surgery+mRNA_Subtype+Radiotherapy”
⑵ 在BRCA1/2胚系突变患者中,通过多元logistic回归分析评估以下因素是否影响第二原发肿瘤的发生:年龄、是否绝经、肿瘤级别、肿瘤大小、阳性淋巴结数目、手术方式、分子分型(复旦四分型)、以及是否接受术后放疗。模型构建代码主体如下:“glm(Recurrence ~ Age_at_surgery+Menopause+Grade+Size_cm+LN_positive + Surgery + mRNA_Subtype+Radiotherapy)”
⑶ 对上述两分析结果进行交互作用分析,以判断BRCA1/2胚系突变与术后放疗是否对第二原发肿瘤有着交互作用。应用interactionR包进行交互作用分析。首先应用如下代码构建模型“glm(Recurrence~Age_at_surgery+Menopause+Grade+Size_cm+LN_positive+Chemotherapy+Surgery+mRNA_Subtype+BRCA1.2.MUT.20160718*Radiotherapy, family=binomial (link='logit') ,data=clinical1)”, 随后应用interactionR进行交互作用分析,参数设置如下: ci.type="mover",ci.level=0.9 5 。相乘交互作用的统计学指标ORA*B=OR11/(OR10*OR01)。
本研究除特殊说明外,均采用双侧显著性检验且检验水准α=0.05。所有分析均使用R语言进行。
2 结 果
2.1 研究对象基本信息
本研究共纳入292例具备BRCA1/2突变信息的女性三阴性乳腺癌患者,中位年龄52岁,94例患者术后接受放疗。随访患者中共有7例发生了第二原发肿瘤事件(表1),其中同侧乳房内第二原发肿瘤1例,对侧乳房内第二原发肿瘤3例,其他部位第二原发肿瘤3例。
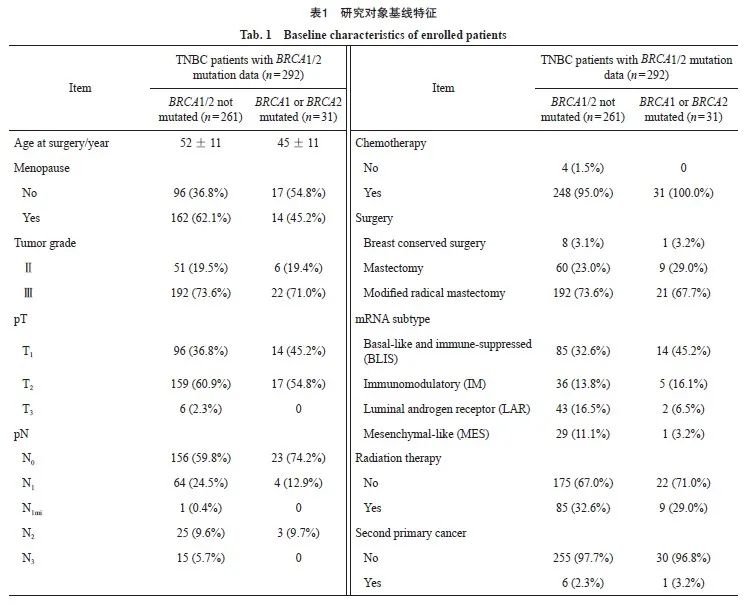
2.2 非BRCA1/2胚系突变人群多元logistic回归
非BRCA1/2胚系突变患者共261例。多元logistic回归分析结果显示,患者年龄、月经状态、肿瘤级别、肿瘤大小、阳性淋巴结数目、是否化疗、手术方式、分子分型(复旦四分型)以及是否放疗对第二原发肿瘤的发生均无显著影响(表2)。
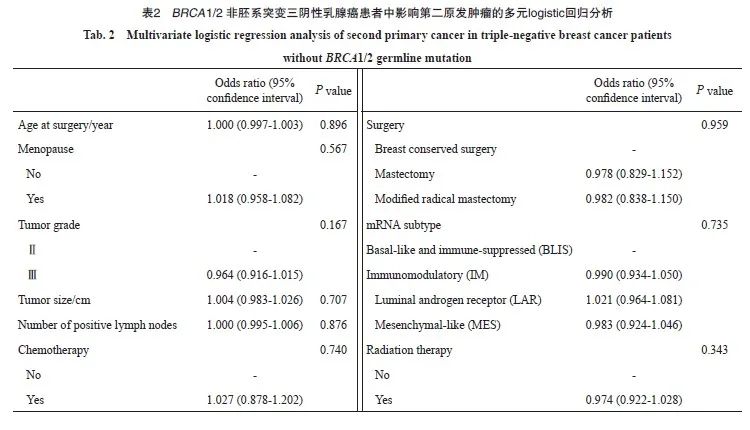
2.3 BRCA1/2胚系突变人群多元logistic回归
BRCA1/2胚系突变患者共31例,多元logistic回归分析结果显示,年龄、月经状态、肿瘤级别、肿瘤大小和手术方式等因素对第二原发肿瘤的发生均无显著影响。阳性淋巴结数目[比值比(odds ratio,OR)=0.852,95% CI:0.784~0.926,P=0.007]与腔面雄激素受体(luminal androgen receptor,LAR)亚型 [相对于基底样免疫抑制(basal-like and immune-suppressed,BLIS)亚型,OR=0.390,95% CI: 0.285~0.534,P<0.001]
可显著降低第二原发肿瘤的风险。接受术后放疗(相对于未接受术后放疗:OR=2.479,95% CI:1.971~3.118,P <0.001)以及免疫调节型(immunomodulatory,IM)亚型 [相对于BLIS亚型),OR=1.211,95% CI:1.023~1.433,P<0.001]可显著增加第二原发肿瘤风险(表3)。
2.4 交互作用
BRCA1/2胚系突变与放疗对第二原发肿瘤的发生无显著的交互作用(OR=9.71,95% CI:0.32~295.25;P=0.193,表4)。

3 讨 论
本研究结果显示,BRCA1/2胚系突变患者术后接受放疗可显著地增加罹患第二原发肿瘤的风险,而对于非BRCA1/2胚系突变患者术后放疗不存在该效应。BRCA1/2胚系突变与放疗不存在显著的交互作用。
BRCA1和BRCA2基因的编码产物在维持基因组的稳定性方面发挥着重要的作用。我们推测BRCA1和BRCA2基因突变可增加患者基因组对放射治疗的脆弱度,从而提高放疗后发生第二原发肿瘤的风险。既往同类型的研究主要关注BRCA1和BRCA2基因突变对放疗敏感性的影响,所关注的事件主要为放疗后缓解率,且不同研究得出的结论并不一致:丁高峰等[9]回顾性分析了156例收治于郑州大学附属肿瘤医院的患者,发现BRCA1基因突变阳性率与放疗的高敏感性相关;而李贺等[10]分析112例收治于河南科技大学第一附属医院的非小细胞癌患者则发现癌组织的BRCA1基因突变阳性率越高,对放疗的敏感性越差。本研究主要观察BRCA1和BRCA2胚系突变对患者全身的影响,即放疗后身体任何部位发生第二原发肿瘤的风险。既往研究大部分未区分原发肿瘤与第二原发肿瘤。Seynaeve等[11]发现,与散发性乳腺癌病例相比,遗传性病例发生同侧乳腺癌的风险在随访5年后显著增高,且这些同侧乳腺癌与原发肿瘤不在同一象限,提示为第二原发肿瘤。Bernstein等[12]进行了一项巢式病例对照研究,结果显示,BRCA1/2突变携带者接受放疗并没有增加罹患对侧乳腺癌的风险。然而,另一项研究数据却提示有以下DNA损伤修复基因(BRCA1、BRCA2、CHEK2或ATM)之一突变的携带者与未携带者相比,患对侧乳腺癌的风险显著增高[13]。这一差异可能是由入组人群特征的差异导致的。
本研究探讨了BRCA1/2胚系突变与放疗对发生第二原发肿瘤的交互作用,结果显示,单从统计学分析结果而言,与未接受放疗者相比,BRCA1/2基因胚系突变患者术后接受放疗可增加罹患第二原发肿瘤的风险,但BRCA1/2胚系突变与放疗对第二原发肿瘤的发生并显著的交叉作用,因而BRCA1/2胚系突变患者术后接受放疗可能并不会增加罹患第二原发肿瘤的风险。但值得注意的是,本研究中第二原发肿瘤事件数较少,可能降低了统计学分析效能。本研究结论还有待更进一步的前瞻性队列临床验证。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:胡晓钰、蔡毓文、叶富贵:文献调研与整理;分析解释数据;起草、修订论文。邵志敏、胡伟刚、余科达:提出研究方向;对文章知识性内容作批评性审阅;书写论文。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] GIAQUINTO ANGELA N, HYUNA S, MILLER KIMBERLY D, et al. Breast cancer statistics, 2022[J]. CA a Cancer J Clin, 2022, 72(6): 524-541.
[3] JIANG Y Z, MA D, SUO C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440. e5.
[4] 中国医师协会精准治疗委员会乳腺癌专业委员会, 中华医学会肿瘤学分会乳腺肿瘤学组, 中国抗癌协会乳腺癌专业委员会. 中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(10): 787-798.
Breast cancer Professional Committee of Precision Therapy Committee of Chinese Medical Doctor Association, Breast Cancer Group of Cancer Branch of Chinese Medical Association, breast cancer Professional Committee of China Anti-Cancer Association. Expert consensus on BRCA1/2 gene detection and clinical application of breast cancer patients in China (2018 edition)[J]. China Oncol, 2018, 28(10): 787-798.
[5] KUCHENBAECKER K B, HOPPER J L, BARNES D R, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers[J]. JAMA, 2017, 317(23): 2402-2416.
[6] 中国抗癌协会乳腺癌专业委员会, 中华医学会肿瘤学分会乳腺肿瘤学组. 中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J]. 中国癌症杂志, 2023, 33(12): 1092-1187.
The Society of Breast Cancer China Anti-Cancer Association, Breast Oncology Group of the Oncology Branch of the Chinese Medical Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2024 edition)[J]. China Oncol, 2023, 33(12): 1092-1187.
[7] LEE W H, BOYER T G. BRCA1 and BRCA2 in breast cancer[J]. Lancet, 2001, 358(Suppl): S5.
[8] DROOGER J C, HOONING M J, SEYNAEVE C M, et al. Diagnostic and therapeutic ionizing radiation and the risk of a first and second primary breast cancer, with special attention for BRCA1 and BRCA2 mutation carriers: a critical review of the literature[J]. Cancer Treat Rev, 2015, 41(2): 187-196.
[9] 丁高峰, 郭雷鸣, 陆寓非. 乳腺癌患者HER2和BRCA1表达与放疗敏感性的关系研究[J]. 中国癌症杂志, 2021, 31(7): 589-595.
DING G F, GUO L M, LU Y F. The relationship between expressions of HER2 and BRCA1 and radiotherapy sensitivity in breast cancer patients[J]. China Oncol, 2021, 31(7): 589-595.
[10] 李 贺. 非小细胞肺癌患者癌组织中BRCA1和p53表达与放疗敏感性的相关性[J]. 临床医学, 2023, 43(2): 1-4.
LI H. Correlation of BRCA1 and p53 expression in cancer tissues with radiosensitivity in patients with non-small cell lung cancer[J]. Clin Med, 2023, 43(2): 1-4.
[11] SEYNAEVE C, VERHOOG L C, VAN DE BOSCH L M, et al. Ipsilateral breast tumour recurrence in hereditary breast cancer following breast-conserving therapy[J]. Eur J Cancer, 2004, 40(8): 1150-1158.
[12] BERNSTEIN J L, THOMAS D C, SHORE R E, et al. Contralateral breast cancer after radiotherapy among BRCA1 and BRCA2 mutation carriers: a WECARE study report[J]. Eur J Cancer, 2013, 49(14): 2979-2985.
[13] BROEKS A, BRAAF L M, HUSEINOVIC A, et al. Identification of women with an increased risk of developing radiationinduced breast cancer: a case only study[J]. Breast Cancer Res, 2007, 9(2): R26.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#乳腺癌# #BRCA1# #BRCA2# #第二原发肿瘤#
93