Adv Sci:四川大学仝爱平等团队合作验证了CD5-CAR-γδTCD5-在急性淋巴细胞白血病免疫治疗中的作用机理
2024-07-18 iNature iNature 发表于上海
研究通过构建CD5-CAR-γδT细胞,采用新方法避免自相残杀等问题,展现良好功能特征和抗肿瘤功效,为T细胞急性淋巴细胞白血病治疗提供新思路。
嵌合抗原受体T细胞(CAR-T)疗法的临床试验在治疗实体瘤和血液系统恶性肿瘤方面取得了显著的成功。纳米体(Nbs)由于其高特异性、强稳定性和强亲和力,已经成为CAR-T抗原靶向领域的一个有前景的领域,在Nb-CAR-T领域的重大进展。在T细胞急性淋巴细胞白血病(T-ALL)靶点领域,CD5因其在恶性T-ALL细胞表面的独特表达而成为基于T细胞的CAR治疗的潜在优秀候选者。
2024年7月16日,四川大学仝爱平、聂春来及牛挺共同通讯在Advanced Science 在线发表题为“mRNA-Engineered CD5-CAR-γδTCD5- Cells for the Immunotherapy of T-Cell Acute Lymphoblastic Leukemia”的研究论文,该研究中为了减轻与同种异体CAR-T相关的移植物抗宿主病,从外周血单个核细胞中选择和刺激γδT细胞,并通过CRISPR/Cas9对γδT细胞进行工程化以消除杀兄弟氨酸,从而产生抗杀兄弟氨酸的CAR-γδTCD5 -细胞。
体外转录(IVT)mRNA用于构建CAR-T,与传统的病毒载体方法相比,它提供了一种更安全、更快速、更经济的方法。在这项研究中,构建了一个CD5-VHH文库,并筛选了特异性的CD5纳米体,用于后续的CD5-CAR-γδTCD5 -治疗。IVT-mRNA-CD5-CAR-γδTCD5 -细胞表现出良好的功能特征,并对恶性T细胞系显示出抗肿瘤功效,这表明了mRNA-CD5-CAR-γδTCD5 -治疗的潜力。

嵌合抗原受体T细胞(CAR-T)是经过基因工程改造的T淋巴细胞,在其表面表达合成的CAR分子。这些分子由细胞外结构域组成,专门用于识别和结合靶细胞表面的抗原。纳米体(Nbs)因其高特异性、强稳定性和高亲和力而被开发为CAR-T抗原靶向结构域,在CAR-T治疗中取得了重大进展。
CAR-T疗法在临床试验中取得了显著的成功。一些CAR-T细胞产品已经获得监管部门的批准,并且正在进行的研究正在扩大这种疗法在实体瘤和其他血液系统恶性肿瘤中的应用。在血液系统恶性肿瘤中,T细胞急性淋巴细胞白血病(T- all)是一种由T细胞祖细胞转化引起的侵袭性恶性肿瘤,具有独特的挑战,特别是缺乏不同的靶抗原来有效区分白血病和正常T细胞。
先前的研究表明,CD5是CAR的潜在良好靶标,因为它是T-ALL中恶性T细胞上表达的标记物之一。此外,CD5不在造血干细胞上表达,将肿瘤外效应的风险降至最低。此外,临床前研究表明,CD5-CAR-T细胞优先靶向恶性T细胞,同时保留正常T细胞群。尽管前景光明,但CAR-T细胞上CD5的先天表达会诱导自相残杀,从而降低治疗效果。在这种情况下,利用CRISPR-Cas9技术敲除CAR-T细胞中的CD5基因是一种开创性的方法,可以避免自相残杀,并增强靶向CD5的CAR-T治疗T-ALL的有效性。
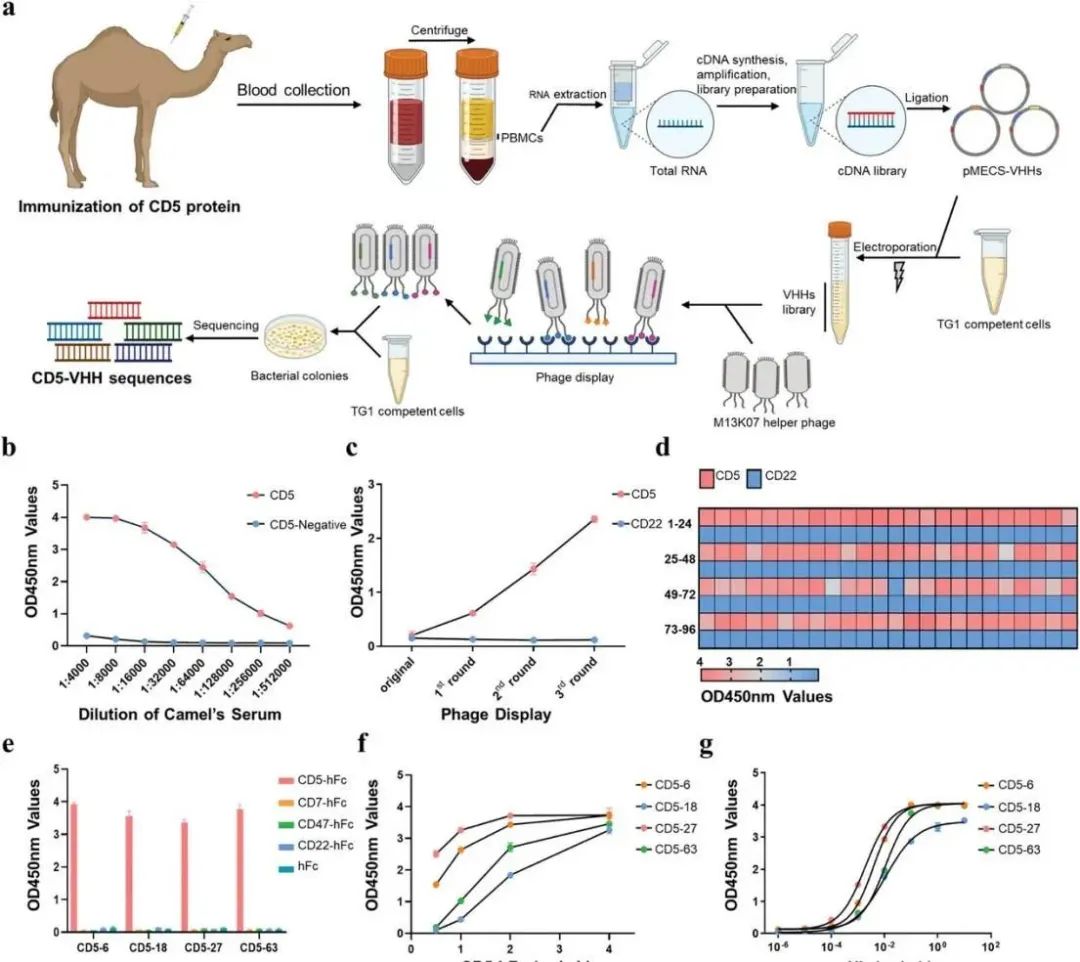
CD5-VHH文库构建、特异性纳米抗体筛选和CD5-Nbs的表征(图源自Advanced Science )
同时,T-ALL作为一种起源于T细胞的恶性血液肿瘤,在收集患者来源的正常T细胞用于CAR-T治疗方面存在巨大障碍。在这种情况下,CAR-γδT细胞疗法成为人们关注的焦点,有望打破这种困境。由于每个人都有自己独特的一套人类白细胞抗原(HLA)分子,αβT细胞免疫系统不容易在个体之间转移。相比之下,γδT细胞不依赖于经典HLA分子的识别,对感染或癌症的感知依赖于大多数时候在许多个体中观察到的更普遍的变化。因此,γδT细胞可以从健康的供体中收集,并且具有实现同种异体移植的能力,减轻严重的移植物抗宿主病。初步研究表明,CAR修饰的γδT细胞对多种恶性肿瘤,包括血液病和实体瘤具有细胞毒活性。然而,诸如优化γδT细胞的CAR设计,增强体内扩增和持久性以及减轻潜在的脱靶效应等挑战是研究的活跃领域。
传统上,T细胞是通过携带CAR基因序列的病毒载体进行体外转染来进行工程改造的,然后将其送回患者体内治疗相关疾病。然而,这一过程涉及到几个可以优化的方面,例如CAR-T细胞制备过程的复杂性以及病毒载体整合到细胞基因组的相关风险,可能会诱导肿瘤的形成。
因此,体外转录mRNA CAR-T (IVT mRNA CAR-T)疗法是一种新兴的安全、快速、经济的替代方案,可以克服这些挑战,并具有避免长期不良反应的优势。由于mRNA的不稳定性,IVT mRNA CAR-T减少了与靶标、非肿瘤毒性相关的副作用。此外,体外和体内研究已经证明了mRNA工程T细胞对实体肿瘤的治疗能力,包括黑色素瘤、神经母细胞瘤和卵巢癌。此外,在临床应用中,该方法对剂量和疗效具有更好的可控性,具有很大的发展潜力。
尽管有很好的进展,但IVT mRNA CAR-γδT治疗T-ALL的有效性有待进一步验证。在该研究中,探索了利用Nb构建CD5 CAR,并开发了CD5-CAR-γδT细胞。从健康供体中收集γδT细胞,采用CRISPR/Cas9核糖核蛋白(RNP)和CD5-VHH-CAR mRNA电穿孔技术构建CD5-CAR-γδTCD5−。初步研究结果证实了mRNA-CD5-CAR-γδTCD5 -细胞的理想功能属性,强调了继续探索这种创新疗法的必要性。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202400024
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#T细胞急性淋巴细胞白血病# #CD5-CAR-γδT细胞#
6