赵彦利教授/张洪杰院士最新JACS:单位点纳米酶可用于铜死亡和级联强化T细胞介导的抗癌免疫疗法
2024-02-08 BioMed科技 BioMed科技 发表于陕西省
这种免疫纳米重塑剂可以通过增强肿瘤免疫原性、重塑ECM和下调IC,大大增强T细胞的浸润和抗肿瘤活性,从而实现对肿瘤生长和转移的有效抑制。
肿瘤微环境(TME)中的细胞外基质(ECM)和抗肿瘤免疫细胞上上调的免疫检查点(IC)阻碍了T细胞对肿瘤的浸润和杀伤作用,进而产生了免疫抑制性TME。
基于这一认识,南洋理工大学赵彦利教授和中科院长春应化所张洪杰院士/Yinghui Wang等人开发了可共递送胆固醇氧化酶(CHO)和赖氨酰氧化酶抑制剂(LOX-IN-3)得铜二苯并-[g,p]chrysene-2,3,6,7,10,11,14,15-辛醇单位点纳米酶(Cu-DBCO/CL)。共轭有机配体和分布良好的Cu-O4位点赋予了Cu-DBCO独特的氧化还原能力,使其能够催化O2和H2O2生成·O2–和·OH。活性氧(ROS)的激增导致线粒体功能受损和ATP供应不足,影响铜转运ATPase-1的功能,并导致二氢硫酰胺S-乙酰转移酶寡聚化介导的铜死亡。此外,Cu-DBCO/CL在通过级联增强CD8+T细胞活力来激活有效的抗肿瘤免疫反应方面表现出高效特性。更重要的是,ECM重塑和胆固醇耗竭可以抑制肿瘤细胞的转移和增殖。总之,这种免疫纳米重塑剂可以通过增强肿瘤免疫原性、重塑ECM和下调IC,大大增强T细胞的浸润和抗肿瘤活性,从而实现对肿瘤生长和转移的有效抑制。相关工作以“Single-Site Nanozymes with a Highly Conjugated Coordination Structure for Antitumor Immunotherapy via Cuproptosis and Cascade-Enhanced T Lymphocyte Activity”为题发表在JACS。

【文章要点】
对于Cu-DBCO/CL来说,共轭有机配体赋予Cu-DBCO氧化还原特性,其衍生的各种氧化还原中间体中的半醌自由基可以有效催化O2生成·O2–(图1)。此外,分布良好的Cu-O4位点有利于催化H2O2生成·OH,表现出高效的过氧化物酶(POD)样活性。同时,CHO可以催化肿瘤中过量的胆固醇产生胆固醇酮和H2O2,不仅提高了Cu-DBCO的·OH生成性能,而且可以有效抑制肿瘤细胞的转移和侵袭。ROS的激增则破坏了细胞的氧化还原稳态,导致线粒体功能受损和ATP供应不足。ATP的减少可直接影响铜转运ATPase 1(ATP7A)的功能,导致大量Cu+在癌症细胞中被捕获,导致硫酰化蛋白二氢硫酰胺S-乙酰转移酶(DLAT)低聚和硫酰合酶(LIAS)缺失,最终诱导肿瘤细胞铜死亡。
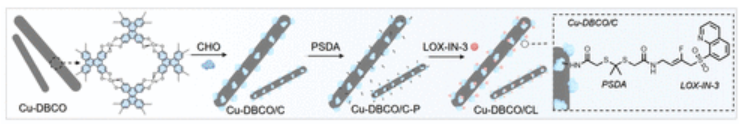
图1 Cu-DBCO/CL
此外,多种ROS风暴和谷胱甘肽过氧化物酶4的耗竭也会诱导脂质过氧化并引发铁死亡。同时,ROS触发LOX-IN-3的释放通过抑制赖氨酰氧化酶活性重塑ECM,并进一步增强CD8+T细胞的浸润。同时,CHO触发的胆固醇耗竭不仅增加·OH的产生,而且下调PD-1和TIM-3等IC的表达,恢复肿瘤浸润性CD8+T细胞的抗肿瘤活性(图2)。简而言之, Cu-DBCO/CL免疫纳米重塑剂可以大大增强CD8+T细胞的浸润和抗肿瘤活性,从而实现免疫疗法的级联增强。
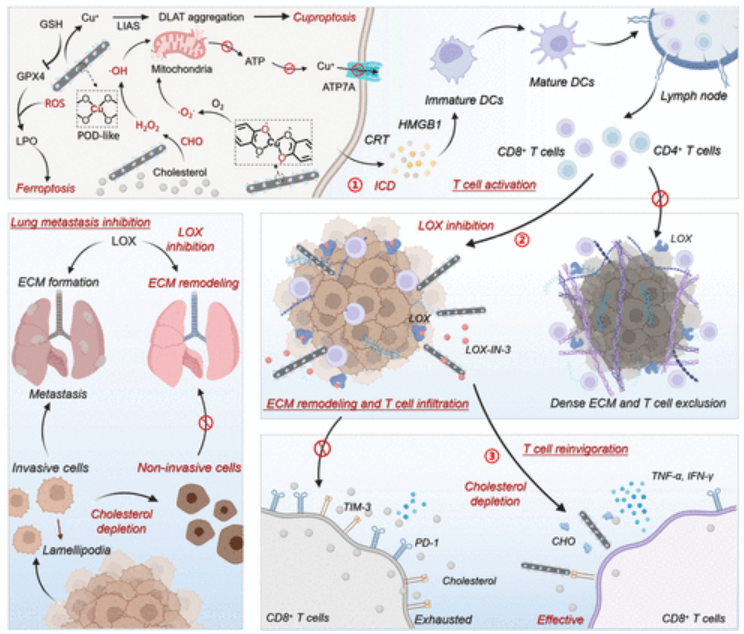
图2 抗肿瘤免疫治疗示意图
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.3c08622
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肿瘤微环境# #免疫疗法# #铜死亡# #胆固醇氧化酶#
104