四川大学华西口腔医院袁泉/邵彬团队《Adv. Sci.》:发现牙周炎症破坏的新机制和干预措施
2024-05-06 BioMed科技 BioMed科技 发表于上海
该研究发现METTL3通过NEK7调控NLRP3炎性小体活化影响牙周炎进展的重要机制,并筛选了针对METTL3的小分子天然抑制剂。
四川大学华西口腔医院袁泉/邵彬团队发表题为“Inhibition of METTL3 alleviates NLRP3 inflammasome activation via increasing ubiquitination of NEK7”的文章。该研究发现METTL3通过NEK7调控NLRP3炎性小体活化影响牙周炎进展的重要机制,并筛选了针对METTL3的小分子天然抑制剂。该研究解析了牙周炎症破坏的新机制,为该疾病的治疗提供了潜在的药物,具有重要的研究意义和临床价值。

牙周炎是一种常见的口腔疾病,危害牙齿和全身健康。在病原诱导的牙周病起始阶段,牙龈组织充当抵御病原体入侵的前线防御。牙龈成纤维细胞(gingival fibroblasts,GFs)是牙龈组织最丰富的细胞,其除了作为组织的支持细胞外,还发挥免疫调节作用。研究表明,GFs经细菌等病原体刺激后能够募集免疫细胞清除受损细胞。GFs和免疫细胞之间的相互作用是通过利用细胞内炎症信号通路引发炎症反应和驱动结缔组织迁移来实现。
METTL3介导的mRNA m6A甲基化在炎症和免疫反应中发挥重要的作用。研究表明METTL3通过促进TLR4/NF-κB信号通路中中靶转录产物(包括Cd40、Cd80和Tirap)的翻译来增强树突状细胞的成熟;而METTL3缺陷的巨噬细胞消除病原体的能力减弱。前期研究表明,METTL3介导的m6A甲基化与牙周炎的发生发展有关,然而具体机制尚不清楚。
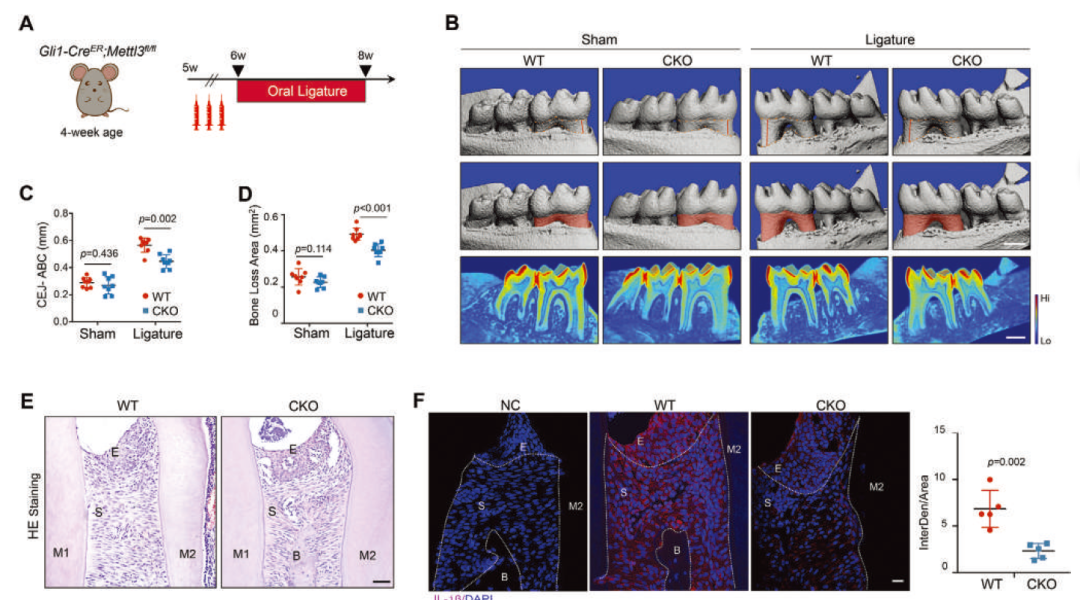
作者首先繁育Gli1-CreER; Mettl3fl/fl条件敲除小鼠,通过丝线结扎构建牙周炎模型,发现条件敲除组小鼠牙周炎表型显著弱于野生型。随后,提取人牙龈成纤维细胞(HGFs),通过siRNA敲降METTL3,RNA-seq及体外验证提示敲降组NLRP3炎性小体相关通路的激活有所下调。
为进一步探索METTL3影响NLRP3炎性小体激活的作用机制,作者进一步挖掘MeRIP seq测序数据,发现肿瘤坏死因子α诱导蛋白3(TNFAIP3)mRNA上存在m6A修饰,并在LPS刺激后增强。在HGFs中敲降METTL3,TNFAIP3 mRNA稳定性增强,表达升高。构建METTL3、TNFAIP3双敲小鼠,可见敲除TNFAIP3消除了敲除METTL3对牙周炎的抑制作用,双敲组牙周组织炎症水平回升。提示METTL3对牙周炎的促进作用依赖于TNFAIP3。
作者通过质谱、免疫荧光共定位、内源性及外源性免疫共沉淀实验提示了TNFAIP3与炎性小体成分NEK7的互作。放线菌酮(CHX)、MG-132实验提示TNFAIP3的存在导致NEK7蛋白稳定性下降。前期研究提示TNFAIP3是一种锌指泛素编辑酶,进一步地,通过in-vivo及in-vitro的泛素化蛋白检测,作者发现TNFAIP3可对NEK7进行泛素化修饰,促进其降解,以抑制炎性小体激活。
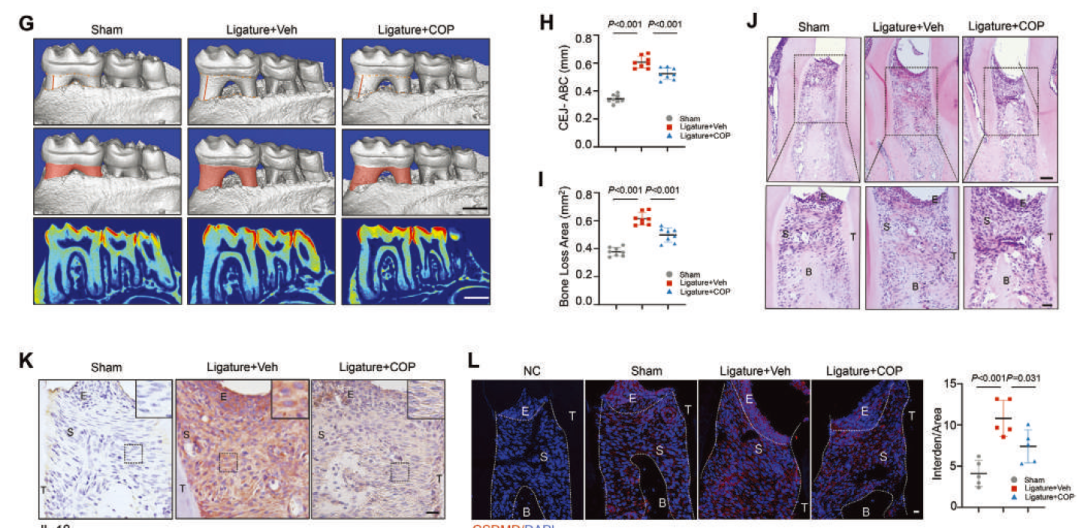
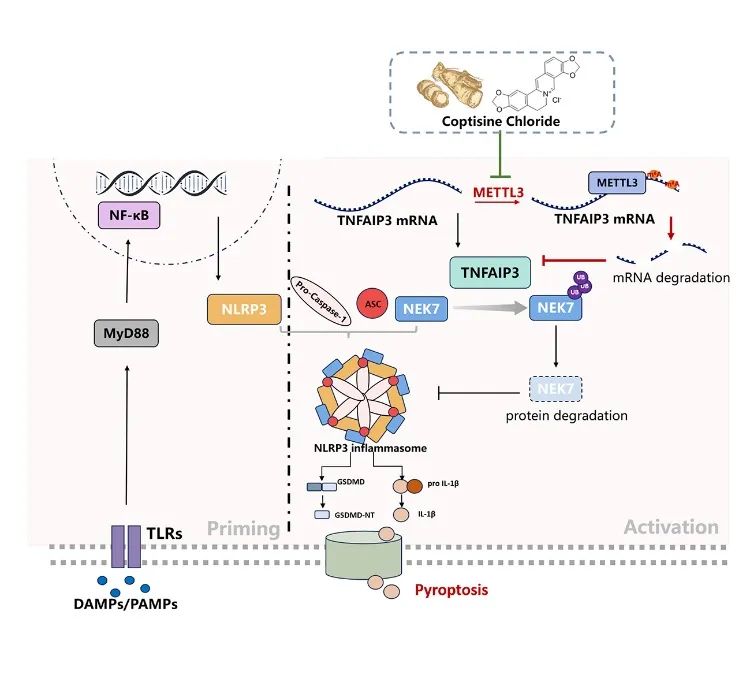
最后,作者通过高通量筛选发现天然小分子盐酸黄连碱(coptisine chloride, COP)可特异结合METTL3的SAM-binding pocket,抑制其甲基转移酶功能,即阻止m6A修饰的写入。体内验证提示COP局部给药有效缓解小鼠牙周炎骨吸收。
四川大学华西口腔医院/口腔疾病防治全国重点实验室袁泉教授和邵彬副研究员为该论文共同通讯作者,周欣奕博士和杨晓宇博士为共同第一作者。该研究得到了四川大学生物治疗全国重点实验室杨胜勇教授的大力支持和帮助。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202308786
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#牙周炎# #Mettl3#
48