肿瘤免疫治疗联合放疗或化疗,或为肿瘤治疗打开新天地
2016-08-28 MedSci MedSci原创
2016 ASCO 年会上,瑞士 Zürich 大学医院神经内科泰斗 Michael Weller 博士总结了免疫疗法在脑胶质瘤领域的应用状态,但他认为这些赞成和反对的论据可以推广到其他类型的肿瘤。 免疫疗法在肿瘤领域的运用还处于婴儿期,尽管试验数据日趋成熟,仍任重而道远。以下是各界对免疫疗法联合其他治疗的一些观点: 联合法的推崇者「combo believers」—— 化疗,可
2016 ASCO 年会上,瑞士 Zürich 大学医院神经内科泰斗 Michael Weller 博士总结了免疫疗法在脑胶质瘤领域的应用状态,但他认为这些赞成和反对的论据可以推广到其他类型的肿瘤。
随着肿瘤免疫治疗热潮的逐步冷静下来,人们开始思考如何最大化免疫治疗效果!因为单纯采用肿瘤免疫治疗还存在不足,例如,对免疫敏感的肿瘤(如黑色素瘤,血液肿瘤等)效果很好,对免疫非敏感肿瘤要差得多。另外,实体瘤对免疫治疗的获益还受到很多方面影响,整体获益人群还是有限的。那么,下一步肿瘤免疫治疗将何去何从?
联合治疗成为新的切入点。不过针对联合治疗,仍然存在争议,主要是以下观点:
联合法的推崇者(combo believers)——
*化疗,可能会消耗机体的 T 细胞并释放肿瘤抗原
*放疗,可能通过免疫细胞死亡途径并释放肿瘤抗原
*抗血管生成治疗,VEGF 也是有免疫抑制作用的
*手术,微小的残留病灶使肿瘤周边的免疫抑制最小化
联合法的怀疑者(combo skeptic)——
*化疗,易致淋巴细胞减少并具骨髓毒性
*放疗,杀伤肿瘤边浸润的免疫细胞并减少使用固醇类药物的必要性和耐受性
*抗血管生成,血脑屏障的完整性减少了免疫细胞的流入
*手术,残留微小的肿瘤细胞被转化成肿瘤抗原并被免疫系统识别
肿瘤免疫治疗+放疗:被认为是一种新希望
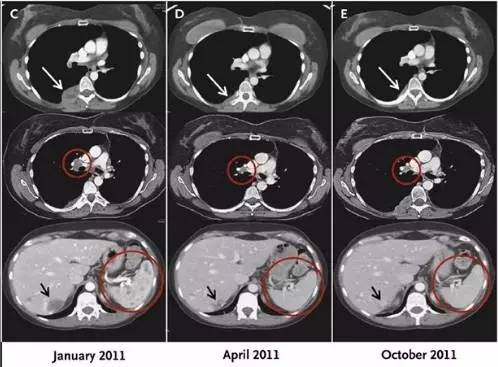
一些患者在联合治疗后,出现照射区以外的肿瘤的自发退缩,这就是“远端辐射效应(abscopal effect)”,也称放疗远端效应,一般认为放射线增强了肿瘤细胞抗原递呈的效应,产生更多的 CD8+T 细胞,随着血液迁移到远端照射区域以外,使得未经照射区域的肿瘤得到一定程度的控制。放疗远端效应的出现,表明放疗不仅能局部直接杀死癌细胞,还能引起某种全身性的变化。通过放疗杀死的肿瘤细胞,可能会释放出肿瘤特异性抗原,相当于体内产生了天然的“癌症疫苗”(Cell:放疗,或将改变“癌症免疫疗法”)。
2012 年Sloan Kettering 癌症中心的研究者们报道一例黑色素瘤患者经局部放疗后再联合检查位点抑制剂 Ipilimumab 的案例。该患者瘤块退缩,外周血免疫细胞、抗体均有所反应,显示了令人震惊的全身效果。同时发现放疗与免疫治疗结合,患者全身针对癌细胞的免疫系统被显著激活,其中一种针对癌细胞的抗体增加了30倍!(NEJM:转移性黑色素瘤治疗后的一个罕见现象)(NEJM: PD-1单抗对多种癌症有良好疗效)
有研究者认为,远端辐射效应可能与放疗启动机体免疫系统识别肿瘤特异性抗原(放疗杀伤的肿瘤细胞后,部分蛋白可能转化为抗原)有关,并进一步转化为全身性效应(systemic effect)。当然,还有一些新的解释,如Deutsch E认为,免疫治疗药物可能放大了远端辐射效应。Dai T甚至称为可能是下一个新时代的到来!但是,免疫治疗与放疗如何结合,还需要研究,是同时使用,还是先免疫后放疗,或是先放疗后免疫,或是穿插使用,目前还没有明确的结论支持。
因此,除黑色素瘤等敏感肿瘤外,针对肺癌,前列腺癌,肝癌,肾透明细胞癌等多项临床试验中,都采用了放疗+免疫治疗的组合拳,如果在Clinicaltrials上采用PD-1+radiology作为关键词搜索,可以发现有10项研究正在进行。
多种免疫联合治疗是否会产生协同效应?有研究者认为PDL1阻断疗法复兴了耗尽的CD8+ T细胞,CTLA4阻断疗法主要减少了Treg 的细胞数量,两者加在一起,这些免疫检验点抑制剂增加了CD8/Treg 的比例,促进了TILs细胞的四周克隆扩增。放疗的主要作用是多元化TILs的T细胞受体,塑造出扩增的外周细胞克隆。从而产生了协同!
大家都治疗免疫治疗毒性低,化疗毒性大,这对于开展化疗+免疫治疗的临床试验是一个巨大的挑战——患者不愿被随机纳入到单纯化疗组。事实上,目前一项研究就存在小细胞肺癌患者不愿加入拓扑替康标准治疗组,因为该组生存曲线和反应并不大。免疫疗法获益越是明显,将患者随机分组就越是困难。这就要求合作组及医药公司更加合理的设计临床试验,同时标志物的选择显得尤为重要。
有效的生物标志物,预测到疗效,才能更好的引导患者进行单药或者联合的治疗。运用化疗杀死癌细胞时,死亡的癌细胞会释放出吸引T细胞的分子,从而使T细胞聚集到肿瘤周围。例如,将实验性免疫疗法Avelumab与化疗药物Doxorubicin联合使用治疗卵巢癌的效果也在研究过程中。
目前,最常见的生物标志物是 PD-L1,除此之外,还有哪些好的标志物呢?免疫疗法用于不同阶段、不同类型肿瘤的报道将会大量涌现,未来需要选择合适的标志物、挑选最适的患者,然后思考是先给予 PD-1 抑制剂单药、化疗+PD-1 抑制剂、放疗+PD-1 抑制剂、还是联合 BRAF 抑制剂等。
已经做过CTLA-4抗体Yervoy和化疗药物dacarbazine联合的临床,发现二者联合比单纯dacarbazine化疗效果要好,副作用也大,OS 连用11.2月 VS 单用9.1月。这个临床没有设置Yervoy的实验组,所以还不能说明联合确实比单用好。另外,还有Yervoy和紫杉醇以及卡铂连用的临床,发现很有意思的结论:只有先用两次剂量的化疗,然后给四次剂量的Yervoy,才能看到联合组比单纯化疗组PFS有优势;如果,化疗和Yervoy同时给药,联合跟单纯化疗比并没有差别。
PD-1抗体Opdivo也做过联合化疗针对非小细胞肺癌的临床,效果好像不是很好。联合治疗组的效果不比Opdivo单用的效果好。这个临床checkmate 012招募的是没有化疗过的患者,虽然联合治疗的效果不好,但是5mg/kg的 Opdivo能使85%的患者存活超过18个月,是令人吃惊的(百时美Opdivo治疗晚期非小细胞肺癌(NSCLC)具有极显著的持续总生存受益)。
在黑色素瘤中,BRAF V600E突变可以有三种靶向药使用:Vemurafenib,dabrafenib和trametinib,对于BRAF V600E突变型的黑色素瘤有很好疗效,是否需要与免疫治疗药物联合使用,以及如何联合,还是序贯,目前没有明确结论。单纯的联合使用可能会造成很大副作用,序贯使用,可能是选择之一。临床数据表明,针对黑色素瘤BRAFV600E突变的vemurafenib(威罗非尼)跟CTLA-4或PD-1联合使用可能会引发严重的肝脏毒性。不过,在肾细胞癌中,2014年的ACCO公布了sunitinib(舒尼替尼)或Pazopanib(帕唑帕尼)联合Opdivo治疗RCC的结果。Opdivo联合舒尼替尼的ORR是45%,联合帕唑帕尼的ORR是52%,疗效相当不错,这提示两者联合可能具有极大的潜力。
除上述结合之外,不同免疫治疗药物的联合,以及与CDK4/6类抑制剂的结合等,都可能是未来探索的重要方向。其它的,还如与内分泌治疗结合,或mTOR抑制剂类结合,都可能是方向。如,PD-L1 抑制剂 durvalumab (medi4736) 联合放疗和替莫唑胺的研究,联合组的相关数据将于 2017 年公布。如果数据是可靠的,患者未来或许可以远离单纯的细胞毒药物。
小结
目前,免疫制剂的低毒性(至少单药治疗时),使其与化疗联合时更具吸引力。免疫制剂的大部分副作用都是较温和的并且比较好处理。从这点来看,对于患者来说具有潜在毒性的治疗联合低毒性药物就更具吸引力,而非均剧毒性的化疗药物、与放疗联合,靶向治疗联合,都可能是重要的发展趋势。但是,联合治疗的具体方式与方法,以及应用领域,都是未来5年重要的研究方向。通过不断的探索和治疗方案的优化,能够把肿瘤的治疗向前推动一大步!
Levy A, Chargari C, Marabelle A, Perfettini JL, Magné N, Deutsch E. Can immunostimulatory agents enhance the abscopal effect of radiotherapy? Eur J Cancer. 2016 Jul;62:36-45
Ng J, Dai T. Radiation therapy and the abscopal effect: a concept comes of age. Ann Transl Med. 2016 Mar;4(6):118.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












继续关注
117
#联合放疗#
91
很好,不错,以后会多学习
132
很好,不错,以后会多学习
132
大胆创新学习。
130
这篇咨询不错哦,值得学习,对于临床工作和科研思路都很有帮助。
112
#肿瘤治疗#
77
好文章,感谢分享,学习了
83
学习啦,谢谢分享
163
希望治疗肿瘤越来越好
95