重磅:安德森癌症中心余棣华教授Nature文章解读
2016-02-02 佚名 生物谷
余棣华教授,美国德州大学安德森癌症中心分子肿瘤细胞学系主任,终身教授,美国科学发展学会院士和美国德州教育学院院士,美国华人生物学会会长。 在三月份生物谷主办的2016首届外泌体与疾病研讨会上,余棣华教授将会作为大会主席出席并在大会上做相关的报告。让我们先来一睹为快余教授的两篇重磅级研究成果解读: 1.Zhang,L.,et al. (2015). "Microenvironment-i

余棣华教授,美国德州大学安德森癌症中心分子肿瘤细胞学系主任,终身教授,美国科学发展学会院士和美国德州教育学院院士,美国华人生物学会会长。
在三月份生物谷主办的2016首届外泌体与疾病研讨会上,余棣华教授将会作为大会主席出席并在大会上做相关的报告。让我们先来一睹为快余教授的两篇重磅级研究成果解读:
1.Zhang,L.,et al. (2015). "Microenvironment-inducedPTEN loss by exosomal microRNA primes brain metastasis outgrowth." Nature.
IF=41.457
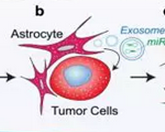
. 外泌体在肿瘤方面的功能逐渐受到重视,越来越多的报道开始展示出外泌体在肿瘤发生发展中的作用。在肿瘤的研究中,转移一直是肿瘤的关键,90%的肿瘤病人死亡的原因并非原位肿瘤的生长而是因为转移瘤对病人的致命打击。近年来,对肿瘤转移机制的研究十分火热,研究者们对这方面的进展的关注度也十分高涨。但多数研究都是从肿瘤细胞自身入手,寻找肿瘤细胞对转移靶器官微环境的适应或者改造,大量的研究报道倾向于认为肿瘤的转移多是由于转移靶器官微环境对肿瘤细胞的适应性筛选,转移瘤与原位瘤的差异主要来源于转移靶器官对转移细胞的筛选压力。虽然有种种迹象表明肿瘤细胞与转移微环境间存在相互作用,并且大量报道证实肿瘤细胞具有对转移靶器官微环境的改造能力,但关于转移靶器官对肿瘤细胞影响的报道却较为鲜见,较为完整阐释转移靶器官微环境对肿瘤细胞改造机制的报道更是凤毛麟角。10月19日,nature报道了来自德克萨斯大学安德森癌症研究中心的发现。
Dihua Yu研究组发现正常表达PTEN的肿瘤细胞在脑部定植时,其PTEN的表达会降低,当从脑部重新分离出来后,其PTEN表达水平会恢复到之前水平。进一步研究发现肿瘤细胞转移到脑部后可以被神经胶质细胞分泌的外泌体所改造,其外泌体内部携带的大量的miRNA-19a可以靶向肿瘤细胞内的PTEN mRNA从而影响肿瘤细胞内PTEN的蛋白水平,通过这一途径进而影响CCL2和NF-kB等通路促进肿瘤细胞的增殖,提升肿瘤细胞的抗凋亡能力,就这样通过神经胶质细胞的"教唆",肿瘤细胞适应并改造了脑部微环境,为其转移定植和形成转移灶提供了环境基础。
下边是外泌体之家-hzangs对这篇文章的行文思路和创新点的解析。
该文章的实验研究思路相对简单,所涉及到的实验平台也相对较少。但文章的思路标新立异,另辟蹊径解释了一个在基础的gain of function(OE)和lose of function(KD)试验中没有表型的基因是如何真正发挥功能的。作者严谨的治学态度和缜密的思维值得我们学习和仿效。
首先,文章作者通过分析公共数据库中大量的测序数据,对比了病人中脑转移瘤和原位瘤的表达差异并且发现PTEN在脑转移瘤中表达水平明显低于原位瘤。按照一般的假设思路,作者提出了"PTEN的低表达促进肿瘤细胞的脑转移"。因此开始使用 lose of function(KD)的方法降低PTEN在肿瘤细胞的表达,以正常表达PTEN的细胞为对照开始体内实验。但是体内实验的结果很奇怪,作者发现PTEN低表达的细胞转移能力与PTEN正常表达细胞转移能力没有差别。 按照很多人的思路,到这里 可能会认为PTEN只是一个biomarker 因此放弃对其机制的进一步研究。但是作者并没有这么做,作者的严谨和缜密就在于此,他们将目光集中到为什么没有差异。随着新的疑问的提出,假设也随之建立"肿瘤细胞中的PTEN水平在脑组织微环境中受到影响而被降低",依据此假设,设计了实验分别追踪体外、原位、肺转移灶、脑转移灶中的PTEN水平。最终发现,肿瘤细胞中的PTEN只在脑微环境的作用下被特异性的下调。
然后,作者将目光放在了寻找微环境中影响肿瘤细胞PTEN水平的因素方面。排除了通过细胞连接传递的信号的途径后,外泌体的功能走就了文章。通过阐释外泌体中miRNA-19a从胶质细胞传递到肿瘤细胞并抑制后者PTEN mRNA水平,解释了肿瘤细胞中PTEN在脑微环境中被下调的现象。
最后,通过常规的信号通路的分析,解释了肿瘤细胞中PTEN的降低与肿瘤细胞脑转移能力增强之间的关系。
该文章的亮点主要包括两方面,1、通过外泌体途径解释了肿瘤细胞被胶质细胞影响从而展现出在体内体外不同的PTEN表达水平。发现了潜在的抑制脑转移的药物靶点 2、详细的展示了一个微环境改造肿瘤细胞的案例,并且暗示可能在之前的研究中,一些样本中差异明显而实验中没有功能的基因可能恰恰是通过这样的途径发挥功能的。 (评述来源:外泌体之家-hzangs )
原文摘要:
The development of life-threatening cancer metastases at distant organs requiresdisseminated tumour cells' adaptation to, and co-evolution with, thedrastically different microenvironments of metastatic sites. Cancer cells ofcommon origin manifest distinct gene expression patterns after metastasizing todifferent organs. Clearly, the dynamic interaction between metastatic tumourcells and extrinsic signals at individual metastatic organ sites criticallyeffects the subsequent metastatic outgrowth. Yet, it is unclear when and howdisseminated tumour cells acquire the essential traits from themicroenvironment of metastatic organs that prime their subsequent outgrowth.Here we show that both human and mouse tumour cells with normal expression ofPTEN, an important tumour suppressor, lose PTEN expression after disseminationto the brain, but not to other organs. The PTEN level in PTEN-loss brainmetastatic tumour cells is restored after leaving the brain microenvironment.This brain microenvironment-dependent, reversible PTEN messenger RNA andprotein downregulation is epigenetically regulated by microRNAs from brainastrocytes. Mechanistically, astrocyte-derived exosomes mediate anintercellular transfer of PTEN-targeting microRNAs to metastatic tumour cells, whileastrocyte-specific depletion of PTEN-targeting microRNAs or blockade ofastrocyte exosome secretion rescues the PTEN loss and suppresses brainmetastasis in vivo. Furthermore, this adaptive PTEN loss in brain metastatictumour cells leads to an increased secretion of the chemokine CCL2, whichrecruits IBA1-expressing myeloid cells that reciprocally enhance the outgrowthof brain metastatic tumour cells via enhanced proliferation and reducedapoptosis. Our findings demonstrate a remarkable plasticity of PTEN expressionin metastatic tumour cells in response to different organ microenvironments,underpinning an essential role of co-evolution between the metastatic cells andtheir microenvironment during the adaptive metastatic outgrowth. Our findings signifythe dynamic and reciprocal cross-talk between tumour cells and the metastaticniche; importantly, they provide new opportunities for effectiveanti-metastasis therapies, especially of consequence for brain metastasispatients.
2. 14-3-3ζ Turns TGF-β's Function from Tumor Suppressor to MetastasisPromoter in Breast Cancer by Contextual Changes of Smad Partners from p53 toGli2
癌症研究人员发现,在分子遗传学的世界中也存在"善与恶"并存的现象。其中一个例子就是转化生长因子β(TGF-β),这一在早期癌症形成过程中抑制肿瘤进展的蛋白,在细胞一旦进入到癌变状态后实际上对癌症扩散起促进作用。TGF-β是在何时及如何将其功能角色从肿瘤抑制因子切换至转移促进因子的,是一个长期存在的谜题。来自德克萨斯大学MD安德森癌症中心的科学家们确信他们已经找到了答案。
著名华人科学家、德克萨斯大学MD安德森癌症中心分子和细胞肿瘤学部副主任余棣华(Dihua Yu)教授领导了这一研究。在这项研究中,余教授证实另一种叫做14-3-3ζ的蛋白可通过改变SMAD的伴侣蛋白,将TGF-β从在癌前细胞中抑制肿瘤切换至在乳腺癌细胞中促进转移--扩散至骨骼。研究结果发布在《癌细胞》(Cancer Cell)杂志上。
TGF-β扮演了双重角色,其既在正常和癌变前细胞中充当了肿瘤抑制因子,也在晚期癌症中发挥了转移促进因子作用。然而TGF-β切换其角色的分子机制长期以来却是癌症研究人员的一个未解之谜。通过解释14-3-3ζ导致重要蛋白p53失稳定,随后关闭TGF-β肿瘤抑制能力的机制,在某种程度上有可能为解开这一谜题提供了一把钥匙。此外,它也通过稳定另一种蛋白GLi2促进了癌症骨转移。
已知TGF-β在癌症中起至关重要的作用,促使科研人员付诸了极大的努力来开发可用于抗癌治疗的TGF-β抑制剂。然而在抑制肿瘤进展的同时又可充当癌症转移的跳板,TGF-β的这一倾向成为了开发抗TGF-β疗法的一个主要障碍。研究者开发了一种模型,提出TGF-β的复杂特性或许受到SMAD伴侣蛋白的细胞效应的支配。
SMAD蛋白帮助调控了一些特异基因的活性以及细胞生长和分裂。事实上,它们将来自细胞外的TGF-β信号传送到细胞核中,影响了细胞如何生成其他的蛋白。SMAD通过与p53蛋白合伙在癌变前细胞中抑制肿瘤,并帮助GLi2蛋白促进癌症骨转移由此赋予了TGF-β善恶特性。
更好地定义蛋白质的这种分子搅拌缸 (Mixing Bowl)或许可促成一些新的疗法,以更有效地方式来靶向TGF-β在癌症中的关键作用。由于TGF-β在各种生理功能中起着重要的作用,让我们看看如何开发出一个更特异性的药物来选择性靶向癌症中的TGF-β,在癌变前细胞中阻止其引发转移能力的同时维持它的肿瘤抑制能力,这至关重要。
原文摘要:
Transforming growth factor β (TGF-β) functions as atumor suppressor in premalignant cells but as a metastasis promoter in cancercells. The dichotomous functions of TGF-β are proposed to be dictated by differentpartners of its downstream effector Smads. However, the mechanism for thecontextual changes of Smad partners remained undefined. Here, we demonstratethat 14-3-3ζ destabilizes p53, a Smad partner in premalignant mammaryepithelial cells, by downregulating 14-3-3σ, thus turning off TGF-β's tumorsuppression function. Conversely, 14-3-3ζ stabilizes Gli2 in breast cancercells, and Gli2 partners with Smads to activate PTHrP and promote TGF-β-inducedbone metastasis. The 14-3-3ζ-driven contextual changes of Smad partners fromp53 to Gli2 may serve as biomarkers and therapeutic targets of TGF-β-mediatedcancer progression.

参会咨询&媒体合作:
束婷婷
E-mail:tingting.shu@bioon.com
Tel:86(21)64879183-620
Mob:18521051573
地址:中科院上海学术活动中心
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Nat#
88
#重磅#
77
佩服
167