【衡道丨病例】前列腺导管内癌、HGPIN、PIN样癌及导管腺癌的病理诊断与鉴别诊断
2025-04-03 衡道病理 衡道病理
今天就由上海交通大学医学院附属瑞金医院贾景丹老师为大家分享前列腺导管内癌、HGPIN、PIN样癌及导管腺癌的病理诊断与鉴别诊断要点。
前列腺导管内癌如何诊断
诊断要点
定义:
前列腺导管内癌(Intraductal carcinoma of the prostate,IDC-P)为导管-腺泡结构中上皮的肿瘤性增生,其结构和细胞学的不典型性超过了高级别前列腺上皮内瘤变(HGPIN)的范围。
发生部位:
最常位于外周区,几乎总是伴有浸润性高级别前列腺腺癌。
组织结构:
局限在固有导管和腺泡内,呈实性或致密筛状结构,至少保留部分基底细胞层。
分子特征:
ERG 基因重排、PTEN 缺失常见。
临床重要性:
与复发、无进展生存期、远处转移相关。
预后:
独立的预后因子,提示分期晚,预后差。
第五版WHO更新

第五版WHO前列腺导管内癌-诊断标准
基本标准:
-
原来存在的导管-腺泡系统中上皮细胞扩张性增生
-
实性、致密筛状结构和/或粉刺状坏死
-
疏松的筛状或微乳头状结构,需有多形性细胞核
-
残留基底细胞
理想标准:
-
免疫组化显示至少部分基底细胞保留
镜下形态
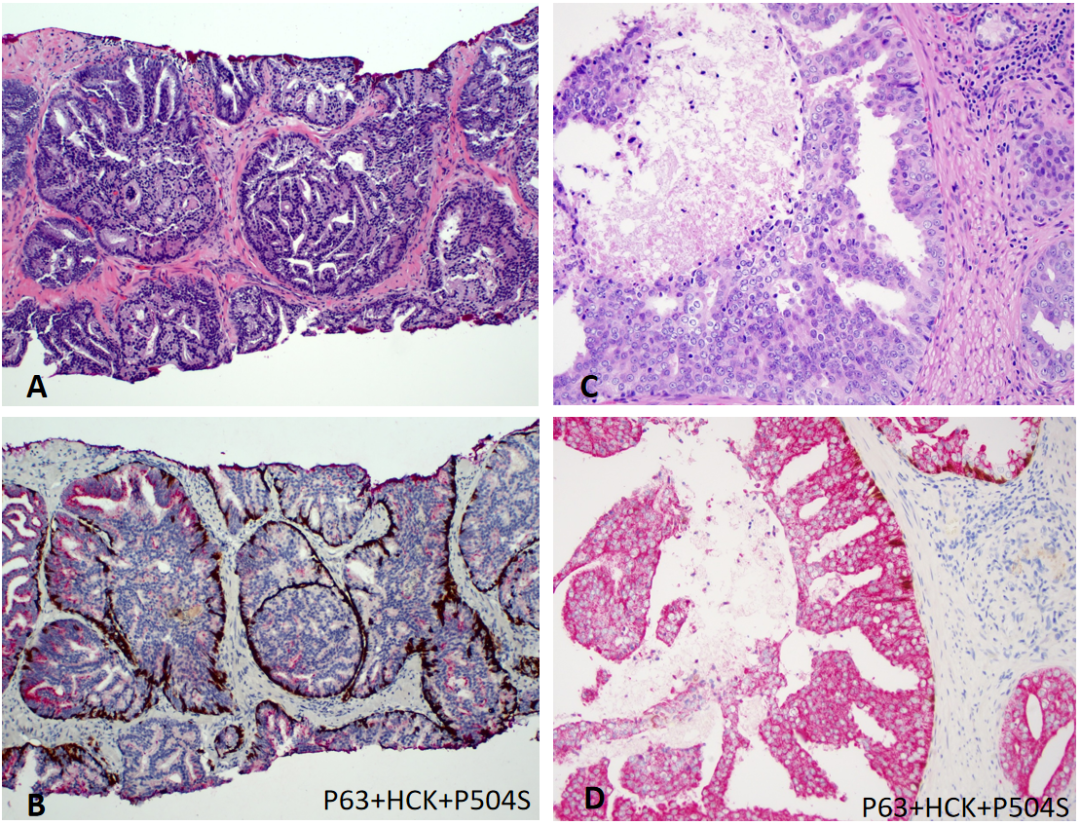
A.穿刺活检显示致密筛状腺体。B.p63和HCK免疫染色显示周围基底细胞,肿瘤细胞中P504S阳性。C.图A高倍。D.图B高倍。
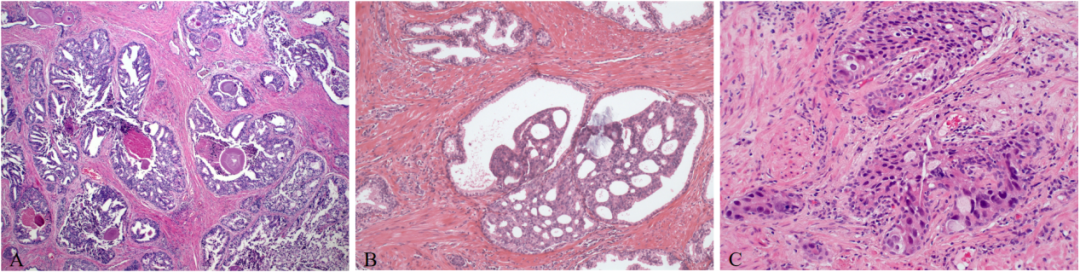
A.密集的筛状腺中可见粉刺状坏死(淀粉样结晶存在于多个腺体中,提示先前存在的良性腺体受累)。B.良性腺体部分受累。C.明显多形性细胞核。

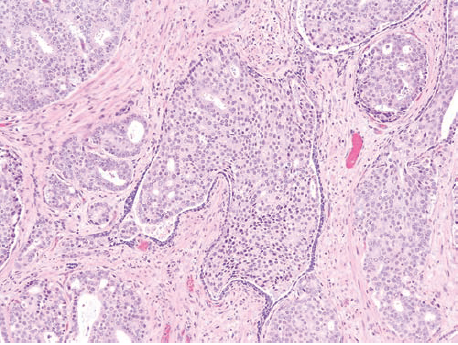
病变腺体为致密筛状结构,周围存在基底细胞
Gleason评分
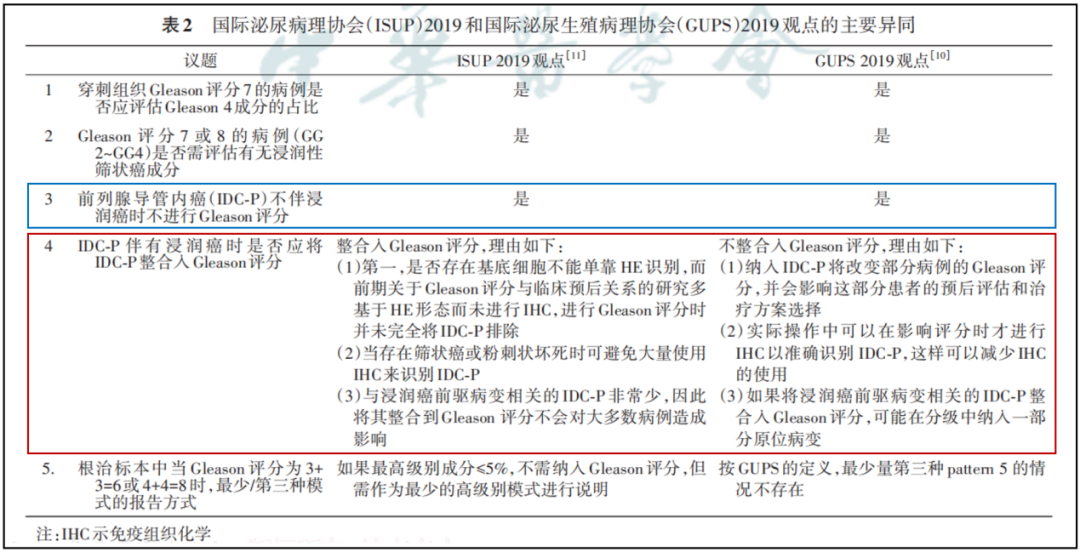
鉴于目前两个协会尚未达成共识,建议病理医师在日常诊断工作和科研工作中,应说明使用的是哪个协会推荐的分级系统
高级别前列腺上皮内瘤变如何诊断
诊断要点
定义:
高级别前列腺上皮内瘤变(High-grade prostatic intraepithelial neoplasia,HGPIN)是一种前列腺内不典型分泌细胞的增生,是前列腺浸润性腺癌最早的组织学上可识别的前驱病变。
发生部位:
最常位于外周区,少见于中央区和移行区。
发病机制:
欧美人群中 20%-30% 的HGPIN存在TMPRSS2::ERG,PTEN 缺失率23%。
分子特征:
ERG 基因重排、PTEN 缺失常见。
临床重要性:
活检标本中HGPIN的发生率约9%(4%-16%);在最初诊断为孤立的HGPIN后,重复活检的肿瘤发生率为20-25%。
病理学特点
组织结构:
不典型分泌细胞排列在原有的导管和腺泡的腺体结构上,基底细胞层存在,通常不连续。
细胞形态:
细胞多层,细胞核增大、深染、密度增加,胞浆嗜双色;关键条件:存在明显核仁。
常见组织学模式:
簇状、微乳头状和扁平状。
少见组织学模式:
小细胞样、空泡状(印戒样)、泡沫样、黏液样、内翻样以及伴鳞状分化。
镜下形态
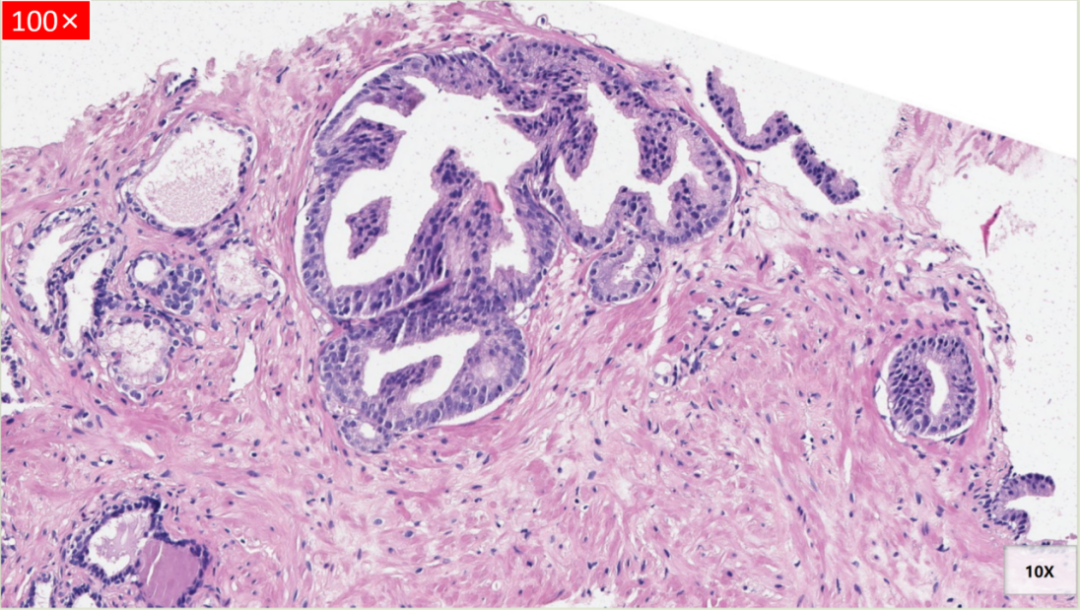
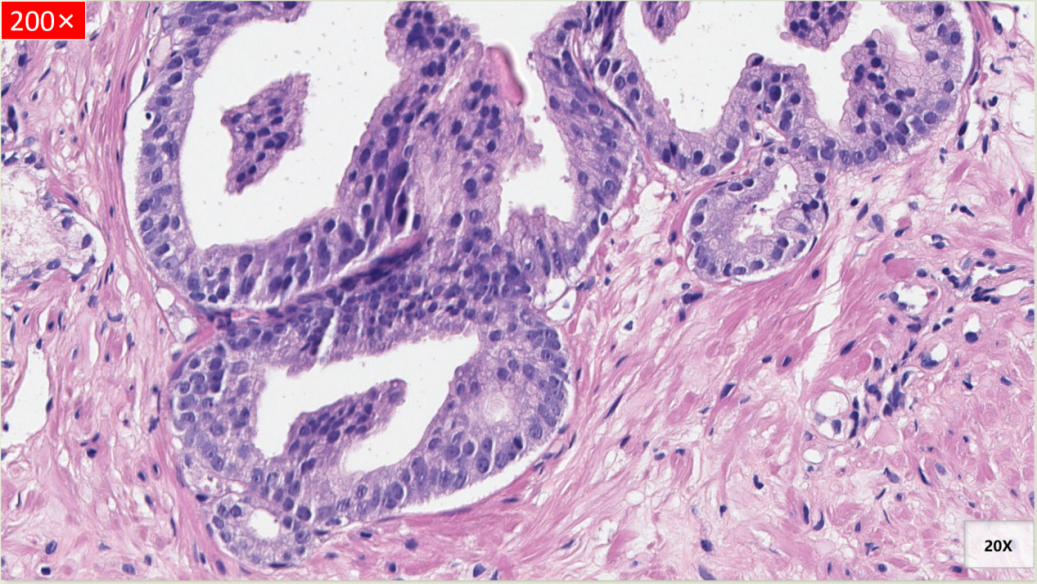
细胞多层,细胞核增大、深染、密度增加,胞浆嗜双色
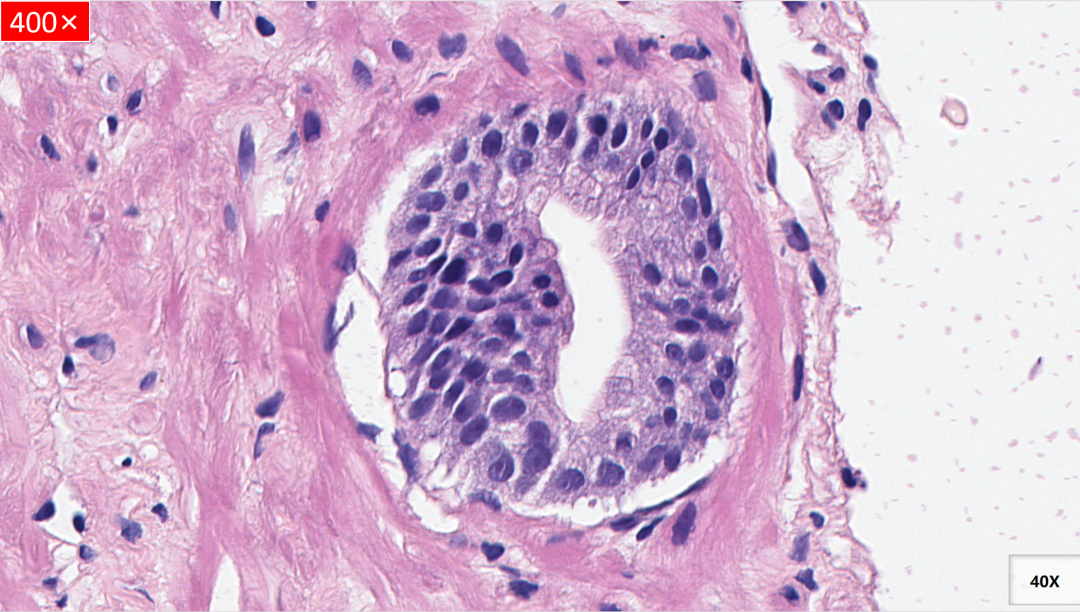
细胞多层,细胞核增大、深染、密度增加,胞浆嗜双色,可见明显核仁
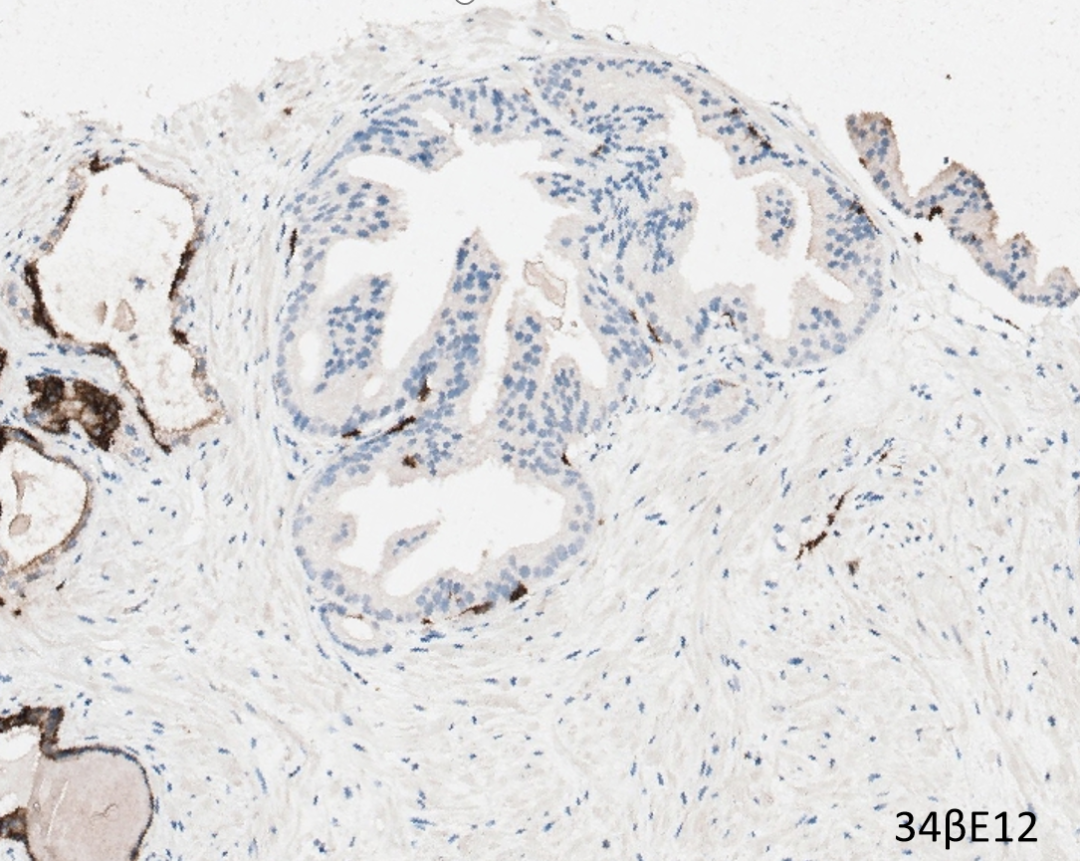
免疫组化
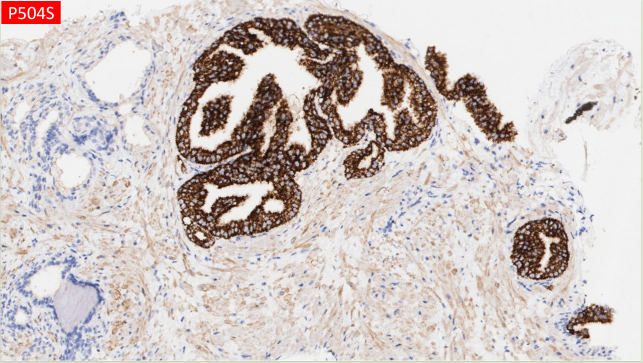
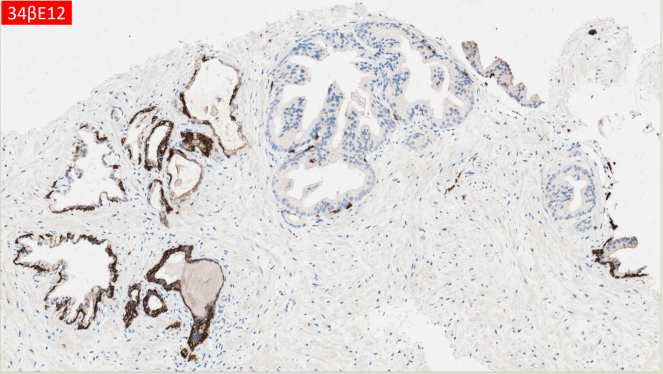
病变腺体P504S阳性,34βE12显示病变腺体周围有不连续基底细胞存在
常见组织学模式
簇状、微乳头状
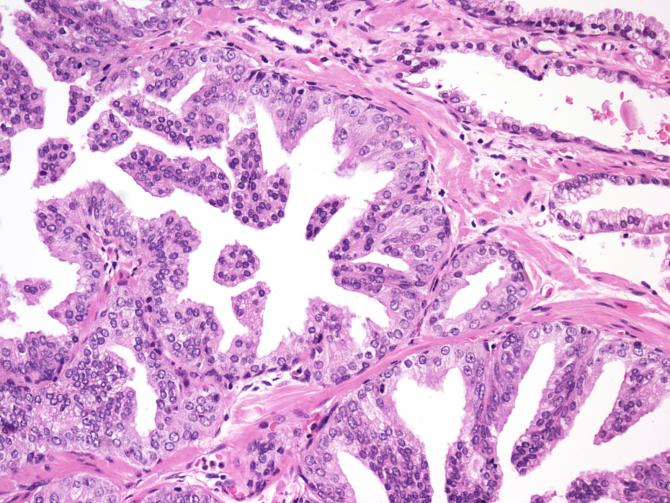
簇状、扁平状

扁平状
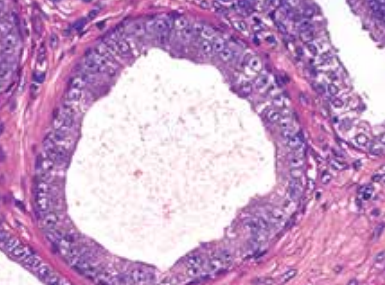
少见组织学模式
小细胞样
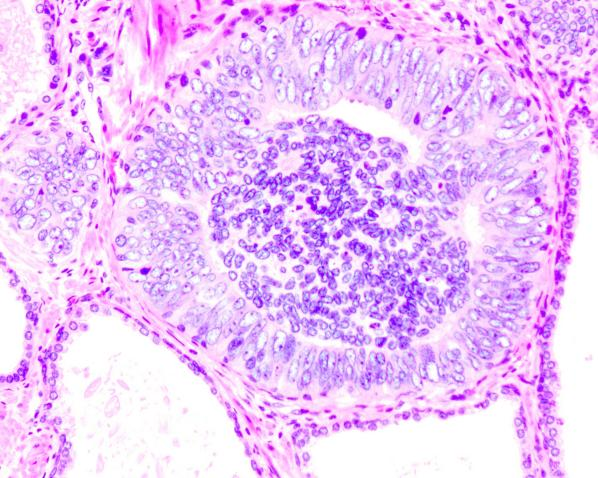
内翻样
泡沫细胞样
第五版WHO更新
筛状结构不再作为HGPIN的组织学模式(存在争议),不建议在穿刺活检中诊断。
若细胞异型性较大,为致密筛状结构【腺体细胞占比>腺腔面积(>50%)】,则诊断为前列腺导管内癌(IDC-P);
若为导管内筛状异型增生,形态学介于HGPIN和IDC-P,可诊断为:
“ 不典型筛状增生(atypical cribriform proliferation)”
“ 不典型导管内增生(atypical intraductal proliferation,AIP)”
“不典型导管内增生,疑为IDC-P(atypical intraductal proliferation suspicious for IDC-P)”
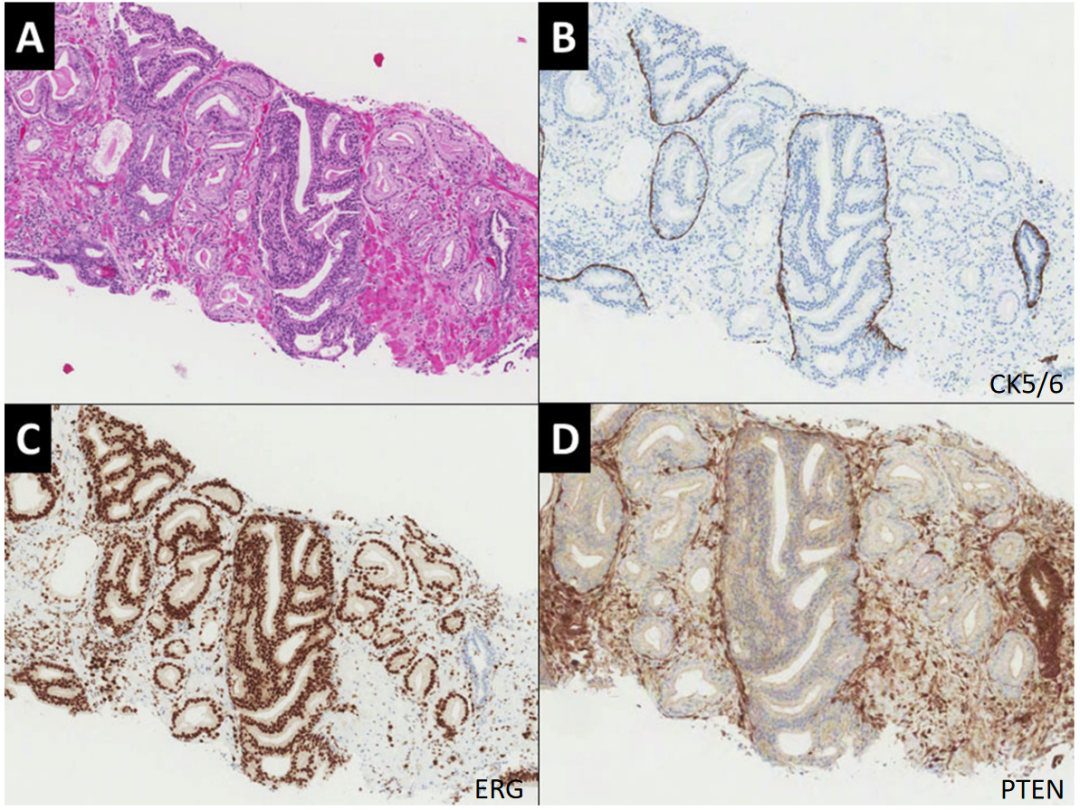
不典型导管内增生,病变腺体呈筛状结构,周围有基底细胞围绕(CK5/6+),同时有ERG表达及PTEN缺失。
现在我们认识了导管内癌和高级别前列腺上皮内瘤变,二者病变腺体的周围都有基底细胞存在,当病变腺体周围无基底细胞存在时,该如何诊断呢?如下图:
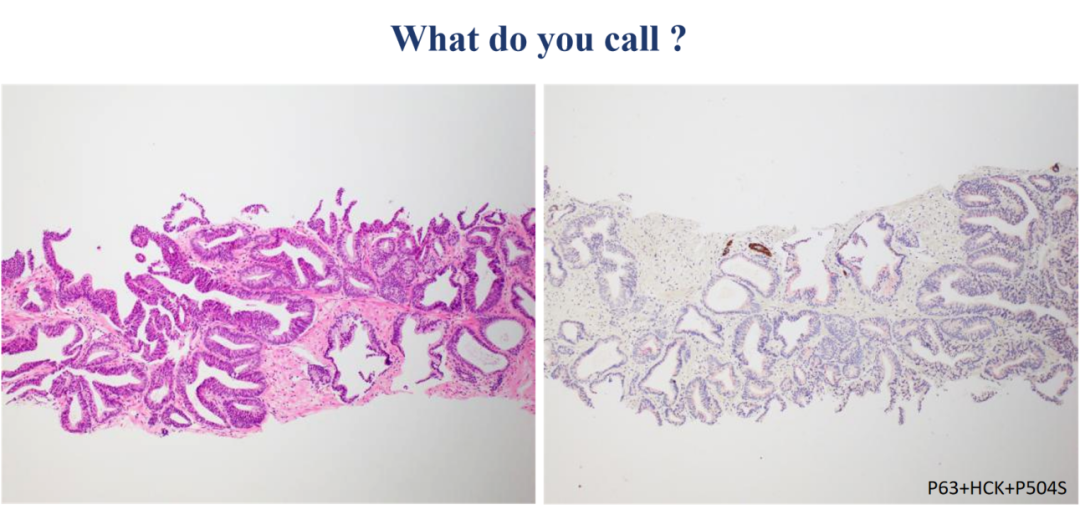
没错,这就是PIN样癌。
PIN样癌如何诊断
诊断要点
定义:
PIN样癌(Prostatic intraepithelial neoplasia-like carcinoma)是一种类似HGPIN的罕见癌。
组织结构:
通常由大的、相互分离的扁平或簇状结构的腺体构成。
细胞形态:
被覆假复层上皮,核拉长,染色质丰富,类似导管腺癌;被覆立方状上皮,核圆形,可见明显核仁,类似腺泡腺癌。
分子改变:
RAF/RAS通路激活突变。
预后:
预后良好,Gleason评分 3+3=6。
第五版WHO更新
因其生物学行为和基因改变更接近于腺泡腺癌,所以归类为前列腺腺泡腺癌的组织学亚型之一。

镜下形态
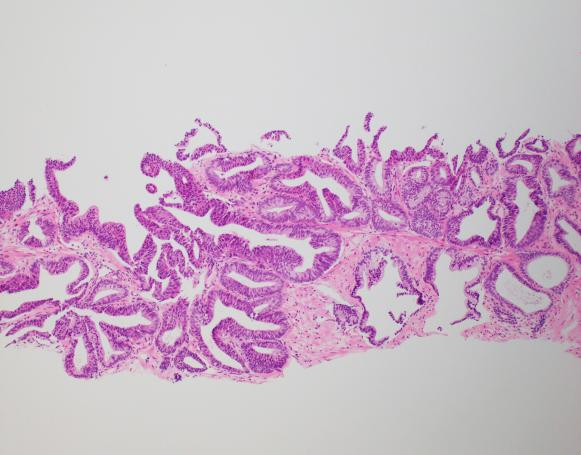
腺体形态类似HGPIN,腺体拥挤程度远超过HGPIN
鉴别诊断
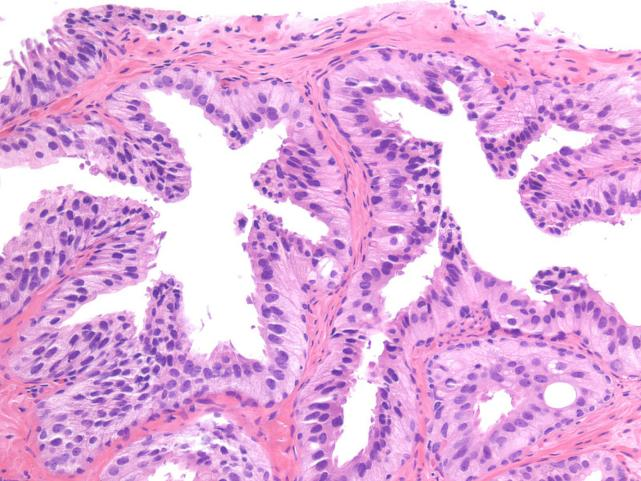
PIN样癌与HGPIN的鉴别:前者无基底细胞
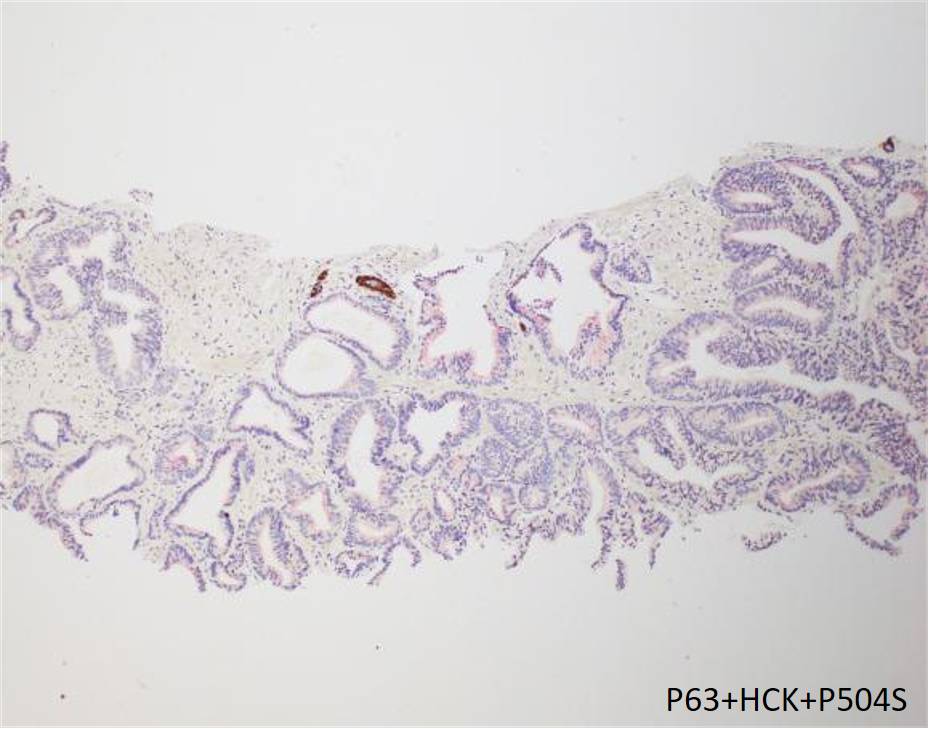
图左:PIN样癌;图右:HGPIN
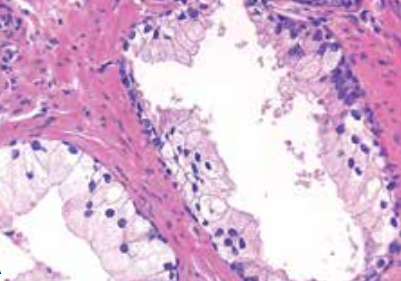
PIN样癌与导管腺癌的鉴别:前者缺乏纤维血管轴心构成的真性乳头、筛状结构和坏死
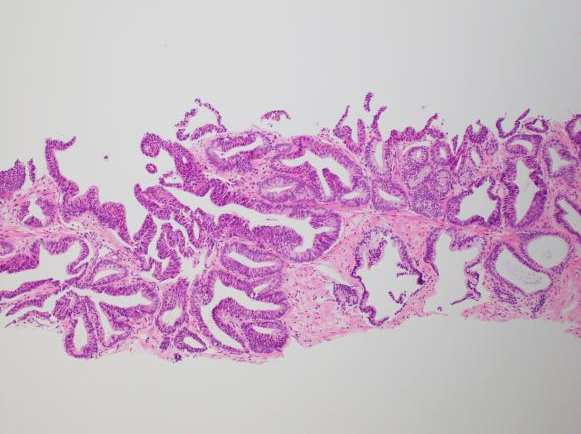
图左:PIN样癌;图右:导管腺癌
前列腺导管腺癌如何诊断
诊断要点
定义:
前列腺导管腺癌(Prostatic ductal adenocarcinoma)由乳头状结构和/或由假复层高柱状细胞衬附的复杂筛状腺体组成。
发生部位:
最常位于外周区,也可位于移行区,尤其是前列腺尿道周围(包括前列腺前部)。
分型:
A型-尿道中央型,是尿道周围的小肿瘤,可经尿道前列腺切除术切除;
B型-腺内浸润型。
根治标本:
要求导管腺癌形态>50%(报比例)。
穿刺标本:
“具有导管特征的前列腺腺癌”(adenocarcinoma with ductal features),而不能直接报导管腺癌。
治疗及预后:
复发率高,对抗雄激素治疗效果差。
转移:
可转移至肺、肝脏及其他不常见部位(脑、皮肤、阴茎、睾丸等)。
病理学特点
组织形态:
乳头状结构(有纤维血管轴心)、复杂筛状,间质促结缔组织增生。
细胞形态:
假复层高柱状细胞,胞浆丰富,嗜双色、苍白或透明,细胞核拉长,核仁大而明显,核分裂象多。
免疫表型:
PSA、PAP、PSMA、NKX3-1、P504S,CK20斑片状+(23-60%)。
分子机制:
导管腺癌与腺泡腺癌常混合存在,均有ERG 重排和其他基因组改变。
Gleason评分:乳头状、筛状为4级,合并粉刺样坏死为5级。
镜下形态
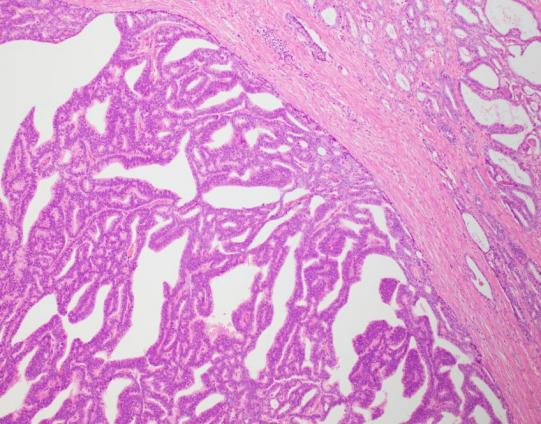
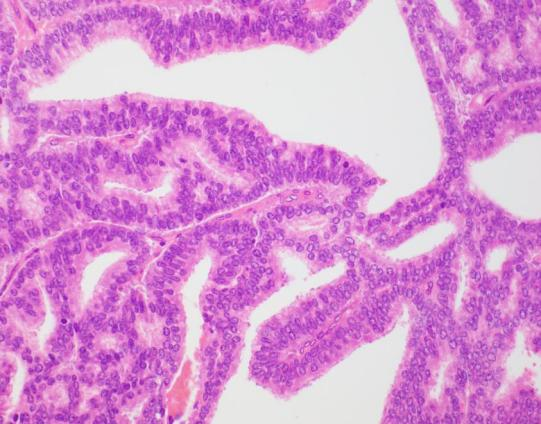
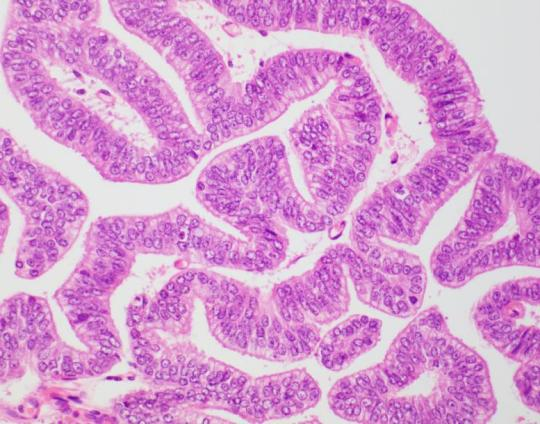
图左:筛状和乳头状结构;图中:假复层高柱状上皮;图右:复层高级别核
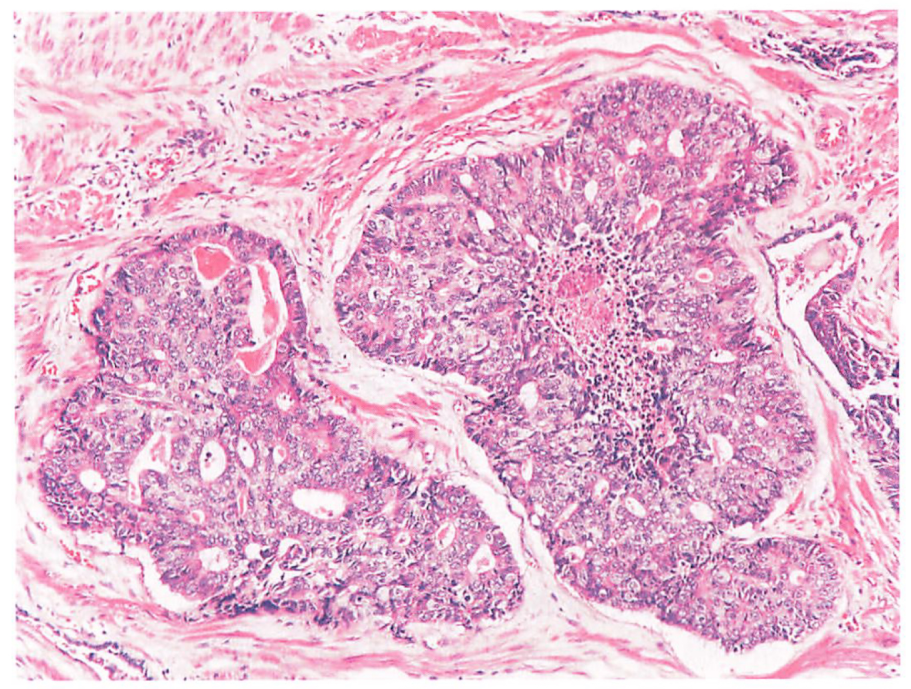
图左:乳头状结构(有纤维血管轴心);图右:复杂筛状结构
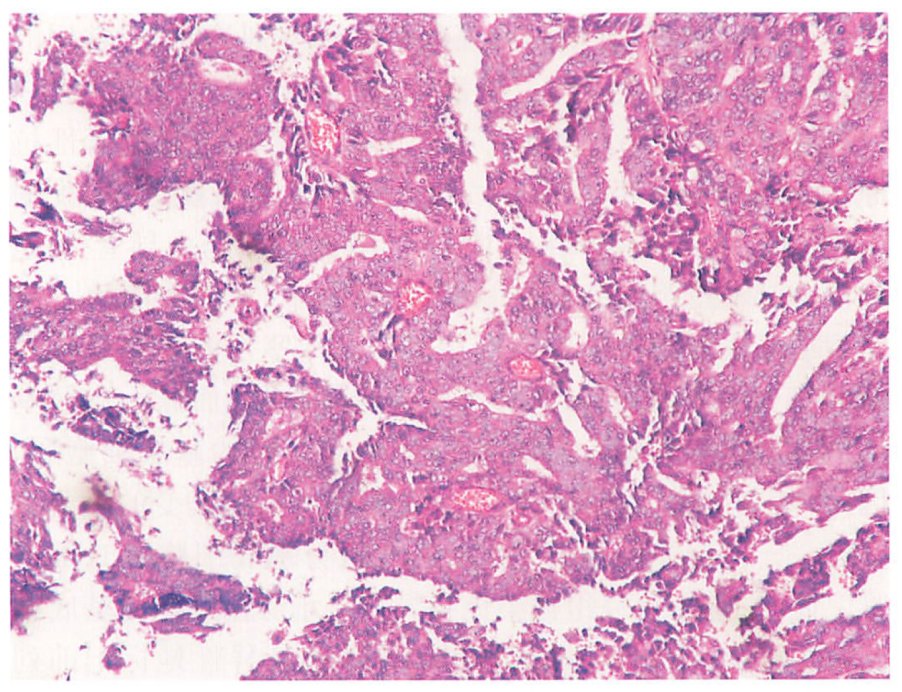
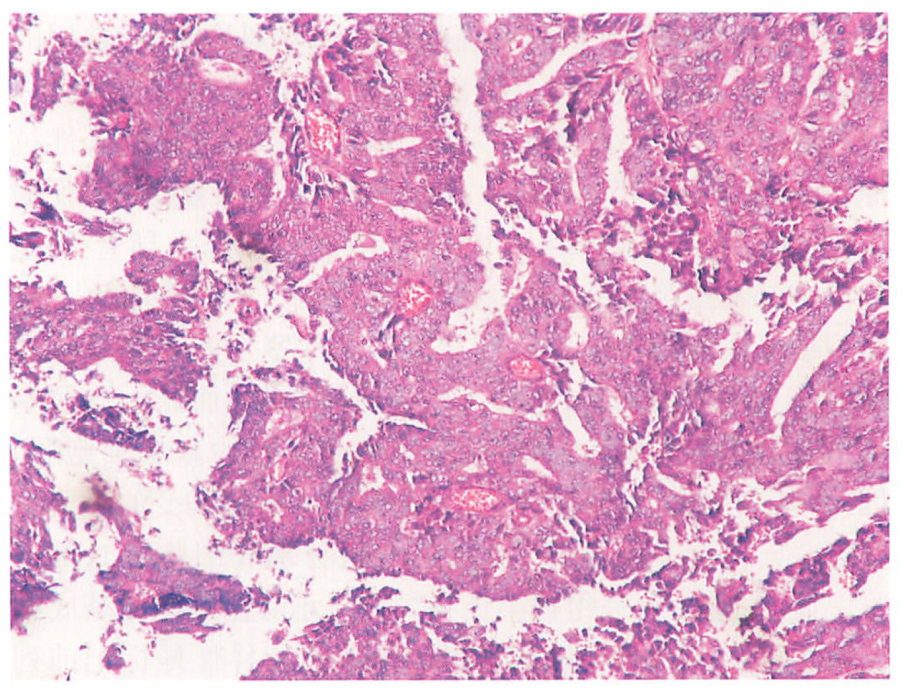
前列腺导管腺癌转移到肺
穿刺标本
“具有导管特征的前列腺腺癌”(adenocarcinoma with ductal features)
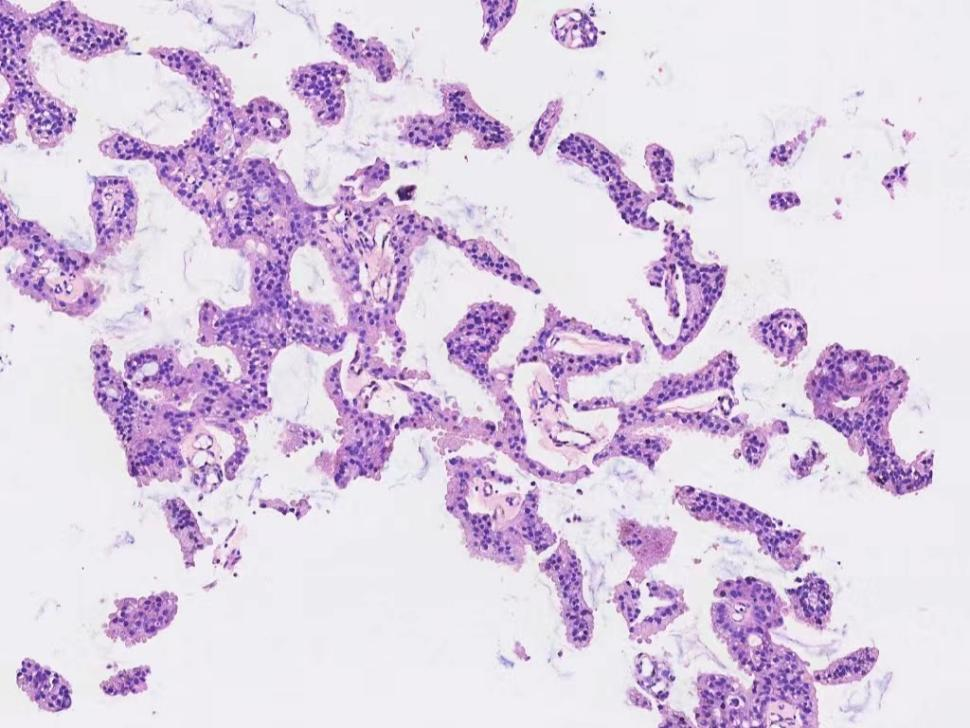
前列腺穿刺组织,局部可观察到具有纤维血管轴心的真性乳头结构
导管腺癌的导管内生长
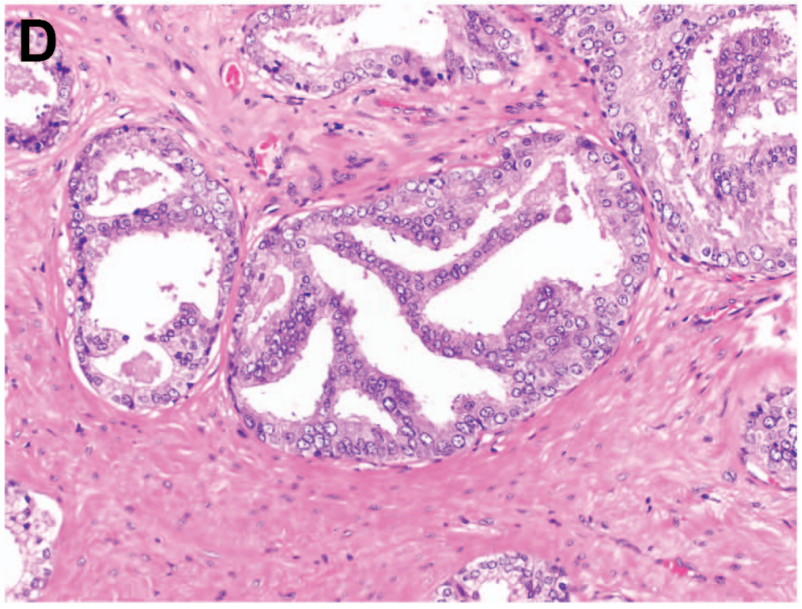
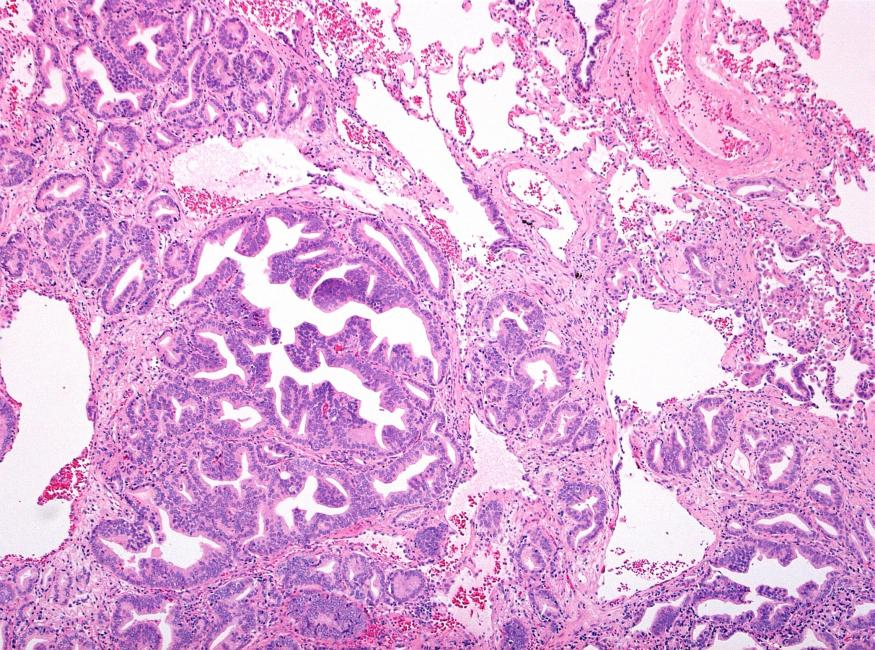
有一种情况可看到导管腺癌周围有基底细胞,就是导管腺癌可长入前列腺的正常导管内,免疫组化显示的病变腺体周围的基底细胞为正常导管周围的基底细胞,而不是导管腺癌成分中存在基底细胞(如下图)。
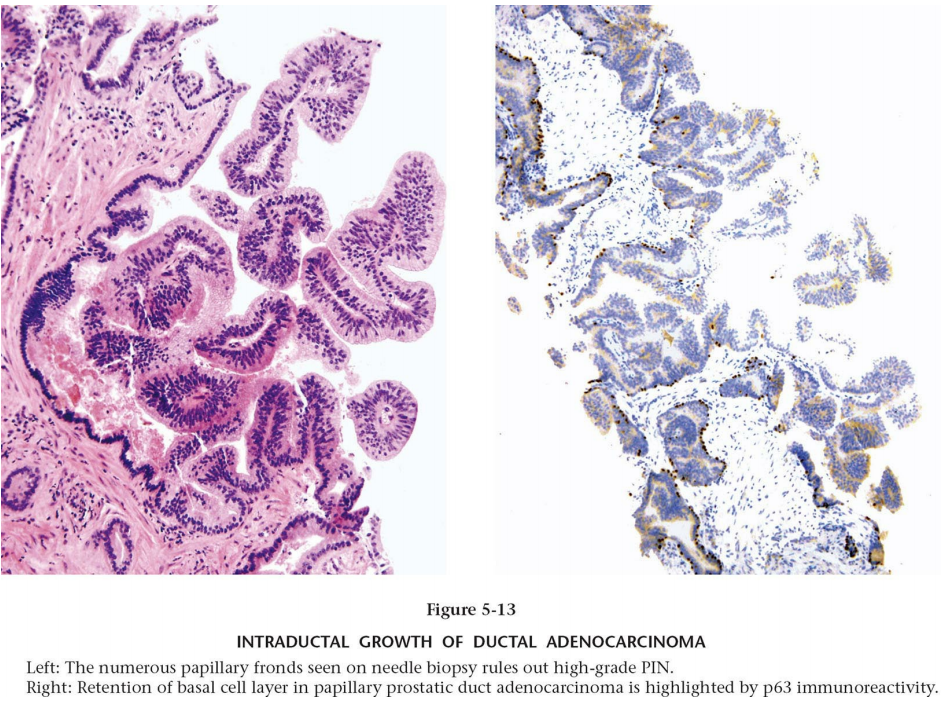
导管腺癌的导管内生长。图左:穿刺活检中看到的众多乳头状结构,可排除高级别PIN。图右:P63显示导管腺癌周围有基底细胞层的保留。
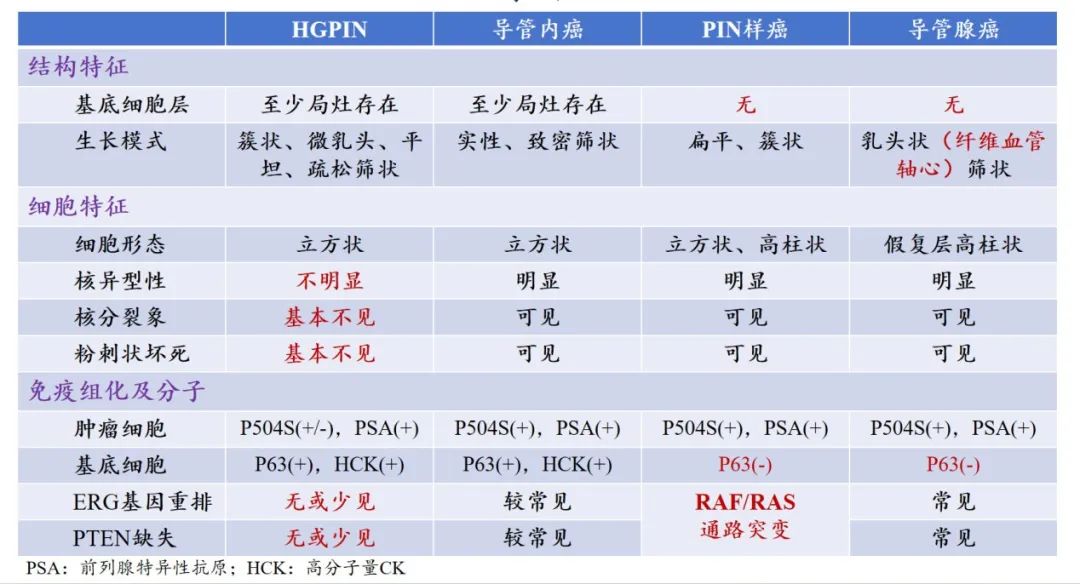
小结
参考文献及书籍:
1.WHO Classification of Tumours of Urinary and Male Genital Tumours. 5th Edition.
2.WHO Classification of Tumours of Urinary and Male Genital Tumours. 4th Edition.
3.中华病理学杂志
4.刘彤华诊断病理学 第4版
5.The Armed Forces Institute of Pathology.
6.Contemporaryprognostic indicators for prostate cancer incorporating International Society of Urological Pathology recommen- dations. Pathology.2018 Jan;50(1):60-73.
7.Khani F.Precursor Lesions of Urologic Malignancies[J].Archives of pathology & laboratory medicine,2017,141(12):1615-1632.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#诊断# #前列腺肿瘤#
10