最大限度降低重型颅脑损伤患者脑缺氧的“MANTLE”集束化治疗
2024-05-19 重症医学 重症医学 发表于上海
了解氧的生理学和动力学,以及低氧的各种病因,结合临床推理和个性化治疗,即使未使用先进和特定的神经监测设备的情况下,也有助于最大限度地减少颅内高热性缺氧的发病率及其直接且危险的后果。
摘要
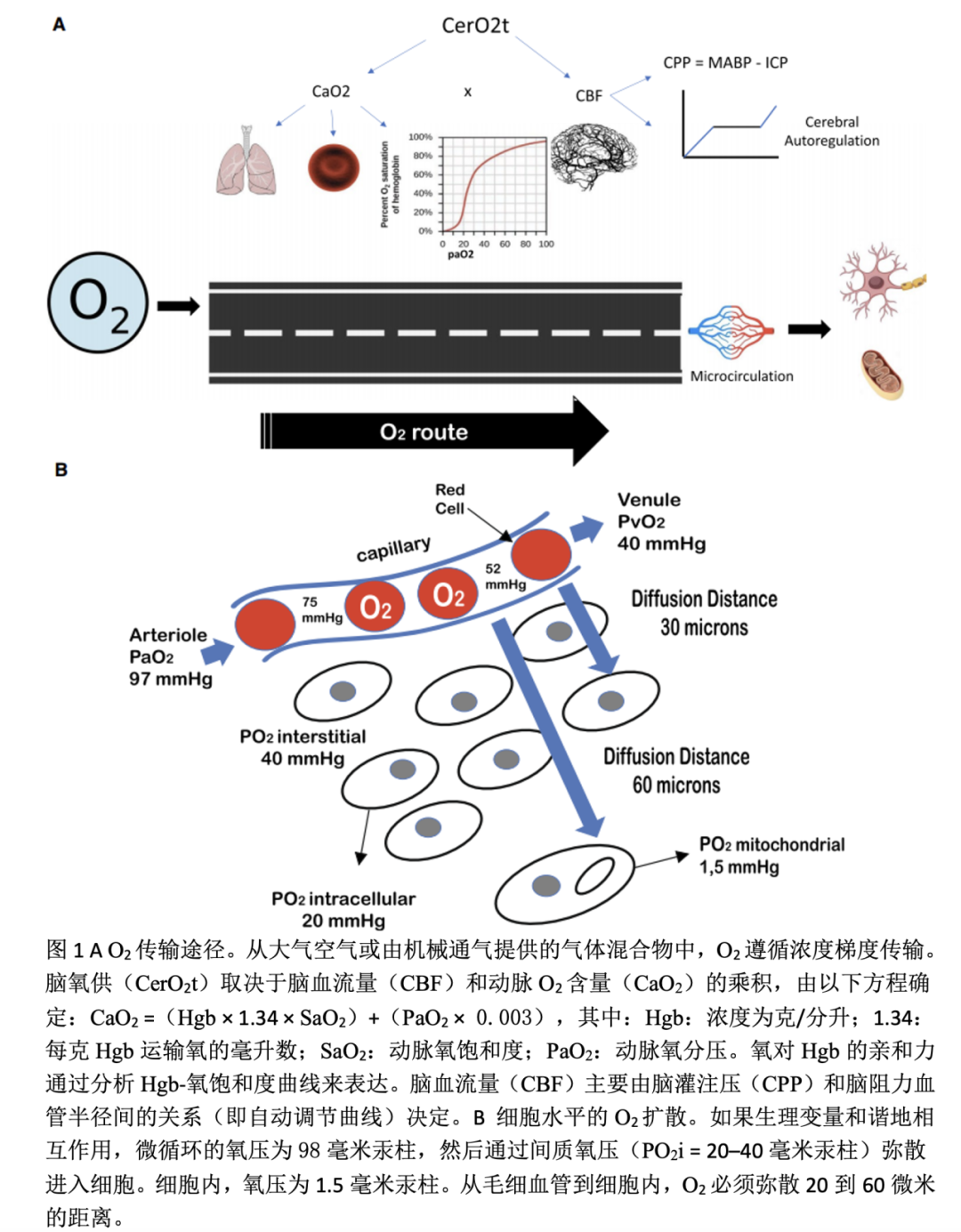
为保证严重颅脑外伤后神经元存活,供氧至关重要。脑组织氧合代表了氧供和消耗之间的平衡,很大程度上反映了脑灌注是否充分。多个生理参数决定了脑氧的输送,通过呼吸链,血压、血红蛋白水平、全身氧合、微循环和许多因素参与了脑氧输送到其最终受体的过程。当供氧不足或因某些原因氧不能在细胞水平利用时,脑组织就会缺氧。缺氧原因多种,可沿“氧运送途径”分析其病理生理学。目前的趋势是精准医学,这是一种针对特定脑损伤的病理生理学行个性化和治疗性治疗的医学,然而,这需要多模式监测。为此,我们开发了首字母缩写“MANTLE”,这是一系列覆盖和保护大脑的治疗干预,优化了从环境空气到线粒体氧运输系统的各个部分。
引言
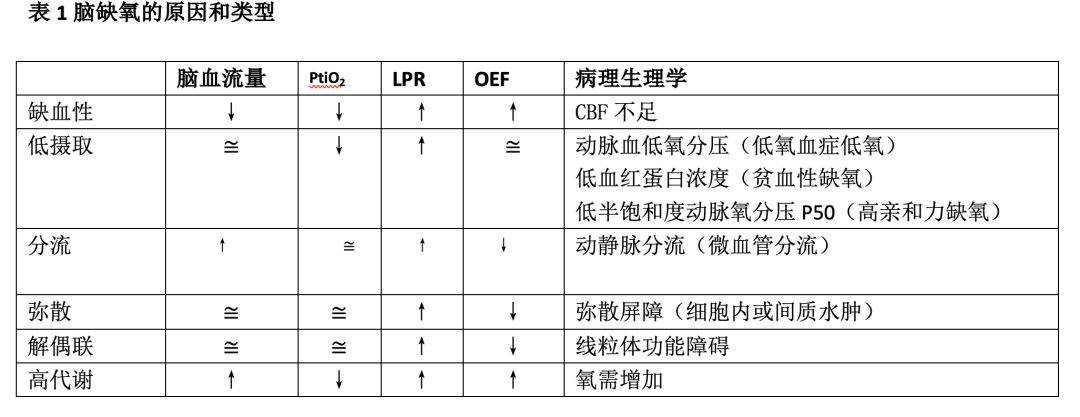
氧(O2)对神经元存活至关重要。由于大脑无法储存氧,就需要持续供氧,来维持其重要的能量(即三磷酸腺苷)来源。确保大脑氧供(DO2)的两个基本要求是:充足的脑血流量(CBF)和适当的动脉氧含量(CaO2)。生理条件下,大脑氧利用率仅33%,但当任何决定DO2的因素受损时,大脑能增加氧利取率。细胞线粒体中氧的最终代谢,始于环境空气或由非有创性供氧技术或机械呼吸机提供的气体混合物。实现氧的最终代谢,就需要呼吸、心血管(包括微循环)和血液系统功能良好,所有这些都受到内稳态的调节。当DO2不足或线粒体无法使用提供的氧气时,就会“脑组织缺氧”(CTH),这构成了对原发性脑损伤的二次打击,并恶化临床结局,特别是在严重创伤性脑损伤患者中。DO2是CBF和CaO2的乘积,这提供了一个整体的氧供计算,但不能检测局部组织或微循环异常,这就限制了组织层面上的局部氧供(见图1A和B)。CTH在神经重症患者中很常见,大多数情况下是由基本生理参数的变化所致。CTH的病因多样(见表1),从病理生理学角度,可沿着氧运输途径研究和探讨(见图1A和B)。然而,监测创伤性脑损伤患者的脑氧合并非常规,有一定局限性,且证据支持并不充分。即使发达国家,监测组织氧压(PtiO2)的中心不超过19%。最近的一项研究表明,仅8.6%的中心常规监测PtiO2,1.3%使用颈静脉球静脉饱和度(SvjO2),1.7%使用近红外光谱(NIRS)。多方面因素决定脑氧合,个体的病理生理病因决定了个性化的临床方法。为以实用和简单的方式记住涉及氧运输和利用的生理变量,并帮助减少脑缺氧事件,我们创造了助记符“MANTLE”,作为一个有用的工具,对于严重创伤性脑损伤患者,它能提醒我们床边保护和优化脑氧合的因素(见图2)。

体温:“避免高热是根本”
高热在神经重症患者中非常普遍。脑损伤的初期,常因急性期反应(包括激活炎症和增加交感神经活动)升高体温。直接损伤下丘脑的体温调节中心也可能导致高热。大脑温度比身体其他部位要高,大脑和核心体温差可能高达2℃。入住ICU或在发病初期几小时内发热,将构成二次伤害,二次伤害与加重伤害的严重程度有关,对最终预后不利。通过多种机制(增加兴奋性氨基酸和自由氧的水平,抑制蛋白水解酶,破坏血脑屏障,以及增加易损区缺血面积),高热产生有害影响。由于代谢增加,高热还可能导致脑缺氧。因此,需保持核心体温在36至37℃间。
血红蛋白(Hgb):“保持和维持良好运输体的质量和数量至关重要”
血红蛋白转运的氧超过血液中总氧量的95%。生理上,血红蛋白水平只要降低1 gr/dl就会降低氧供(贫血性缺氧),而当Hgb值较高(>12 gr/dl)时,增加血红蛋白水平不会增加氧供。由于存在多个变量(包括输血量和献血者年龄),输血不能确保纠正脑缺氧。血红蛋白的最佳水平仍然未知,然而,达到并维持血红蛋白值在7-9 gr/dl似乎是合理的。长期库血血中2,3二磷酸甘油酸下降,这进一步增加了血红蛋白对氧的亲和力,限制了向细胞释放氧。
电解质和酸碱状况:“生理平衡是基石”
氧向细胞运输和释放的生理过程中,细胞外环境的稳态是关键。这在避免血红蛋白解离曲线偏移中至关重要。通过右移血红蛋白氧解离曲线,体温升高和二氧化碳增加以及细胞代谢产生的组织酸中毒,均促进氧向组织释放。另一方面,低温、低碳酸血症和碱中毒增加血红蛋白对氧的亲和力(左移血红蛋白氧解离曲线),这限制了血红蛋白向细胞释放必要的氧。酸中毒、高碳酸血症和高热会扩张脑阻力血管,增加脑血容量和颅内压,而低碳酸血症通过引起血管收缩,促进脑缺血。为确保血红蛋白氧解离曲线始终在功能范围内(p50= 26–28 mmHg),以降低脑缺血和颅内高压的风险,应实现以下目标:a)pH值:7.35–7.45、b)血碳酸正常、c)中心体温(T°):36–37.5°C。另一方面,为最小化或治疗脑水肿,保持轻微的高渗透状态(血清Na+ 140—150 mEq/L)和避免输注低渗液体至关重要。
新陈代谢:“如果新陈代谢加速,需氧量就会增加”
脑代谢是决定脑氧耗的主要因素。某些缺氧情况下,氧需超过氧供。因此,应评估并迅速纠正所有增加神经元氧需求的情况,如镇静和镇痛不足(疼痛、躁动)、惊厥、发热、脓毒症和阵发性交感神经亢进综合征。根据可用资源和所采用的技术,决定要实现的脑氧合目标。脑组织的局部氧压反映了氧供和氧耗间的平衡,并应维持>18 mmHg。从颈静脉球获得的静脉氧饱和度(SvjO2),总体上代表了被脑细胞消耗后返回全身循环的氧饱和度,应维持在>55%。无论局部脑氧分压还是SvjO2,都依赖于充足的脑血流量(CBF),而CBF又需要适当的脑灌注压(CPP)。当有先进的专业技术(如微透析或用于连续评估自动调节现象的特定软件)时,建议维持乳酸/丙酮酸比<25和压力反应性指数(Prx)或氧反应性指数(Orx)<0.2。Orx衡量CPP和PtiO2间的关系,Prx衡量CPP和ICP间的关系。这两个参数都与脑氧合相关,因为高颅内压(ICP)降低了低氧耐受性。
动脉血压:“动脉低血压是大脑损伤的先兆”
脑血流量(CBF)的主要决定因素之一是脑灌注压(CPP),它是平均动脉血压(MABP)减去颅内压(ICP)的值,并且依赖于脑小血管(直径50–150微米)的直径。这些参数相互作用,产生脑血流自动调节曲线,这是血管阻力的一种内在现象,通过改变它们的直径,能维持恒定的CBF。但这种自动调节也是有限的,当自动调节受损时,被动地跟随CPP,CBF可能会超出或低于限制。多年来,人们一直认为CPP在50至150 mmHg的范围内波动时,CBF不会变化。但最近的生理学研究质疑了该论断,表明脑损伤患者的脑自动调节现象更加“被动”,自动调节曲线的“平台”阶段明显更窄。某些生理情况下(如运动时),当血压(BP)突然变化时,脑血流量(CBF)可能会变化,甚至可能变得依赖于血压。对于维持适当的脑灌注和氧合,脑血流自动调节(CAR)至关重要。PtiO2是替代CBF的一个指标。通过经颅多普勒或通过有创监测MABP,或使用特定软件(建立脑组织氧合和CPP间的相关性),可轻松监测CAR。通过观察CPP和PtiO2间的变化,Orx可评估CAR。Orx值可在-1到+1间变化。当PtiO2被动地随CPP变化时,自动调节就会受到损害,因此两者为正相关。当自动调节完好时,PtiO2不会受CPP变化的影响,因此两个参数间存在负相关,以及Orx值为负。反过来,MABP依赖于不同的血流动力学变量,如全身血管阻力和心输出量。创伤性脑损伤中,动脉低血压是对最终结局不良影响最大的因素之一,可能导致缺血性缺氧,因此必须紧急预防和纠正。
营养和葡萄糖:“葡萄糖,受损大脑的基本燃料”
对于维持线粒体功能,葡萄糖是一种必需的营养物质和能量底物。受损大脑对葡萄糖的亲和力增加,由于大脑不储存葡萄糖,无葡萄糖供应时,不超过2分钟就能快速耗尽稀缺的脑葡萄糖储备。大脑的葡萄糖供应不足是代谢受损的主要原因。血糖值<110 mg/dl可能会导致非缺血性代谢危象。相反,高血糖>180 mg/dl会引起神经毒性级联反应(炎症、微血栓、水肿)并扰乱内环境的稳态(高渗透压、脱水),损害免疫状态,以及其他变化。此外,神经性低血糖症可能导致线粒体功能障碍(缺氧性氧化磷酸化解偶联)。
氧合目标:“全身氧合的两个极端都是有害的”
全身氧合多依赖于肺功能,决定气体交换量,尤其是通气/血流比及其极端情况(无效腔和分流)必须在生理限度内。增加无效腔降低肺泡通气量,从而引起CO2潴留和低氧血症。另一方面,分流增加导致低氧血症,因为混合静脉血会灌注到较大的非通气区域,降低动脉血含O2量。这种类型的低氧血症性缺氧的标志物是降低动脉血氧分压(PaO2)和动脉血氧饱和度(SaO2),记住PaO2代表溶解的O2,仅占总氧转运能力的3-4%。
这种情况下,一种常见且合理的实践是增加吸氧浓度(FiO2);然而,如果没有全面分析该情况,这一措施并不能解决根本问题,因为即使在PaO2的超常水平(常压高氧血症)下,仍可能有隐匿性的脑缺氧;另一方面,最近的证据表明,实际上高氧血症也可能有害。
如果损害了这些变量,就必须采取措施使PaO2达到80-120毫米汞柱,且SaO2超过95%。
肺保护性通气:“保护肺就是保护大脑”
肺保护性通气的概念在脑损伤患者中受到质疑。事实上,(保持低平台压和驱动压的)低潮气量结合(呼气末正压诱导的)高胸内压和静脉回流减少可能易增加二氧化碳值。因这些原因,过去评估普通ICU人群肺保护策略的重大研究都排除脑损伤患者,故对脑损伤患者是否适合肺保护性通气缺乏有力证据。
然而,过去几年中,即使脑损伤患者中,肺保护性通气的概念也越来越受到关注,因为它可以减少肺部并发症,因此与改善预后相关。
优化机械通气策略意味着优化肺功能和全身及脑的氧合,但同时也降低血管收缩继发的缺血性缺氧(低碳酸血症)和(高碳酸血症引起的)血管舒张所致颅高压的风险。
根据现有证据,似乎明智的做法是以控制模式开始肺保护性通气,潮气量在6至8毫升/公斤之间,确保PaCO2在35至45毫米汞柱间的最低呼吸频率,以及我们上面提到的为达到全身性氧合目标所必需的FiO2和PEEP。为防止机械通气引起的肺损伤(气压伤、生物伤、容积伤),应保持平台压<20厘米水柱,驱动压<13厘米水柱,并且机械功率低于17焦耳/分钟。建议不要常规过度通气,并维持PaCO2在35至45毫米汞柱之间。较低的目标可以作为控制颅内高压的策略。威胁生命的情况下,如脑疝综合征、A型平台波或继发于充血的颅内高压,可适度和控制性地过度通气。
水肿和颅内压控制:脑部肿胀,大脑处于边缘状态
脑水肿致脑组织缺氧的机制有两种。一方面,通过增加颅内压(ICP),脑水肿减少脑灌注压(CPP),引起缺血性低氧血症;另一方面,通过减少氧向细胞的弥散,脑水肿促进低氧血症,见图2。达到适当的钠水平对最大程度减少脑水肿至关重要。同样,推荐应用既定的颅内高压管理方案来治疗颅内高压。应实现的主要目标如下:a)ICP<22毫米汞柱、b)CPP: 55–70毫米汞柱、c)视神经鞘直径(ONSD)<5.8毫米、d)脉博指数(PI)<1.2、以及e)脑部CT扫描无水肿迹象
结论
颅内高热性缺氧在重度颅脑损伤中并不罕见,可独立预示不良预后。了解氧的生理学和动力学,以及低氧的各种病因,结合临床推理和个性化治疗,即使未使用先进和特定的神经监测设备的情况下,也有助于最大限度地减少颅内高热性缺氧的发病率及其直接且危险的后果。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#颅脑损伤# #脑缺氧#
27