新一代强效ROS1抑制剂泰莱替尼(AB-106)获优先审评资格!cORR高达92.5%
2023-12-23 全球好药资讯 全球好药资讯 发表于威斯康星
泰莱替尼的NDA获受理和纳入优先审评是基于一项II期TRUST-I临床研究 (NCT04395677)的数据。该试验旨在评估泰莱替尼在中国ROS1阳性非小细胞癌患者中的的安全性、耐受性和疗效。
2023年12月19日,信达生物与葆元医药共同宣布,新一代ROS1酪氨酸激酶抑制剂(TKI)泰莱替尼(他雷替尼)的新药上市申请(NDA)获得国家药品监督管理局(NMPA)药品审评中心(CDE)授予优先审评资格,用于经ROS1-TKI治疗失败的ROS1阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
此前,2023年11月23日,泰莱替尼的新药上市申请(NDA)已获国家药品监督管理局(NMPA)药品审评中心(CDE)受理,用于治疗经ROS1-TKI治疗失败的ROS1阳性局部晚期或转移性NSCLC成人患者。
泰莱替尼是一款口服、强效、脑渗透、选择性、新一代的ROS1抑制剂。此前,2022年3月1日,国家药监局药品评审中心将泰莱替尼纳入突破性治疗药物品种名单,用于治疗ROS1-TKI初治和既往接受ROS1-TKI治疗的ROS1融合阳性非小细胞肺癌患者。同年8月,美FDA授予泰莱替尼突破性疗法指定,用于ROS1阳性非小细胞肺癌患者。
通用名:Taletrectinib(他雷替尼、泰莱替尼)
代号:DS6051b/AB-106
靶点:ROS1/NTRK
厂家:葆元医药、信达生物

Taletrectinib分子结构
临床数据
泰莱替尼的NDA获受理和纳入优先审评是基于一项II期TRUST-I临床研究 (NCT04395677)的数据。该试验旨在评估泰莱替尼在中国ROS1阳性非小细胞癌患者中的的安全性、耐受性和疗效。
试验的主要终点是客观缓解率(ORR);关键次要终点包括反应持续时间(DOR)、疾病控制率(DCR)、颅内ORR(IC-ORR)、无进展生存期(PFS)和总生存期(OS)。
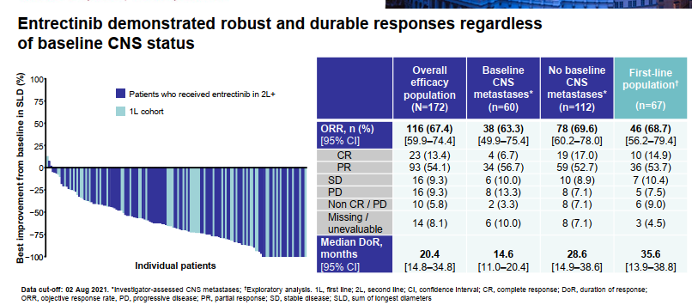
研究结果显示,在TKI初治的可评估患者(n=67)中,根据独立审查委员会(IRC)评估的确认总客观缓解率(cORR)为92.5%;疾病控制率(DCR)为95.5%。此外,中位DOR和中位PFS尚未达到(NR)。
在先前接受过TKI治疗(克唑替尼)的可评估患者(n=38)中,ORR为52.6%;DCR为81.6%;中位PFS为9.8个月。值得一提的是,在ROS1耐药突变G2032R的患者中,ORR为80%(4/5)。

此外,在12例可测量的脑转移患者中,颅内ORR为91.7%,所有患者(100%)均实现了颅内疾病控制。
在安全性方面,泰莱替尼是可耐受的,并且与神经系统不良反应(AE)的发生率低相关。治疗中出现的AE(TEAE)大多为低级别,因TEAE而中断治疗和减少剂量的情况并不多见。
小结
信达生物制药集团高级副总裁周辉博士表示:“纳入优先审评程序进一步显示了泰莱替尼作为新一代精准疗法的同类最佳潜力。我们将继续配合监管机构对泰莱替尼的审评,期待能早日让此创新疗法满足更多ROS1阳性中国非小细胞肺癌患者的需求。”
葆元医药首席医学官颜冰博士表示:“泰莱替尼获得优先审评资格凸显了国内既往接受过ROS1-TKI治疗的 ROS1阳性非小细胞肺癌患者的迫切需求,以及泰莱替尼为患者带来显著临床获益的潜力。我们非常期待配合中国监管机构对泰莱替尼的审查,争取尽早将这项突破性疗法尽快提供给患者。”
参考来源:
http://cn.innoventbio.com
https://www.prnasia.com
https://www.anhearttherapeutics.com
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#ROS1# #ROS1阳性肺癌# #信达生物# #泰莱替尼# #葆元医药#
104