FDA和EMA批准OPT-302治疗湿性AMD的III期临床试验
2020-08-23 Allan MedSci原创
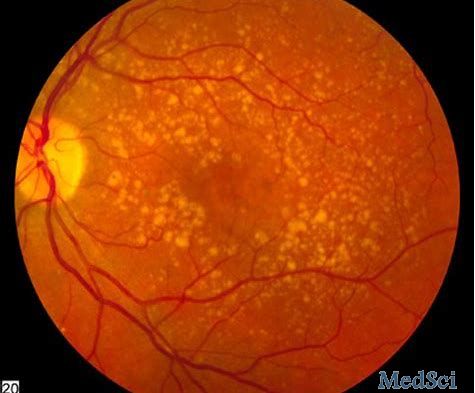
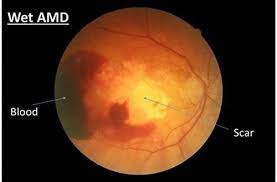
会议的结果支持进行OPT-302治疗新生血管性(湿性)老年黄斑变性(湿性AMD)的III期临床开发。
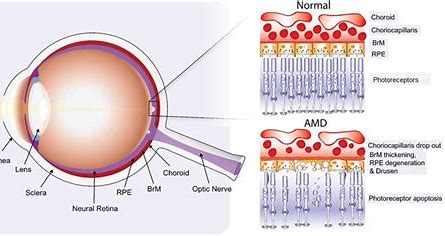
在2010年全球有两千三百万的人有老年性黄斑部病变。在2013年,中度到重度的病患有一千三百四十万人,且这是在继白内障、早产及青光眼后造成失明的第四常见的主要因素。超过五十岁的人较容易出现老年性黄斑部病变,在美国,老年性黄斑部病变为造成此年龄族群失去视力的主要因素。年龄50到60岁的人,约有0.4%有此疾病。
生物制药公司Opthea致力于开发治疗进行性视网膜疾病的新型疗法,Opthea近日宣布,已完成与美国FDA及欧洲药品管理局(EMA)的科学建议会议,会议的结果支持进行OPT-302治疗新生血管性(湿性)老年黄斑变性(湿性AMD)的III期临床开发。该公司有望在2021年初启动III期试验。
FDA和EMA在III期临床试验设计的关键方面达成了一致,包括两项同时进行的、全球性、多中心、随机对照研究,以评估OPT-302与雷珠单抗的组合(OPT-302-1004研究,称为ShORe)或与aflibercept(Eylea)的组合(OPT-302-1005研究,称为COAST)。如果试验获得成功,OPT-302有望与Eylea或雷珠单抗一起使用。每项试验将比较与VEGF-A抑制剂联合使用的OPT-302的临床疗效,以便了解OPT-302治疗效果的持久性。
在OPT-302联合雷珠单抗(ShORe)的研究中,未接受过治疗的湿性AMD患者将被随机分配到三个治疗组。在COAST中,将OPT-302与Aflibercept联合使用,未接受过治疗的湿性AMD患者将被随机分配到三个治疗组。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#III#
0
#I期临床试验#
69
#II期临床试验#
68
#I期临床#
79
#AMD#
81
#EMA#
99
#II期临床#
65
#III期临床试验#
0
#III期#
80