细胞药物系列丨间充质干细胞疗法在美申请上市:Remestemcell-l
2023-03-22 干细胞者说 网络 发表于四川省
2023年3月8日,国际干细胞领军企业Mesoblast公司宣布,美国FDA已接受其同种异基因干细胞药物Remestemcel-L的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(
2023年3月8日,国际干细胞领军企业Mesoblast公司宣布,美国FDA已接受其同种异基因干细胞药物Remestemcel-L的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者。
FDA认为重新提交是一个完整的回应,并将处方药用户收费法案(PDUFA)的目标日期定为2023年8月2日
。如果获得批准,Remestemcell-l将成为美国首个异基因“现货型”细胞药物,也是首个针对12岁以下SR-aGVHD儿童的治疗药物。
-01- 重新递交的新增数据
在过去的20年里,最严重的SR-aGVHD患者生存结果并没有得到改善,这是同种异基因骨髓移植治疗血液癌和其他疾病后的一种危及生命的并发症。缺乏任何批准的12岁以下儿童的治疗方法,这意味着迫切需要一种疗法来改善惨淡的生存结果。如果Remestemcell-l获得FDA批准,将是美国批准的第一个异基因“现成”细胞药物,也是第一个针对12岁以下儿童的SR-aGVHD治疗。
此次重新递交的BLA材料,包含的新增数据包括:
(1)针对高危疾病儿童的匹配研究,对25位在临床试验Phase3阶段中接受治疗的儿童和27位接受不同治疗的儿童进行比较。研究显示:接受remestemcel-L治疗的高危儿童中,在接受治疗28天内,67%的儿童产生积极应答,并且在180天后仍然活着,而对照组中只有10%。
(2)临床试验Phase3阶段中,51位儿童患者的4年生存数据。结果显示:干细胞疗法效果的持久性,患者的1年生存率为63%,2年生存率为51%。此前,这些患者的2年预期生存率为25-38%。
-02-几经波折的干细胞候选药物
Remestemcel-L是一款骨髓来源的同种异基因间充质干细胞疗法,通过静脉输注给药。Remestemcel-L具有免疫调节作用,通过下调促炎细胞因子的产生、增加抗炎细胞因子的产生、并能将自然产生的抗炎细胞招募到相关组织中,来对抗与多种疾病相关的炎症过程。
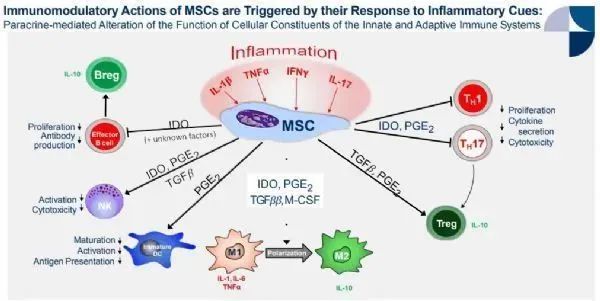
间充质干细胞的抗炎和免疫调节机制
事实上,Remestemcel-L已经是获批上市的干细胞治疗产品,也就是世界上第一个治疗急性移植物抗宿主病
(aGVHD)的间充质干细胞产品Temcell。Temcell以前也被称作Prochymal,已在加拿大(2012年)和新西兰(2012年)获得批准。尽管Prochymal在III期临床中的研究数据不是很积极的,但是考虑到部分患者中的有效数据,加拿大还是批准了Prochymal产品的上市。或许是同样的理由,2016年Temcell在日本获得完全批准,由JCR制药公司在日本销售,用于治疗儿童和成人的aGVHD。
可能因为先天不足,Remestemcel-L在美国的上市之路颇为曲折。2020年1月,Mesoblast递交上市申请。2020年08月,Remestemcel-L虽然获得9:1的压倒性支持。然而,FDA拒绝批准,给出的理由是试验数据来自单臂试验而不是随机试验,建议至少在成人和/或儿童中进行一项随机对照试验,用以提关于治疗机制和疗效的补充信息。此次递交的试验数据终于得到了FDA认可,FDA认为此次重新提交的数据是一个完整的数据,并将PDUFA日期定为2023年8月2日。
-03-三项重要临床试验数据
据悉,在2020年递交BLA材料申请上市时,Remestemcel-L已经进行了10多年的临床研究,主要包括三项研究。
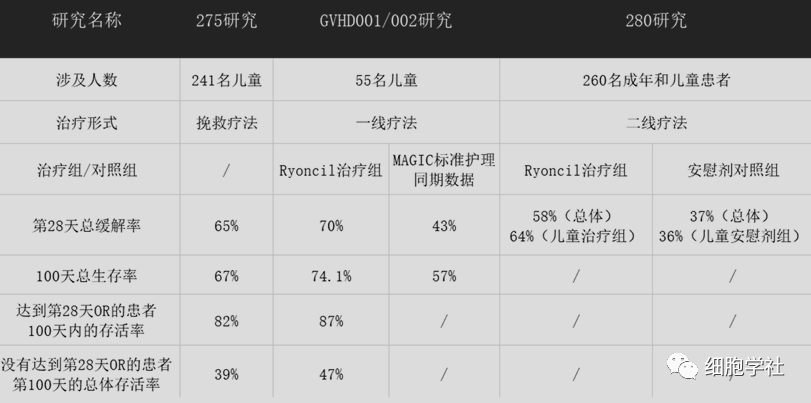
(1)275研究,涉及241名儿童的3期临床试验。主要终点是:第28天的总缓解率达到65%,100天的总体存活率为67%。其中,没有达到第28天OR的患者第100天的总体存活率为39%,达到第28天OR的患者100天内的存活率,达到82%。
(2)GVHD001/002研究,涉及55名儿童的3期临床单臂试验。主要终点是:第28天总缓解率达到70%,100天的总体存活率为74.1%。
(3)280研究,涉及260名患者(包括28名儿童)的3期随机安慰对照临床试验。在疾病程度最严重的儿童和成年患者中,干细胞治疗组第28天总缓解率达到58%,对照组为37%。在儿童患者亚组中,干细胞治疗组第28天总缓解率明显更高,达到64%,而安慰剂组为36%。
-04-Mesoblast产品研发管线

Mesoblast产品研发管线
Mesoblast 公司是一家澳大利亚墨尔本的生物技术公司,是同种异基因(现货通用型)干细胞疗法的全球领导者,致力于开发用于炎症疾病的细胞治疗产品。
Mesoblast公司的细胞产品在多个适应症上都有布局,可以分为Remestemcel-L和Rexlemestrocel两大类。Remestemcel-L(基于全身炎症)的适应症主要是移植物抗宿主病和急性呼吸窘迫症;Rexlemestrocel(基于局部炎症)的适应症主要是慢性心衰和慢性腰痛。
参考资料:
[1]https://www.biospace.com/article/releases/fda-accepts-mesoblast-s-resubmission-of-the-biologic-license-application-for-remestemcel-l-in-children-with-steroid-refractory-acute-graft-versus-host-disease-as-a-complete-response-and-sets-goal-date-of-august-2-2023/
[2]关山难越:干细胞三期临床试验成功的关键要素是什么?步步先生 干细胞者说.2019-10-14
[3]临床级间充质干细胞的技术壁垒:国际纵览 步步先生 干细胞者说 2022-05-06
[4]Mesoblast Submits Completed Biologics License Application for Ryoncil:trade_mark: to US FDA
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







