【论著】| 帕博利珠单抗联合XELOX方案治疗晚期胃癌的回顾性研究
刚刚 中国癌症杂志 中国癌症杂志 发表于陕西省
本研究初步尝试探究帕博利珠单抗联合XELOX方案对改善晚期胃癌免疫抑制状态的效果,以期改善晚期胃癌的疗效,提高患者的生活质量。
[摘要] 背景与目的:尽管目前针对胃癌的治疗手段已取得了显著进步,但晚期胃癌患者仍存在预后差、5年生存率偏低等问题,因此探究有效的治疗方案仍是临床研究的重点。帕博利珠单抗作为新型免疫检查点抑制剂,其临床应用效果及安全性仍需大量研究予以验证,因此本研究回顾性分析帕博利珠单抗联合XELOX方案治疗晚期胃癌的效果,以期为临床治疗提供参考。方法:回顾性收集2020年3月—2022年8月山西省肿瘤医院收治的晚期胃癌患者的临床资料。纳入标准:经临床组织病理学检查确诊为HER2阴性、未经治疗的晚期胃癌/食管胃结合部腺癌患者,符合相关诊断标准;TNM分期为Ⅳ期;年龄≥20岁;预计生存期≥6个月;治疗前器官无严重损伤者;Karnofsky评分>60分;临床资料完整者。排除标准:合并重要器官功能障碍者;合并甲状腺功能减退或亢进者;合并血液、凝血功能异常者;合并自身免疫性疾病者;哺乳、妊娠期女性;存在精神类疾病或诊断史者;伴有其他恶性肿瘤者;存在严重肝肾功能障碍者;临床资料不全者。通过纳入和排除标准选择91例晚期胃癌患者,其中45例接受XELOX方案治疗(对照组),46例接受帕博利珠单抗联合XELOX方案治疗(观察组),建立数据库后发现观察组1例患者的治疗信息存在逻辑错误,因此去除该病例,最终确定研究对象90例,对照组和观察组各45例。对比两组疗效、中位总生存期(overall survival,OS)、中位无进展生存期(progression-free survival,PFS)、不良反应、生活质量改善情况,以及治疗前后癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、大肠杆菌、双歧杆菌、乳杆菌水平。本研究已获得山西省肿瘤医院伦理委员会批准(伦理编号:KY2023081)。结果:治疗后观察组疾病进展(progressive disease,PD)占20.0%(9/45),低于对照组的40.0%(18/45),但两组的疾病稳定(stable disease,SD)、完全缓解(complete response,CR)和部分缓解(partial response,PR)占比差异无统计学意义(P>0.05)。治疗后观察组的生活质量改善率为60.0%(27/45),高于对照组的37.8%(17/45)(P<0.05)。观察组的中位OS和中位PFS均大于对照组(P<0.05)。治疗后观察组的外周血CEA、 CA19-9均低于对照组(P<0.05)。治疗后观察组的大肠杆菌数量低于对照组,双歧杆菌、乳杆菌数量均高于对照组(P<0.05)。两组不同等级恶心呕吐、腹泻、白细胞减少、皮疹及肝功能损害的发生率差异无统计学意义(P>0.05)。结论:帕博利珠单抗联合XELOX方案可调节肿瘤标志物在晚期胃癌患者中的水平,预防疾病进展,改善患者生活质量,还有助于维持肠道微生态平衡。
[关键词] 帕博利珠单抗;XELOX方案;化疗;晚期胃癌;免疫抑制
[Abstract] Background and purpose: Despite the significant advancements that have been made in the treatment of gastric cancer, there are still problems such as poor prognosis and low five-year survival rate in advanced gastric cancer. Therefore, exploring effective treatment options remains a key focus of clinical research. As a new type of immune checkpoint inhibitor, the clinical efficacy and safety of pembrolizumab still need to be confirmed by extensive research. Therefore, this study conducted regression analysis of the effect of pembrolizumab combined with XELOX regimen in the treatment of advanced gastric cancer, providing a reference for clinical treatment. Methods: Clinical data of patients with advanced gastric cancer who were admitted to Shanxi Province Cancer Hospital from March 2020 to August 2022 were retrospectively collected. Inclusion criteria: patients with HER2-negative, untreated advanced gastric cancer or adenocarcinoma of the esophagogastric junction, confirmed by clinical histopathological examination and meeting relevant diagnostic criteria; TNM stage Ⅳ; age ≥20 years; expected survival ≥6 months; no severe organ damage before treatment; Karnofsky score >60; patients with complete clinical data. Exclusion criteria: patients with concurrent major organ dysfunction; hypothyroidism or hyperthyroidism; blood or coagulation disorders; autoimmune diseases; lactating or pregnant women; individuals with mental illnesses or a history of mental illness; those with concurrent other malignancies; those with severe liver or kidney dysfunction; patients with incomplete clinical data. Based on the inclusion and exclusion criteria, 91 patients with advanced gastric cancer were selected. Among them, 45 received XELOX regimen treatment (control group), and 46 received pembrolizumab combined with XELOX regimen treatment (observation group). After establishing the database, one patient in the observation group was found to have logical errors in their treatment information and was therefore excluded. Ultimately, 90 patients were included in the study, with 45 in each of the control and observation groups. The efficacy, median overall survival (OS), median progression-free survival (PFS), toxic side effects, improvement in quality of life, and levels of carcinoembryonic antigen (CEA), carbohydrate antigen 19-9 (CA19-9), Escherichia coli, Bifidobacterium and Lactobacillus before and after treatment were compared between the two groups. This study was approved by the ethics committee of Shanxi Province Cancer Hospital (ethics number: KY2023081). Results: After treatment, the proportion of progressive disease (PD) in the observation group was 20.0% (9/45), which was lower than that in the control group (40.0%, 18/45). However, there was no significant difference between the two groups in proportion of stable disease (SD), complete response (CR) and partial response (PR) (P>0.05). The improvement rate of quality of life in the observation group after treatment was 60.0% (27/45), which was higher than that in the control group, with a rate of 37.8% (17/45) (P<0.05). The median OS and PFS in the observation group were longer compared with the control group (P<0.05). After treatment, the levels of CEA and CA19-9 in peripheral blood of the observation group were lower compared with the control group (P<0.05). After treatment, the number of Escherichia coli was lower in the observation group than in the control group, while the numbers of Bifidobacterium and Lactobacillus were higher (P<0.05). There was no significant difference in the incidence of nausea and vomiting, diarrhea, leukopenia, rash, liver function damage between the two groups (P>0.05). Conclusion: The combination of pembrolizumab and XELOX regimen can regulate the expression levels of tumor markers in patients with advanced gastric cancer, prevent disease progression, improve patient quality of life, and help maintain intestinal microecology balance.
[Key words] Pembrolizumab; XELOX regimen; Chemotherapy; Advanced gastric cancer; Immunosuppression
胃癌致死率极高,是全球第5大常见癌症,也是第4大癌症死亡原因,全球每年新发胃癌病例达100万例[1]。因胃癌早期缺乏特异性症状,临床就诊患者以进展期居多,胃癌根治术已无法彻底清除体内癌细胞,需接受化疗干预以延长生存期[2]。但胃癌患者本身存在体液及细胞免疫调节障碍,化疗会进一步影响机体免疫。有研究[3-4]证实,胃癌的发生、发展及远处转移等过程是多种原因综合作用的结果,尤其化疗患者免疫降低会加速肿瘤细胞增殖、生长,通过免疫治疗维持机体正常免疫功能,对遏制肿瘤细胞具有积极作用。帕博利珠单抗是一种针对程序性死亡蛋白-1(programmed death-1,PD-1)的免疫检查点抑制剂,可应用于程序性死亡蛋白配体-1 (programmed death ligand-1,PD-L1)阳性肿瘤的治疗中[5]。本研究初步尝试探究帕博利珠单抗联合XELOX方案对改善晚期胃癌免疫抑制状态的效果,以期改善晚期胃癌的疗效,提高患者的生活质量。
1 资料和方法
1.1 一般材料
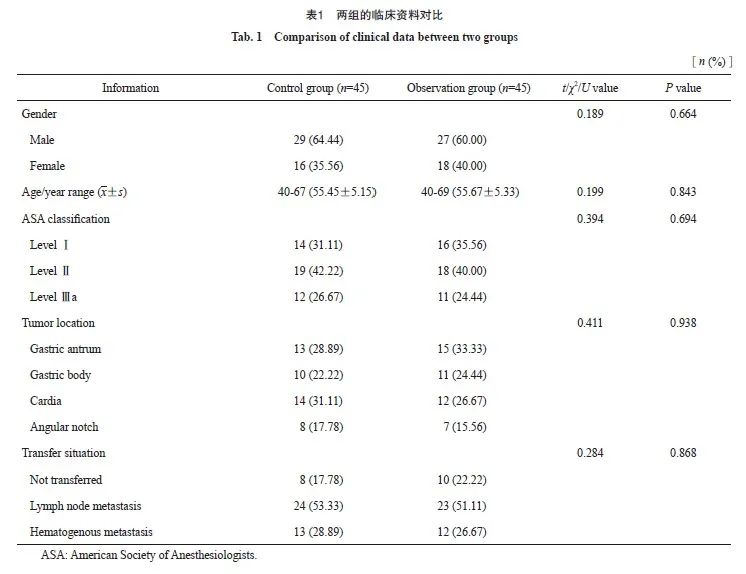
回顾性收集2020年3月—2022年8月山西省肿瘤医院收治的晚期胃癌患者的临床资料。纳入标准:经临床组织病理学检查确诊HER2阴性、未经治疗的晚期胃癌/食管胃结合部腺癌患者,符合相关诊断标准[6];TNM分期为Ⅳ期;年龄≥20岁;预计生存期≥6个月;治疗前器官无严重损伤者;Karnofsky评分[7]>60分;临床资料完整者。排除标准:合并重要器官功能障碍者;合并甲状腺功能减退或亢进者;合并血液、血液凝固功能异常者;合并自身免疫性疾病者;哺乳、妊娠期女性;存在精神类疾病或诊断史者;伴有其他恶性肿瘤者;存在严重肝肾功能障碍者;临床资料不全者。通过纳入和排除标准选择91例晚期胃癌患者,其中45例接受XELOX方案治疗(对照组),46例接受帕博利珠单抗联合XELOX方案治疗(观察组),建立数据库后发现观察组1例患者治疗信息存在逻辑错误,因此去除该病例,最终确定研究对象90例,对照组和观察组各45例。两组一般资料对比差异无统计学意义(P>0.05,表1)。本研究已获得山西省肿瘤医院伦理委员会批准(伦理编号:KY2023081)。
1.2 方法
1.2.1 对照组
给予XELOX方案,静脉滴注奥沙利铂(远大医药黄石飞云制药有限公司,批号:H20103129,规格:100 mg),时间3 h,剂量:130 mg/m2,第1天;口服卡培他滨(上海罗氏制药有限公司,批号:H20073024,规格:0.5 g),第1~14天,2次/d,每次给药剂量:1 000 mg/m2;14 d后停药7 d,为1个周期,治疗4个周期(12周)。
1.2.2 观察组
在对照组的基础上,联合帕博利珠单抗[MSD Ireland(Carlow),批号:S20180019,规格:100 mg/4 mL]治疗,静脉滴注200 mg,每3周1次,治疗过程中关注患者的临床表现,若疾病进展(progressive disease,PD)或出现难以忍受的不良反应则停止用药。3周为1个周期,治疗4个周期(12周)。
1.3 观察指标
1.3.1 疗效
参照文献[8]确定疗效的评估标准,部分缓解(partial response,PR):靶病灶直径之和比基线水平减少≥30%;完全缓解(complete Response,CR):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm;PD:以整个试验过程中所有测量的靶病灶直径之和的最小值为参照,直径之和相对增加至少20%(如果基线测量值最小就以基线值为参照),除此之外,必须满足直径之和的绝对值增加至少5 mm(出现一个或多个新病灶也视为PD);疾病稳定(stable disease,SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考。
1.3.2 生化指标
治疗前后于患者清晨空腹状态下以肝素抗凝管采集静脉血3 mL,离心10 min(离心半径10 cm,离心速率3 000 r/min),分离血清,采用瑞士Roche公司MODULARE170型全自动生化分析仪通过化学发光免疫法检测糖类抗原19-9 (carbohydrate antigen 19-9,CA19-9)和癌胚抗原(carcinoembryonic antigen,CEA)水平。
1.3.3 肠道菌群
治疗前后,采集0.5 g新鲜粪便,采用无菌生理盐水稀释至10-6菌液,取100 µL菌液,涂布于培养基表面,乳杆菌、双歧杆菌选择BS琼脂平板(厌氧条件),大肠杆菌选择中国兰琼脂平板(需氧条件),培养24~72 h,计算菌落数。试验过程严格无菌操作,培养结束后从菌落中提取DNA,选择目标细菌特异性引物进行聚合酶链反应(polymerase chain reaction,PCR)扩增,确定目标细菌的存在。
1.3.4 生活质量改善情况
治疗前后采用Karnofsky评分评估患者生活状态,量表总分100分,分为11个等级,0分表示死亡,100分表示正常,每10分为1个等级,依据Karnofsky评分评估患者治疗后的生活状态,分为3个等级,改善:治疗后Karnofsky评分提高分 值>10分;稳定:Karnofsky评分增加或降低10分及以内;进展:Karnofsky评分下降>10分。
1.3.5 不良反应
记录两组治疗过程中的不良反应,参照抗肿瘤药物不良反应评价标准[9]将恶心呕吐、白细胞减少、皮疹、腹泻及肝功能损害等不良反应由轻到重分为Ⅰ、Ⅱ、Ⅲ和Ⅳ级。
1.3.6 总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)
通过定期住院治疗、门诊随访和电话随访,随访终点事件为患者出现PD或死亡或至最终观察日期2024年5月30日。OS是指从研究开始至任何原因引起死亡的总时间,是临床上用以评估抗肿瘤药物疗效的重要指标,若到最终观察日期患者未死亡,则将研究开始至最终观察日期的总时间记为OS。PFS是指从研究开始至PD的总时间,也是评估患者生存情况及抗肿瘤疗效的重要指标,若至最终观察日期未出现PD,则将研究开始至最终观察日期的总时间记为PFS。
1.4 统计学处理
采用SPSS 22.0软件对数据进行分析。对计量资料进行正态性检验,符合正态分布以x±s表示,多组间比较采用单因素方差分析,两两比较采用最小显著差异t检验,计数资料以n(%)表示,采用χ2检验,当总例数<40例或理论频数T≤1,采用确切概率法精确检验,对等级资料进行Wilcoxon秩和检验,对OS、PFS采用Log-rank检验,比较两组的生存情况。P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤标志物水平
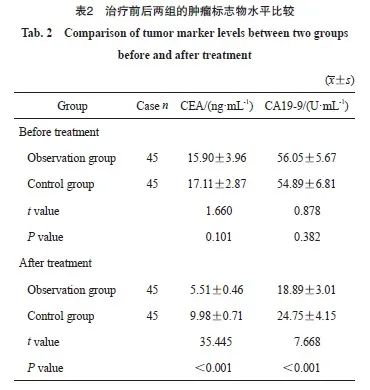
治疗前两组的肿瘤标志物水平差异无统计学意义(P>0.05),治疗后观察组外周血中的CA19-9、miR-135、CEA及miR-93水平均低于对照组(P<0.05,表2)。
2.2 肠道菌群数量
治疗前观察组和对照组的双歧杆菌和乳杆菌数量低于健康人群,大肠杆菌数量高于健康人群(P<0.05),治疗前观察组和对照组的肠道菌群差异无统计学意义(P>0.05),治疗后与对照组相比,观察组的双歧杆菌和乳杆菌数量较高,大肠杆菌数量较低(P<0.05,表3)。

2.3 生活质量改善率
治疗后观察组的生活质量改善率显著高于对照组,差异有统计学意义(P<0.05,表4)。

2.4 不良反应
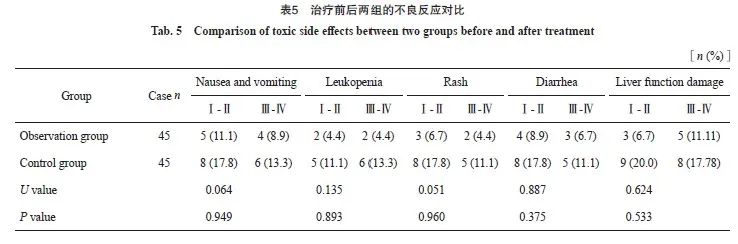
两组的恶心呕吐、皮疹、白细胞减少、腹泻及肝功能损害发生率差异无统计学意义(P >0.05,表5)。
2.5 疗效、中位OS和中位PFS
观察组的PD患者数显著低于对照组(P <0.05,表6)。至随访结束,观察组和对照组的中位OS分别为14.51和13.33个月,中位PFS分别为12.20和10.21个月,两组间比较差异均有统计学意义(χ2=7.159和20.156,P<0.05)。

3 讨 论
晚期胃癌患者的临床治疗以化疗为主,但随着耐药性及不良反应增加,疗效逐渐降低,严重影响患者的生活质量。随着临床研究的不断深入,免疫治疗为晚期胃癌的诊疗提供了新方向,帕博利珠单抗、贝伐珠单抗、阿特珠单抗及纳武单抗等PD-1抑制剂已成为辅助治疗的主要方式之一[10]。
在Shitara等[11]开展的一项随机、开放标签、对照Ⅲ期临床试验中,将PD-1抑制剂应用于接受一线化疗(铂类药物和氟尿嘧啶类药物)后的综合阳性评分≥1的晚期胃癌患者中,发现PD-1抑制剂在提高患者OS率方面与二线紫杉醇治疗方案相比,未表现出明显优势,但其具备更高的安全性。但王俊松等[12]研究显示,增加帕博利珠单抗治疗胃癌进展期患者,可将患者的客观缓解率从67.5%提升至90.1%。本研究在化疗基础上,联合帕博利珠单抗治疗,结果显示,观察组的PD率为20.0%,与李璐璐等[13]研究统计的数据(22.2%)相近,且均低于对照组,中位OS和中位PFS均高于对照组(P<0.05),提示帕博利珠单抗联合化疗方案可有效地控制晚期胃癌患者的PD,效果优于单纯化疗。本研究同时对肿瘤标志物进行检测,CEA和CA19-9主要由消化系统及其他组织的肿瘤细胞合成分泌,常用于监测癌症的发生及复发[14]。本研究中,治疗后观察组的CEA和CA19-9水平均低于对照组,生活质量改善率均高于对照组(P<0.05),提示联合帕博利珠单抗可下调肿瘤标志物水平,促进患者身体状态好转,改善患者的生活质量。帕博利珠单抗最初主要应用于黑色素瘤治疗中,且单药方案在PD-L1表达>50%的患者中效果良好,其主要通过抑制PD-1与其配体结合发挥抑制癌细胞增殖的作用[15]。正常状态下,T淋巴细胞免疫应答机制主要受抗原呈递及协同刺激影响,受正性或负性刺激信号调控,T淋巴细胞活化处于动态平衡,可抵御外来抗原,并抑制自身免疫过度[16]。而在多种肿瘤组织中PD-1处于高表达状态,可与肿瘤表面配体PD-L1结合使肿瘤细胞逃逸免疫监视而大量复制和增殖,并诱导T淋巴细胞凋亡[17]。本研究联合帕博利珠单抗治疗,可阻断PD-1与肿瘤细胞表面配体结合,削弱对免疫功能的负性刺激,从而增强T淋巴细胞活性,调动机体自身免疫系统[18]。当患者机体免疫得以恢复时,不仅有助于机体功能状态好转,还能通过免疫监视及记忆发挥持久杀死癌细胞的作用,进而下调相关肿瘤标志物水平,延长患者的生存期[19]。本研究中两组的不良反应分级差异无统计学意义(P>0.05)。帕博利珠单抗作为PD-1抑制剂,是通过增强机体免疫实现抗肿瘤效果的,但也可能激发非特异性免疫,增加皮疹、内分泌紊乱等免疫相关不良反应。刘昭等[20]研究也显示,联合信迪利单抗治疗晚期胃癌未明显降低不良反应,与本研究结果一致。
本研究中,治疗前两组的大肠杆菌、双歧杆菌及乳杆菌与健康人群存在明显差异。李慧珍等[21]研究证实,相较于健康人群,胃癌患者肠道菌群丰度、多样性较低,与本研究结果相符。且消化系统手术会对肠道菌群平衡造成不同程度破坏,进一步加重肠道菌群失调[22]。肠道菌群与免疫存在相互作用的关系[23]。Mager等[24]研究发现,免疫检查点抑制剂可诱发肠道屏障功能降低,促使肠内杆菌代谢产物肌苷进入不同组织,进而强化细胞毒性T淋巴细胞的抗肿瘤效应。本研究结果显示,治疗后与对照组相比,观察组的大肠杆菌数量较低,双歧杆菌和乳杆菌数量较高(P<0.05),提示帕博利珠单抗联合治疗可调节肠道微生态平衡。其中双歧杆菌种群中部分菌株被证实可作为免疫调节剂,能介导免疫炎性反应,减轻细胞损伤[25]。本研究增加帕博利珠单抗治疗可能通过激活微生物免疫途径发挥辅助治疗作用,有助于预防PD,但具体作用机制还需要进一步研究探索。
本研究存在一定局限性。首先,本研究样本量较少,只测定了大肠杆菌、双歧杆菌及乳杆菌数量变化情况,并未展开更全面的菌群分析,研究它们之间的相互作用。其次,本研究为回顾性研究,在疾病诊断和药物治疗方面可能因管控差异导致分析偏倚。因此未来还需要进一步开展多中心、大样本量的前瞻性随机对照研究进行探索。
综上可知,帕博利珠单抗联合化疗在晚期胃癌患者中的应用效果良好,可下调肿瘤标志物水平,改善肠道菌群微环境,增强疗效,有助于提高患者的生活质量。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
冯惠枝:实验设计及验证,数据整理,实验数据分析,文章初稿撰写;
柳婧美:实验验证,数据整理,实验数据分析;
卜晓倩:文章审阅和修订。
[参考文献]
[1]YASUDA T, WANG Y A. Gastric cancer immunosuppressive microenvironment heterogeneity: implications for therapy development[J]. Trends Cancer, 2024, 10(7): 627-642.
[2]HOU W T, ZHAO Y Q, ZHU H. Predictive biomarkers for immunotherapy in gastric cancer: current status and emerging prospects[J]. Int J Mol Sci, 2023, 24(20): 15321.
[3]XU J M, JIANG H P, PAN Y Y, et al. Sintilimab plus chemotherapy for unresectable gastric or gastroesophageal junction cancer: the ORIENT-16 randomized clinical trial[J]. JAMA, 2023, 330(21): 2064-2074.
[4]LING Q, HUANG S T, YU T H, et al. Optimal timing of surgery for gastric cancer after neoadjuvant chemotherapy: a systematic review and meta-analysis[J]. World J Surg Oncol, 2023, 21(1): 377.
[5]YARCHOAN M, GANE E J, MARRON T U, et al. Personalized neoantigen vaccine and pembrolizumab in advanced hepatocellular carcinoma: a phase 1/2 trial[J]. Nat Med, 2024, 30(4): 1044-1053.
[6]WADDELL T, VERHEIJ M, ALLUM W, et al. Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Radiother Oncol, 2014, 110(1): 189-194.
[7]STEDMAN M R, WATFORD D J, CHERTOW G M, et al. Karnofsky performance score-failure to thrive as a frailty proxy?[J]. Transplant Direct, 2021, 7(7): e708.
[8]张 萍, 艾 斌. 实体瘤免疫治疗疗效评价标准[J]. 国际肿瘤学杂志, 2016, 43(11): 848-851.
ZHANG P, AI B. Efficacy evaluation criteria for immunotherapy in solid tumors[J]. J Int Oncol, 2016, 43(11): 848-851.
[9]朱春荣, 熊 峰, 朱彦博, 等. 贝伐单抗联合FOLFOX4或FOLFIRI方案治疗晚期结直肠癌的临床观察[J]. 江苏医药, 2012, 38(19): 2306-2307.
ZHU C R, XIONG F, ZHU Y B, et al. Clinical observation of bevacizumab combined with FOLFOX4 or FOLFIRI regimen in the treatment of advanced colorectal cancer[J]. Remote Sens Technol Appl, 2012, 38(19): 2306-2307.
[10] BANTA K L, XU X Z, CHITRE A S, et al. Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses[J]. Immunity, 2022, 55(3): 512-526.e9.
[11] SHITARA K, ÖZGÜROĞLU M, BANG Y J, et al. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2018, 392(10142): 123-133.
[12] 王俊松, 吕秀鹏. 卡培他滨、奥沙利铂联合帕博利珠单抗对进展期胃癌的疗效及安全性[J]. 实用药物与临床, 2022, 25(3): 217-220.
WANG J S, (LÜ/LV/LU/LYU) X P. Safety and efficacy of capecitabine, oxaliplatin combined with pembrolizumab in advanced gastric cancer[J]. Pract Pharm Clin Remedies, 2022, 25(3): 217-220.
[13] 李璐璐, 黄然欣, 张 蓉, 等. 信迪利单抗联合白蛋白紫杉醇对晚期胃癌血清肿瘤标志物水平及免疫功能的影响[J].临床和实验医学杂志, 2023, 22(22): 2384-2387.
LI L L, HUANG R X, ZHANG R, et al. Effect of sintilimab combined with albumin paclitaxel on serum tumor marker levels and immune function in advanced gastric cancer[J]. J Clin Exp Med, 2023, 22(22): 2384-2387.
[14] 邵化敏, 马锦程, 杨贺才. 血清TK1、CEA、CA19-9检测对胃癌的诊断价值及与其临床病理特征的相关性研究[J].实用癌症杂志, 2023, 38(5): 730-733.
SHAO H M, MA J C, YANG H C. Diagnostic value of serum TK1, CEA and CA19-9 detection on gastric cancer and their correlation with clinicopathological features of gastric cancer[J]. Pract J Cancer, 2023, 38(5): 730-733.
[15] ZHENG L, HU F, HUANG L, et al. Association of metabolomics with PD-1 inhibitor plus chemotherapy outcomes in patients with advanced non-small-cell lung cancer[J]. J Immunother Cancer, 2024, 12(4): e008190.
[16] AHMED A, TAIT S W G. Targeting immunogenic cell death in cancer[J]. Mol Oncol, 2020, 14(12): 2994-3006.
[17] XIONG G, CHEN Z, LIU Q W, et al. CD276 regulates the immune escape of esophageal squamous cell carcinoma through CXCL1-CXCR2 induced NETs[J]. J Immunother Cancer, 2024, 12(5): e008662.
[18] GOU M M, ZHANG Y, WANG Z K, et al. PD-1 inhibitor combined with albumin paclitaxel and apatinib as second-line treatment for patients with metastatic gastric cancer: a singlecenter, single-arm, phase Ⅱ study[J]. Invest New Drugs, 2024, 42(2): 171-178.
[19] ZHANG T Q, GENG Z J, ZUO M X, et al. Camrelizumab (a PD-1 inhibitor) plus apatinib (an VEGFR-2 inhibitor) and hepatic artery infusion chemotherapy for hepatocellular carcinoma in Barcelona Clinic Liver Cancer stage C (TRIPLET): a phase Ⅱ study[J]. Signal Transduct Target Ther, 2023, 8(1): 413.
[20] 刘 昭, 任玉川, 张亚鹏, 等. 信迪利单抗联合化疗对晚期胃癌患者近期疗效及血清CEA sTim-3 sLAG-3和T淋巴细胞亚群的影响[J]. 河北医学, 2024, 30(2): 335-340.
LIU Z, REN Y C, ZHANG Y P, et al. Effects of sintilimab combined with chemotherapy on short-term efficacy and serum CEA, sTim-3 sLAG-3 and T lymphocyte subsets in patients with advanced gastric cancer[J]. Hebei Med, 2024, 30(2): 335-340.
[21] 李慧珍, 吴紫莹, 范婷婷, 等. 山西省东南部地区胃癌患者肠道菌群分布的配对病例对照研究[J]. 中国微生态学杂志, 2021, 33(8): 869-875.
LI H Z, WU Z Y, FAN T T, et al. A paired case-control study on the distribution of intestinal flora in patients with gastric cancer in southeastern Shanxi Province[J]. Chin J Microecol, 2021, 33(8): 869-875.
[22] PAN C L, ZHANG H W, ZHANG L Y, et al. Surgery-induced gut microbial dysbiosis promotes cognitive impairment via regulation of intestinal function and the metabolite palmitic amide[J]. Microbiome, 2023, 11(1): 248.
[23] WANG S, XU B L, ZHANG Y Y, et al. The role of intestinal flora on tumorigenesis, progression, and the efficacy of PD-1/PD-L1 antibodies in colorectal cancer[J]. Cancer Biol Med, 2023, 21(1): 65-82.
[24] MAGER L F, BURKHARD R, PETT N, et al. Microbiomederived inosine modulates response to checkpoint inhibitor immunotherapy[J]. Science, 2020, 369(6510): 1481-1489.
[25] ABDULQADIR R, ENGERS J, AL-SADI R. Role of Bifidobacterium in modulating the intestinal epithelial tight junction barrier: current knowledge and perspectives[J]. Curr Dev Nutr, 2023, 7(12): 102026.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#晚期胃癌# #帕博利珠单抗#
1